大麦对大麦条纹病菌毒素胁迫的响应
2021-05-25孙莉莎司二静姚立蓉汪军成李葆春孟亚雄马小乐王化俊
孙莉莎,郭 铭,司二静,姚立蓉,汪军成, 李葆春,杨 轲,孟亚雄,马小乐,王化俊
(1.甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与种质创新重点实验室,甘肃兰州 730070;2.甘肃农业大学农学院,甘肃兰州 730070;3.甘肃农业大学生命科学技术学院,甘肃兰州 730070)
大麦(HordeumvulgareL.)属于禾本科一年生植物,是最早被驯化的作物之一。由于其具有早熟、耐盐、耐旱和耐贫瘠等特性,在世界各地均有种植,在中国已种植了数千年[1]。在世界耕作谷物中,大麦的种植总面积和产量位居第四,仅次于小麦、水稻和玉米;中国的大麦现多种植于淮河流域及其以北地区[2]。
大麦条纹病(barley leaf stripe )是由大麦条纹病菌Pyrenophoragraminea(anamorph Drechslea graminea)[(Rabenh.ex.Schlech.)Shoemaker]引起的以种子带菌为初侵染源的系统性病害[3]。大多数大麦种植都是自留种,受病菌侵染严重,虽然新品种在推广种植初期发病较轻,但随着种植年限增加,发病会逐渐严重[4]。大麦条纹病在世界范围内均有发生,甘肃省是在中国发病的主要地区之一[5]。Arabi等[6]研究发现,大麦条纹病菌毒性受1对显性基因控制。大麦条纹病菌属于植物病原真菌,其产生的毒素原初作用位点可能在寄主的细胞质膜上[7],这些毒素先破坏细胞质膜系统,使电解质渗漏增加,从而达到对寄主的破坏作用。影响病原菌致病力的因素主要有致病因子类型及其活性,酶、毒素、激素是病原菌的三大致病因子,病原菌产生的毒素或病原菌与寄主协同作用产生的有毒物质可以引起植物萎蔫并表现出组织坏死等症状[8]。研究发现,用病原菌毒素处理材料,可以快速筛选出抗病材料[9],这对植物的抗性鉴定及抗病育种有重要的意义。马莹莹等[10]研究表明,玉米在接种玉蜀黍尾孢菌毒素后,其叶片中防御酶活性升高,且在7 h时达到峰值,而丙二醛(malondialdehyde,MDA)含量降低。吴颖静等[11]研究表明,拟南芥被大丽轮枝菌侵染后,其胼胝质、活性氧含量和防御酶活性均升高。但关于大麦条纹病菌毒素与大麦生长及其防御酶活性关系的研究尚未见报道。鉴于此,本研究拟以20个大麦品种为供试材料,研究大麦条纹病菌毒素对大麦萌发、胚根和胚芽生长的影响,并对筛选出的强抗病性品种进行毒素胁迫下防御酶活性变化的研究,确定毒素胁迫处理的最适时间,筛选衡量大麦条纹病菌抗性水平的防御酶指标,以便在室内完成对大麦抗性品种的初步筛选及鉴定,为大麦条纹病菌抗性机制的研究和抗性品种的选育提供参考。
1 材料与方法
1.1 试验材料
供试大麦条纹病菌菌株QWC为强致病力型菌株[12]。供试大麦材料详见表1,均由甘肃省作物遗传改良与种质创新重点实验室麦类种质创新课题组提供。
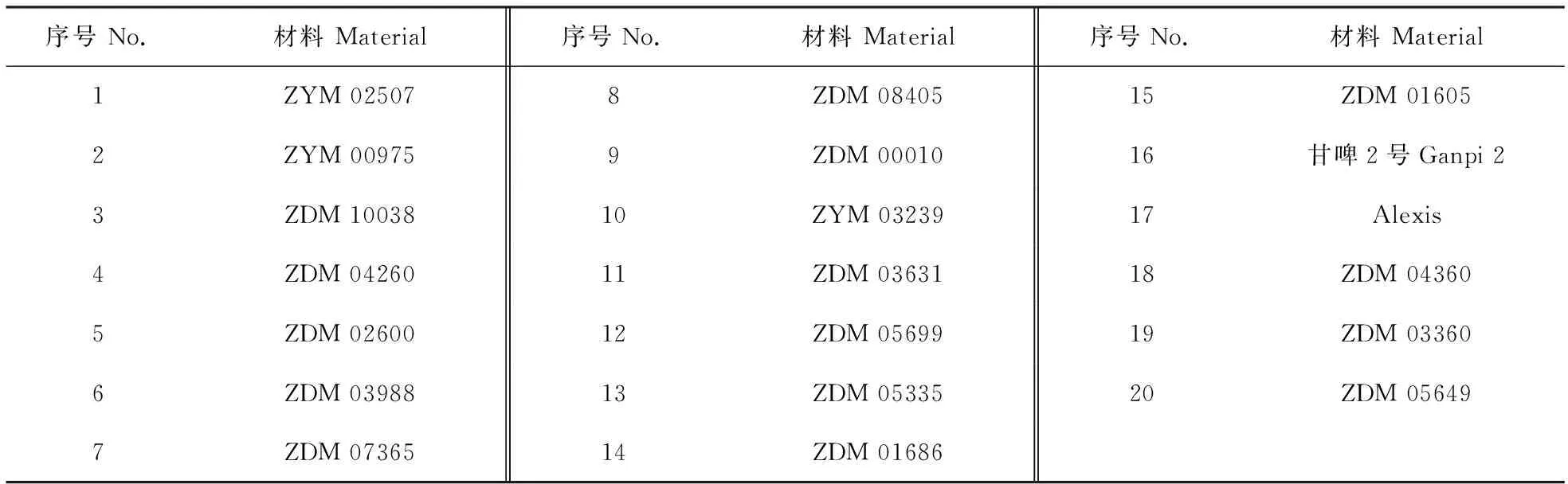
表1 供试大麦品种及品系Table 1 Barley varieties(lines) tested
1.2 方法
1.2.1 改良诱导培养基的制备
9 g蔗糖、5 g酒石酸铵、1 g NH4NO3、1 g K2HPO4、0.5 g MgSO4·7H2O、0.1 g NaCl、 0.13 g CaCl2·2H2O、18.3 mg FeSO4·7H2O、3.5 mg ZnSO4·7H2O、2 mg MnCl2·4H2O,蒸馏水定容至1 L。
1.2.2 大麦条纹病菌毒素液的制备
将低温保存的QWC菌株转接于PDA培养基上,22 ℃恒温培养7 d后,沿菌饼边缘打直径10 mm的菌饼,置于200 mL改良诱导培养基中培养21 d;培养液经无菌滤纸过滤后得到含QWC菌株代谢物的滤液。
1.2.3 菌株QWC的毒性测定
用叶脉注射器将4 mL 1.2.2中得到的滤液注入大麦幼苗植株中并做好标记,置于人工气候室中光(20 ℃)暗(12 ℃)各12 h交替培养,7 d后在标记处出现带状条纹说明所得滤液含有毒素,为毒素液。
1.2.4 供试材料抗性测定
用70%的乙醇处理大麦种子(每个材料对照和处理各30粒种子)30 s后,用5%的次氯酸钠处理5 min,经无菌水冲洗4次后彻底晾干(约3 h);将种子置于铺有两层滤纸的培养皿上,滤纸事先用毒素液或无菌水(对照)润湿,盖好盖子置于25 ℃培养箱培养。24 h、48 h、72 h后调查大麦种子萌发数;120 h后测种子萌发抑制率及胚根和胚芽生长抑制率[13]。3次重复。
萌发抑制率=(对照萌发数-处理萌发数)/对照萌发数×100%
胚根/胚芽生长抑制率=(对照胚根/胚芽长-处理胚根/胚芽长)/(对照胚根/胚芽长)×100%
1.2.5 大麦防御酶活性及代谢物相关指标测定
选择高抗大麦材料按照1.2.4中方法将种子培养48 h、 72 h、120 h、168 h后,每个处理分别采样5 g,置于-80 ℃保存备用。过氧化氢酶(CAT)采用紫外吸收法测定;过氧化物歧化酶(SOD)采用氮蓝四唑还原法测定;过氧化物酶(POD)采用愈创木酚比色法测定;游离脯氨酸(Pro)含量采用茚三酮法测定;丙二醛(MDA)含量采用硫代巴比妥酸比色法测定[14]。
1.3 数据统计分析
采用Excel 2010整理数据并作图,用SPSS 19.0对数据进行方差分析,运用Duncan’s检验法进行多重比较。
2 结果与分析
2.1 大麦条纹病菌培养液毒性测定
将含QWC代谢物的滤液注入大麦叶片7 d后发现,从叶片基部到叶尖出现多条与叶脉相平行的细长条纹,颜色呈黄褐色(图1)。这些症状与条纹病的发病症状相一致。因此,可以认为所得滤液对大麦有致病作用,为毒素液。
2.2 大麦条纹病菌毒素液对大麦种子生长的 影响
2.2.1 对大麦种子萌发的影响
萌发24 h和48 h时,毒素液处理大麦材料的外观与各自的对照无明显差异;萌发72 h和120 h时,毒素液处理材料胚根和胚芽的长势均明显较各自对照弱,说明大麦条纹病菌毒素对大麦萌发有一定抑制作用。部分材料处理与相应对照见图2。
2.2.2 供试大麦材料萌发及生长指标分析
根据种子萌发抑制率对20个材料进行聚类分析,结果如图3,当欧氏距离为15时,20个大麦材料被分为3类,Ⅰ型(1,5%)、Ⅱ型(12,60%)和Ⅲ型(7,35%)。对3个类型材料间的萌发和生长指标进行分析,结果(表2)发现,毒素下3个类型材料间的萌发抑制率、胚芽生长抑制率和胚根生长抑制率的差异均达显著水平, Ⅰ型、Ⅱ型和Ⅲ型分别为高抗型、中抗型和高感型。其中,高抗型仅包含一种材料,为甘啤2号。
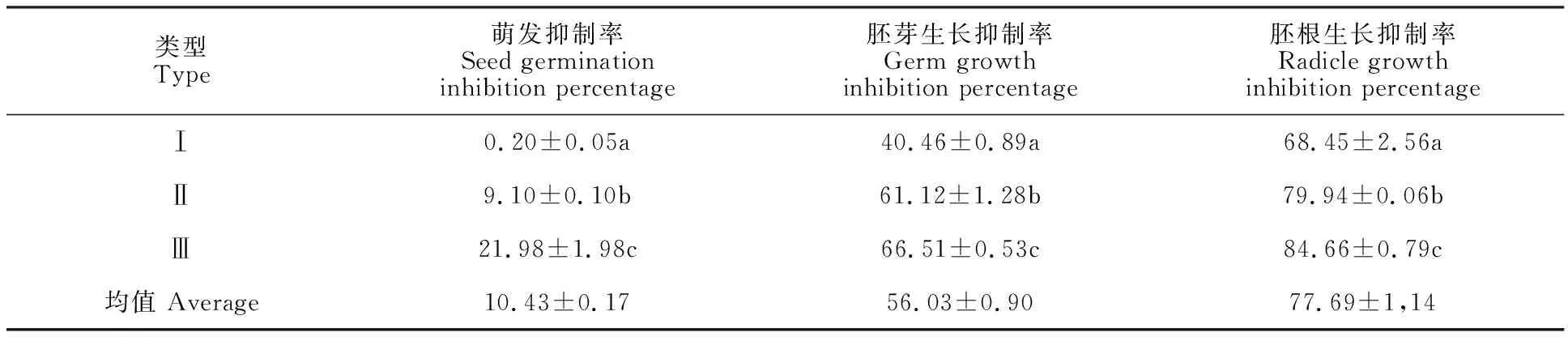
表2 毒素对不同类型大麦材料种子萌发及生长的影响Table 2 Effect of toxins on seed germination and growth of different types barley cultivars %
20个大麦材料在毒素液培养下的萌发抑制率、胚芽生长抑制率和胚根生长抑制率的平均值分别是10.43%、56.03%和77.69%,说明较胚芽而言,毒素液对胚根的抑制作用更强。
毒素对甘啤2号的萌发抑制率及胚芽、胚根生长抑制率相对于其他材料均为最低,因此,对甘啤2号在毒素胁迫下其体内防御酶活性及游离脯氨酸、丙二醛含量的变化进行进一步研究。
2.3 大麦条纹病菌毒素对甘啤2号生理指标的影响
2.3.1 对相关防御酶活性的影响
随着培养时间的延长,大麦中POD活性整体呈上升的趋势,毒素液培养48、72、120、168 h的甘啤2号中POD活性分别较对照增加了 6.72%、14.99%、25.50%、27.03%,其中,在 120 h和168 h时,处理间差异达到显著水平 (P<0.05)(图4A)。麦芽中SOD活性总体呈现先降低后升高的趋势,在72 h时达到最低;4个时间点处理间差异均达到显著水平(P<0.05);在120 h时,毒素液培养较对照的增幅最大,为 95.48%(图4B)。麦芽中CAT活性也随培养时间推移呈先降低后升高的趋势,在72 h时达到最低,处理间差异不显著,且显著低于其他时间点;在48 h、120 h和168 h时,毒素液培养与对照间差异均达显著水平(P<0.05);在168 h时,毒素液培养较对照的增幅最大,为49.63%(图4C)。
2.3.2 对游离脯氨酸(Pro)及丙二醛(MDA)含量的影响
随着培养时间的延长,甘啤2号的Pro含量整体呈上升趋势,且在各个时间点毒素液培养与无菌水培养间差异均显著(P<0.05);培养72 h后,Pro含量急剧增高,而在120 h之后增幅趋于平缓(图5A)。MDA含量随培养时间推移整体呈先上升后下降趋势,且在各个时间点,处理间均存在显著差异(P<0.05),以72 h时差异最大(图5B)。
3 讨 论
大量研究表明,大部分植物病原真菌可产生毒素,这些毒素会对植物种子萌发及生长产生抑制作用,如黑穗病病原菌可以破坏寄主的组织结构,造成寄主组织坏死、胼胝质沉积、电解质渗漏,影响糜子植株的正常生长[15]。田雪亮等[16]研究发现,黄瓜枯萎菌毒素对不同抗性品种的黄瓜胚根生长均有抑制作用,并且抑制作用会随处理浓度的增加而增强,但对抗病品种的抑制作用低于感病品种;杨继芝[17]认为,小麦胚根对禾谷镰刀菌毒素的敏感性大于胚芽。本研究与前人研究结果基本一致,大麦纹枯病菌毒素可抑制大麦种子的萌发和胚根、胚芽的生长。通过对供试材料的萌发抑制率进行聚类分析,可将20个大麦品种分为3类,高抗型占5%,中抗型占60%,高感型占35%;大麦纹枯病菌毒素对不同抗性类型间大麦种子的萌发抑制率和胚根、胚芽生长抑制率均存在显著差异。但车建美等[7]研究发现,黄瓜枯萎病菌粗毒素液对培养5~10 d的黄瓜种子的萌发具有明显的促进作用,对胚根也有促生长作用,并且粗毒素液处理黄瓜幼苗明显高于对照组。这与本研究结果不一致,其原因可能与病原菌及作物不同有关。
POD、SOD、CAT是植物体内清除活性氧自由基的重要酶,植物体内自由基清除或抗氧化能力的强弱可以由防御酶的活性高低直接反映,因此防御酶活性可作为植物抗逆性的指标[18]。植物在逆境胁迫下会产生大量Pro等有机物,以应对不良环境条件对植物生理代谢系统造成的损伤[19]。MDA的含量可以反映植物遭受逆境伤害的程度[20]。关于植物病原菌与植物防御酶活性的关系有很多报道,孙润红等[21]发现,感染枯草芽孢杆菌的小麦中POD、SOD以及CAT等防御酶活性有不同程度的提高。黄志磊[22]发现,受大麦叶斑病浸染的大麦中SOD、POD、CTA活性及Pro含量在各个时期均有所提高。杨继芝等[18]研究发现,禾谷镰刀菌粗毒素可使小麦抗病品种叶片中CAT活性增强,MDA含量下降。本研究中,受大麦条纹病菌毒素浸染后,甘啤2号的SOD、POD、CAT活性和Pro、MDA含量在处理间存在明显差异,在种子培养120 h和168 h时,被测指标在处理间均有显著差异。在培养72 h时,甘啤2号的SOD、CAT活性均达到最小值,而MDA含量达最大值,说明甘啤2号在种子萌发第72 h时防御酶活性及Pro、MDA含量变化较大。
本研究从生理方面研究了接种大麦条纹病菌毒素后,大麦幼苗生长及防御酶活性变化的关系。结果是否与大田生产一致还有待更多和长时间、多品种试验。大麦条纹病菌毒素对大麦防御酶活性的影响的分子机制还有待进一步研究。
