衰老标记蛋白30在不同月龄大鼠晶状体上皮细胞中的表达及其作用*
2021-05-25李思雨MahamaneDobyDjibril谢子康左慧懿唐承业唐东永
李思雨,王 洁,Mahamane Doby Djibril,谢子康,左慧懿,唐承业,唐东永,衷 昕,梁 皓
(广西医科大学第一附属医院眼科,南宁 530021)
衰老标记蛋白30(SMP30)是一种随年龄增长而逐渐减少的钙调节蛋白[1],其含量不受性别因素的影响,是一种新型的抗衰老因子[2]。目前对SMP30 的研究主要集中在肝、肾及心脏等领域,并发现其具有抗细胞凋亡、抗氧化损伤、调控细胞增殖、参与维生素C合成、维持细胞内钙离子稳态等作用[3-7]。但目前有关SMP30 在晶状体上皮细胞(LECs)中的表达情况及其作用鲜少报道。本研究通过观察大鼠自然衰老过程中晶状体形态变化和LECs 凋亡情况,并检测不同月龄大鼠LECs 中SMP30 的表达,以明确大鼠LECs 中SMP30 的表达与年龄的关系,为研究SMP30 在LECs 中的作用提供新的方向。
1 材料与方法
1.1 实验动物 24 只不同月龄(0~1 月龄8 只、8~9月龄16 只)SPF 级Wistar 大鼠购于北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006。所有大鼠均饲养于SPF 级动物房内,给予常规固体饲料,自由饮水。本研究动物实验已取得广西医科大学实验动物伦理委员会批准,审批号:201909018。
1.2 实验分组及自然衰老动物模型的建立 将大鼠按照鼠龄分为3组:1~2月龄组、9~10月龄组、18~19月龄组。首先购买8只8~9月龄大鼠,饲养至17~18月龄时,再次购买8只8~9月龄和8只0~1月龄大鼠,均继续饲养1 个月,即获得18~19 月龄、9~10 月龄、1~2月龄的3组大鼠。
1.3 晶状体形态观察 腹腔注射10%水合氯醛麻醉大鼠,用美丽多复方托吡卡胺滴眼液对大鼠进行散瞳,共滴两次,每次间隔5 min。通过裂隙灯观察晶状体是否浑浊并拍照。
1.4 血清氧化应激指标水平检测 大鼠深度麻醉后开腹,通过腹主动脉取血,静置30 min后离心,取上层血清,检测血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)活性和丙二醛(MDA)含量。试剂盒均购于南京建成生物工程研究所,检测过程严格按照试剂盒说明书进行操作。
1.5 TUNEL 法检测大鼠LECs 凋亡 麻醉处死大鼠后迅速摘取眼球,置于甲醛溶液中固定24 h,石蜡包埋,5 μm 连续切片。切片经脱蜡、水化、洗涤、蛋白酶K工作液消化、破膜工作液破膜处理,按照TUNEL 试剂盒说明书(Servicebio 公司)配置TUNEL反应液,染色及血清封闭过程严格按照试剂盒说明书进行操作,最后DAB显色、苏木精复染后,脱水封片。显微镜下观察染色结果,凋亡细胞核被染成棕黄色,正常细胞核呈蓝色。选取晶状体前囊膜区域,Image-Pro Plus 6.0软件计算细胞凋亡率,细胞凋亡率=LECs凋亡细胞数目/LECs总数×100%。
1.6 间接免疫荧光法检测大鼠LECs 中SMP30 蛋白表达 切片脱蜡、水化、EDTA 抗原修复、PBS 洗涤,BSA 封闭30 min,弃去BSA,放入湿盒中,加SMP30 鼠单克隆抗体(Santa Cruz Biotechnology 公司),存放于4°C 冰箱中孵育过夜。用PBS 洗后加相应二抗室温下避光孵育50 min,PBS洗涤,加DAPI,10 min后PBS洗涤,封片。荧光显微镜下观察染色结果,选取晶状体前囊膜区域拍照,使用Image J软件计算荧光强度。荧光强度越高,表示SMP30蛋白表达越高。
1.7 统计学方法 采用SPSS 23.0统计软件进行数据分析。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 3组血清中SOD、GSH-PX活性和MDA含量比较 随着大鼠月龄的增长,其血清中SOD 和GSHPx活性呈降低趋势,而MDA含量呈升高趋势。18~19 月龄组SOD 活性低于9~10 月龄组和1~2 月龄组,GSH-PX 活性显著低于1~2 月龄组,MDA 含量明显高于9~10 月龄组和1~2 月龄组(均P<0.05);9~10月龄组GSH-PX活性明显低于1~2月龄组(P<0.05),而SOD活性和MDA含量与1~2月龄组比较,差异无统计学意义(P>0.05),见表1。
表1 3组大鼠血清SOD、GSH-PX活性和MDA含量比较

表1 3组大鼠血清SOD、GSH-PX活性和MDA含量比较
与1~2月龄组比较,*P<0.05;与9~10月龄组比较,#P<0.05。
2.2 晶状体形态学观察 散瞳后通过裂隙灯观察显示3组大鼠晶状体均透明,见图1。
2.3 3 组细胞凋亡率比较 1~2 月龄组、9~10 月龄组、18~19 月龄组大鼠LECs 凋亡率分别为(27.51±9.39)%、(32.84±3.76)%、(45.50±9.18)%,18~19 月龄组大鼠LECs 凋亡率显著高于1~2 月龄组和9~10月龄组(P<0.05),1~2 月龄组与9~10 月龄组比较,差异无统计学意义(P>0.05),见图2。
2.4 大鼠LECs 中SMP30 蛋白的表达 SMP30 在3组晶状体囊膜LECs中均呈阳性表达,FITC染色呈绿色荧光。1~2月龄组、9~10月龄组、18~19月龄组大鼠LECs 中SMP30 表达的荧光强度分别为4.36±1.98、2.73±1.14、0.75±0.39,组间两两比较,差异均有统计学意义(均P<0.05),其中1~2月龄组荧光强度最高,9~10月龄组次之,18~19月龄组最低,见图3。
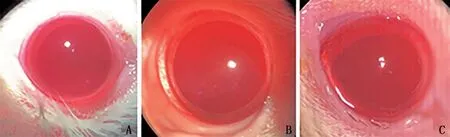
图1 3组大鼠晶状体裂隙灯下形态学观察图像

图2 TUNEL染色观察3组大鼠LECs凋亡情况(×400)
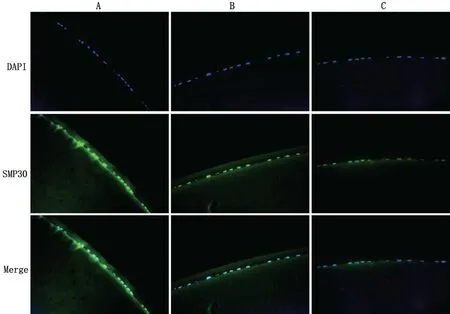
图3 间接免疫荧光法染色观察3组大鼠LECs中SMP30蛋白表达(×400)
3 讨论
Wistar 大鼠是生物医学研究中常用的实验动物,具有饲养简单、容易繁殖、机体生理病理变化和代谢类型与人类比较接近等特点。大鼠的鼠龄与人的年龄有一定对应关系,即1 月龄左右大鼠相当于人的幼年阶段,6 月龄左右大鼠相当于人的青年阶段,12 月龄左右大鼠相当于人的成年阶段,大于18月龄大鼠相当于人的老年阶段[8]。本实验大鼠长时间饲养过程中可能会受到饲养环境、自身疾病等无法控制因素的影响,与研究目的综合考虑,选择把大鼠分为1~2 月龄组、9~10 月龄组和18~19 月龄组3组,模拟人的自然衰老过程,建立大鼠自然衰老模型,研究在大鼠自然衰老过程中,血清和晶状体衰老指标的改变以及LECs中SMP30的表达变化。
衰老的机制十分复杂,研究者提出机体内自由基代谢紊乱、细胞衰老、基因组不稳定、端粒缩短及表观遗传学改变等均为衰老形成的重要因素[9],其中氧自由基学说是发展较早、学界接受度较高的一种衰老理论,此理论指出氧化应激是导致衰老的重要原因。细胞内活性氧(ROS)的生成能力与清除能力处于动态平衡中,若二者失去平衡,将导致氧化应激[10]。SOD 与GSH-PX 是细胞内的抗氧化剂,通过清除细胞内的氧自由基来发挥抗氧化作用[11]。ROS 产生过多会导致细胞脂质过氧化,造成MDA等脂质过氧化物堆积,使细胞受损、生命活力低下,导致器官功能不断减退,机体逐渐进入衰老阶段[12]。因此,在衰老动物体内,SOD、GSH-PX 的活性较低,MDA 的含量较高。目前常用MDA、SOD和GSH-PX 等指标验证衰老模型的建立是否成功。本研究结果显示,随着大鼠月龄的增长,其血清中SOD 和GSH-Px 活性降低,MDA 含量升高(P<0.05)。结果表明,本实验的自然衰老模型构建成功。
SMP30 是一种随年龄增长而逐渐减少的钙调节蛋白[1],其含量不受性别因素的影响,是一种新型的抗衰老因子[2]。近年来研究发现,SMP30 的表达与LECs 的凋亡相关。在临床研究中,SMP30 在人晶状体前囊膜LECs 周边部表达较强,中央部表达较弱,LECs 的凋亡程度与SMP30 的表达呈负相关关系[13-14]。在细胞体外培养研究中,人LECs 系SRA01/04 细胞在正常培养状态下,下调SMP30 的表达可使细胞凋亡率升高[15];在高钙及氧化状态下,SMP30 对SRA01/04 细胞可产生促增殖、抗氧化及抗凋亡的保护作用,且与表达量呈正相关关系[16-19]。本研究探讨SMP30 在不同月龄大鼠LECs中的表达变化,发现在大鼠自然衰老模型中,随着月龄的增加,尽管大鼠晶状体未出现形态学改变,但其LECs 的凋亡程度加重,SMP30 表达量已经减少,由此推测,在大鼠衰老的过程中,SMP30可能作为一种保护性蛋白,参与了LECs的细胞损伤进程,起到一定程度的抗凋亡作用。本实验的不足之处在于仅从细胞层面检测到LECs 的凋亡变化,没有观察晶状体形态学的改变,可能由于大鼠个体差异大、月龄不够大或者LECs 代谢障碍程度尚未超过SMP30 对LECs 的保护作用等,具体因素还需后续研究。
综上所述,随着大鼠月龄的增加,其LECs凋亡增加,SMP30表达降低,提示SMP30可能是LECs的保护因子,在大鼠衰老过程中具有抗LECs 凋亡的保护作用。但是,SMP30 对LECs 发挥保护作用的具体机制仍有待进一步研究。未来,本组拟通过改变大鼠眼内SMP30 的表达量,进一步观察SMP30抗凋亡、抗氧化和维持细胞内钙离子稳态等方面的调控作用。
