9株昆虫病原线虫共生菌菌株的分离、鉴定及其抗菌谱的筛选
2021-05-24张潘杰窦振国王浩包浩然张克云
张潘杰,窦振国,王浩,包浩然,张克云
(南京农业大学生命科学学院,江苏 南京 210095)
昆虫病原线虫(entomopathogenic nematode,EPN),又称昆虫寄生线虫。在自然状态下,EPN侵染期幼虫(infected juveniles,IJ)肠道内携带有与其稳定共生的细菌[1]。对于EPN来说,这种共生关系是单一的,虽然1种细菌可以与多种EPN共生,但每种EPN只能与1种细菌共生。肠杆菌科(Enterobacteriaceae)的致病杆菌属(Xenorhabdus)和发光杆菌属(Photorhabdus)分别与斯氏线虫科(Steinernematidae)和异小杆科(Heterorhabditida)的EPN共生[2-5]。EPN共生菌最早发现于20世纪60年代,晚于肠杆菌科的大部分属,是肠杆菌科的一个特殊菌属[6]。起初关于共生菌的种属确定主要基于菌落形态、生理生化特征的差异[7],但仅仅依靠这类特征具有一定的局限性和不稳定性。20世纪80年代以后,分子生物学技术逐渐被应用于共生菌种属确定工作中,使EPN共生菌的分类准确性更高,特异性更强[7-9]。
近年来,研究表明EPN共生菌除具有昆虫毒性外,在体外培养时对植物真菌有较强的抑制能力[10-14]。与杀虫效果受线虫携带率和线虫自身侵袭力影响不同,抗真菌效果与共生菌自身特性关联更强,将成为EPN共生菌资源开发利用的主要研究方向。前人研究也发现,EPN共生菌对真菌的抑菌效果受各种环境因素的影响,不同菌株的抑菌效果差异也较大[14-18]。因此,优质菌株资源的筛选是后期研究的基础。
稻瘟病、西瓜枯萎病、黄瓜枯萎病、灰霉病与辣椒疫霉病都是长江中下游平原地区农业生产上常见的病害,每次流行都会给农业经济带来巨大损失[19-21]。近年来新型农药的开发大多将以上5种真菌病害列为防治重点,其中西瓜枯萎病与黄瓜枯萎病的病原菌尖孢镰刀菌又因其孢子的环境耐受力强,更成为植物真菌病害防治领域的重点与难题。目前,抑制菌丝生长和分生孢子萌发是防治土传镰刀菌病害的重要手段,而且关于昆虫病原线虫共生细菌对以上5种病原真菌的综合抑制作用尚未见报道。
本研究采用3种方法分离EPN共生菌,比较它们的分离效果;利用最佳分离方法分离9株EPN的共生菌;基于16S rDNA序列信息验证9种共生菌的种属。以稻瘟菌、尖孢镰刀菌西瓜专化型、尖孢镰刀菌黄瓜专化型、灰葡萄孢、辣椒疫霉为供试真菌测试共生菌的抑菌谱,筛选综合抑制效率最高的菌株。研究结果将为防治植物病原真菌的研究提供技术支撑及优质的菌株资源。
1 材料与方法
1.1 试验材料
9种EPN由加州大学河滨分校的Adler R. Dillman 博士惠赠。其中,7种为斯氏线虫科,分别是Steinernemacarpocapsae、S.costaricense、S.glaseri、S.oregonense、S.riobrave、S.texanum、S.innexi,其共生菌株分别编号为NN1、NN2、NN4、NN6、NN7、NN8、NN20;2种为异小杆科线虫,分别是Heterorhabditisbacteriophora和H.megidis,其共生菌株分别编号为NN11和NN13。用于培养和繁殖线虫的昆虫为市售的大蜡螟(Gallermellonella)5龄幼虫。稻瘟病菌(Guy2)、尖孢镰刀菌西瓜专化型(FON1)、尖孢镰刀菌黄瓜专化型(NFOC1)、灰葡萄孢菌(NBC1)和辣椒疫霉(NPC1)保存于本实验室。
1.2 培养基的配制
NBTA(丙酮酸钠)培养基:胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化钠10 g·L-1,琼脂15 g·L-1,溴百里酚蓝(BTB)0.025 g·L-1,丙酮酸钠1 g·L-1,氯化三苯基四氮唑0.04 g·L-1。LB(丙酮酸钠)培养基:胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化钠10 g·L-1,丙酮酸钠1 g·L-1。NA(丙酮酸钠)培养基:牛肉提取物3 g·L-1,胰蛋白胨5 g·L-1,营养琼脂20 g·L-1,丙酮酸钠1 g·L-1。摇瓶发酵(YS)培养基:磷酸二氢铵0.5 g·L-1,磷酸氢二钾0.5 g·L-1,七水合硫酸镁0.2 g·L-1,氯化钠5 g·L-1,酵母提取物5 g·L-1。PDA培养基:称取200 g新鲜马铃薯碎块,加水1 000 mL煮沸30 min,滤液中加入20 g·L-1的葡萄糖,15 g·L-1的琼脂。V8培养基[22]:将1 g碳酸钙加到100 mL V8果蔬汁中,充分混合,5 000 r·min-1离心20 min,用ddH2O将上清液稀释10倍,然后加入15 g·L-1琼脂。所有培养基调节pH 值为7.0~7.4。
1.3 共生菌的分离
1.3.1 研磨法在直径6 cm的培养皿中垫入1层滤纸,加入350 μL无菌水,保持滤纸湿润,再加入100条侵染期幼虫(infective juveniles,IJ),放入5头新鲜健康的大蜡螟5龄幼虫自然侵染。2~3 d后大蜡螟被侵染致死,7~9 d直至虫尸风干,用White trap法收集从虫尸中释放出的新一代IJ。取约100条IJ加入1.5 mL无菌离心管中,加入无菌水洗涤2~3次,自然沉淀后弃上清液,加入200 μL 100 mg·L-1的硫柳汞溶液浸泡10 min,瞬时离心后除去上清液,用林格氏缓冲液洗涤2次。再加入150 μL 100 mg·L-1放线菌酮溶液和150 μL 100 mg·L-1硫酸链霉素溶液浸泡8 min,瞬时离心后除去上清液,用林格氏缓冲液洗涤3次。最后1次洗涤后,保留约80 μL的液体。混匀后吸出线虫悬液,加入无菌研钵中充分研磨5~10 min,将研磨液吸出并均匀滴加到NBTA平板上,用接种环进行四区划线接种,28 ℃下避光培养48 h[23]。
1.3.2 血淋巴涂布法在直径6 cm的培养皿中垫入1层滤纸,加入350 μL无菌水,保持滤纸湿润,再加入100条IJ。放入5头新鲜健康的大蜡螟5龄幼虫自然侵染,18~24 h后用镊子夹出大蜡螟,用70%(体积分数)乙醇进行体表消毒30 s,重复2次。再用无菌剪刀剪去大蜡螟的第5或第6对腹足,用移液枪吸取渗出的20 μL血淋巴液滴入NBTA平板培养基中,用接种环进行平行划线接种,28 ℃下避光培养48 h[24]。
1.3.3 改良涂布法在直径6 cm的培养皿中垫入1层滤纸,加入350 μL无菌水,保持滤纸湿润,再加入100条IJ。放入5头新鲜健康的大蜡螟5龄幼虫自然侵染,约48 h后可观察到大蜡螟开始死亡,将死亡后6 h的大蜡螟用镊子夹出,用70%乙醇进行体表消毒30 s,重复2次。用镊子夹住大蜡螟头部,然后用无菌剪刀在第5或第6对腹足处剪断虫体,用虫体截面在NBTA培养基不同区域上点蘸6~8次,28 ℃避光培养48 h。
1.4 16S rDNA的PCR扩增与系统进化树的构建
挑取NBTA平板上蓝绿色的初生型单菌落接种入20 mL NB培养基,180 r·min-1、28 ℃培养18 h。用苯酚、氯仿和异戊醇(V∶V∶V=1∶1∶1)的混合物提取细菌基因组DNA。用异丙醇沉淀DNA后,用TE缓冲液溶解。16S rDNA扩增的PCR引物序列为16S-Forward:5′-GGGGGATAACCACTGGAAACGG-3′;16S-Reverse:5′-CCACATCTCTACGCATCTCACC-3′。PCR程序:94 ℃ 5 min;94 ℃ 60 s,54 ℃ 60 s,72 ℃ 90 s,循环35次;72 ℃ 10 min。
PCR产物送安徽通用生物系统有限公司测序。将16S rDNA序列与从GenBank获得的16株致病杆菌和5株发光杆菌的16S rDNA序列进行比较。采用MEGA 7.0软件进行多序列同源性分析,采用邻接法(Neighbor-joining method,NJ法)构建系统进化树[25]。
1.5 共生菌发酵液的制备
从分离到的共生细菌中挑取初生型单菌落(蓝绿色),接种到LB液体培养基中,180 r·min-1振荡培养24 h。取新鲜菌液以5%的接种量转移到YS液体培养基中,180 r·min-1振荡培养24 h制备种子液,将种子液以5%的接种量转移到新的YS液体培养基中,180 r·min-1振荡培养72 h完成发酵。细菌培养的所有过程均在28 ℃下进行[26]。
1.6 发酵液组分的分离与倍比稀释
1.6.1 共生菌代谢物(或无菌滤液)的分离NN6与NN8发酵完成后,将发酵液在10 000 r·min-1离心30 min,吸取上清液,用针式过滤器(滤膜孔径<0.22 μm)进行过滤除菌。所得到的滤液于10 000 r·min-1离心10 min,细胞沉淀后用上清液涂布LB平板,24 h后进行菌落计数,小于102CFU·mL-1时可将上清液认定为无菌滤液。
1.6.2 共生菌细胞悬液的制备将所获得的菌细胞沉淀物用与离心前发酵液等体积的无菌水重悬,制成菌细胞悬液。
1.6.3 共生菌代谢物(或无菌滤液)和细胞悬液的稀释将发酵液、菌细胞悬液、无菌滤液采用倍比稀释法稀释至1、2、5和10倍。发酵液和菌细胞悬液浓度用D600和CFU值标定。
1.7 菌丝生长抑制效率的测定
采用平板菌丝抑制法测定发酵液、菌悬液和无菌滤液对真菌菌丝生长的抑制效率[10]。将5 mL处理液(发酵液、菌悬液或无菌滤液)分别添加到43 mL PDA或V8固体培养基中,以无菌YS培养基作为对照,加入处理液时PDA或V8培养基的温度应降至42 ℃左右并保持液态。混合摇匀后制成3个完全相同的平板,从培养5~7 d的真菌菌落边缘切下直径为7.5 mm的菌饼,置于混有处理液的平板中央。25 ℃避光培养6 d,测量菌落直径,计算生长抑制效率,5个生物学重复。抑制效率(C)的计算公式:C=[(b-7.5)-(a-7.5)/(b-7.5)]×100%。式中:a为处理组的菌落直径(mm);b为对照组的菌落直径(mm)。
1.8 分生孢子萌发抑制效率试验[27]
采用凹玻片法测定发酵液、菌悬液和无菌滤液对镰刀菌分生孢子萌发的抑制作用。从PDA平板上培养4 d的镰刀菌菌落边缘打下4个直径7.5 mm的菌饼加入PDB培养基中,180 r·min-1避光振荡培养96 h获得分生孢子悬液。分生孢子悬液用6层纱布过滤,再将滤液1 000 r·min-1离心5 min,弃去上清液,加入ddH2O并再次离心,最后用ddH2O将分生孢子重悬至1×106CFU·mL-1。将10 μL分生孢子悬液滴到凹玻片中心,加入10 μL处理液(发酵液、菌悬液或无菌滤液),最后加入10 μL 5 g·L-1葡萄糖溶液,充分混合。将凹玻片置于浅水培养皿中,25 ℃避光培养9 h,用10 μL无菌水和10 μL 5 g·L-1葡萄糖溶液作为对照。当对照组萌发率达到90%以上时,随机选择视野检查各处理组孢子萌发情况,每一组的调查总数不少于100,分别记录分生孢子总数和萌发数。当分生孢子芽管长度大于分生孢子短半径即为萌发。根据公式(1)计算分生孢子萌发率(R)。根据公式(3)计算相对萌发抑制效率(I)。
R=Ng/Nt×100%
(1)
Rg=Rt/R0×100%
(2)
I=(R0-Rg)/R0×100%
(3)
式中:Ng代表已萌发的分生孢子数;Nt代表调查的分生孢子总数;Rg代表经过处理校正后的分生孢子萌发率;Rt代表处理分生孢子萌发率;R0代表对照分生孢子萌发率;I代表分生孢子萌发的相对抑制效率。
1.9 数据分析
采用Excel 2013软件进行数据处理,用Graphpad Prism 7.0c软件绘图,用SPSS 24.0软件对数据进行差异显著性和回归分析。
2 结果与分析
2.1 3种方法分离效果的比较
2.1.1 研磨法将S.caporcapsae的IJ充分研磨后的匀浆液滴加于NBTA平板,分离共生菌。结果(图1-A)表明:本法分离效率较低,平板上分布有少量初生型单菌落和IJ残体,平均每次可分离出8.2个单菌落,每微升线虫匀浆液分离出0.1个单菌落,杂菌率低。

图1 3种分离方法获得共生菌的菌落形态Fig.1 Colony morphology of symbiotic bacteria obtained by three isolation methodsA. 研磨法Grinding method;B. 血淋巴涂布法Hemolymph coating method;C. 改良涂布法Modified hemolymph coating method.
2.1.2 血淋巴涂布法将被EPN侵染18 h后的大蜡螟的血淋巴液滴加于NBTA平板。结果(图1-B)表明:本法分离效率较高,平板上初生型菌落多,平均每次可分离出67.7个单菌落,每微升血淋巴液可分离出3.4个单菌落,且杂菌率低。由于血淋巴液在体外发生黑化反应,不利于观察和挑取单菌落。
2.1.3 改良涂布法大蜡螟被EPN侵染死亡6 h后,用其尸体截面点蘸NBTA平板。结果(图1-C)表明:本法分离效率高,平板上初生型菌落多,平均每次可分离出124.0个单菌落,且杂菌率低,无黑化反应发生,培养基上易于观察。培养基中的BTB被初生型菌落吸收,平板颜色变浅。
2.2 共生菌16S rDNA的扩增与系统进化树的构建
2.2.1 共生菌菌株的分离与16S rDNA的扩增利用改良涂布法从EPN中分离到9株共生菌,用单菌落在NBTA平板上划线培养纯化(图2)。提取单菌落基因组DNA后进行PCR扩增与琼脂糖凝胶电泳检测。结果显示:共生菌16S rDNA扩增片段长度约为1 500 bp,连接pMD19-T质粒后,菌落PCR扩增片段长度约为1 500 bp(图3)。
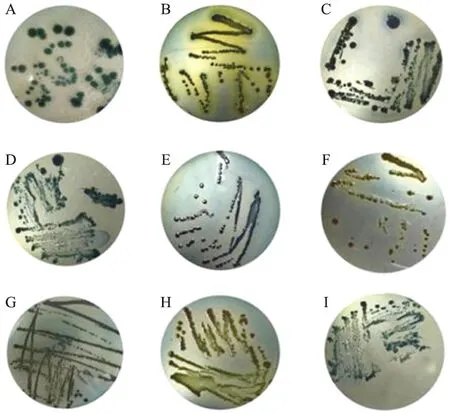
图2 共生菌在NBTA平板上的菌落形态Fig.2 Colony growth morphology of symbiotic bacteria on NBTA plate A. X.nematophila NN1;B. X.koppenhoeferi NN2;C. X.poinarii NN4;D. X.bovienii NN6;E. X.cabaniltasii NN7;F. X.bovienii NN8;G. P.luminescens NN11;H. P.temperata NN13;I. X.bovienii NN20.

图3 16S rDNA扩增片段的电泳检测Fig.3 Agarose gel electrophoresis of 16S rDNAA. 16S rDNA的电泳检测 Agarose gel electrophoresis of 16S rDNA;B. 菌落PCR产物的电泳检测 Agarose gel electrophoresis of colony PCR products. M. DL5000TM DNA marker.
2.2.2 基于16S rDNA序列的系统进化树构建基于16S rDNA序列的同源性分析验证9株共生菌的种属,NN1为X.nematophila,与X.nematophilastrain ATCC 19061的序列相似度达99%;NN2为X.koppenhoeferi,与X.koppenhoeferistrain USNJ01的序列相似度达99%;NN4为X.poinarii,与X.poinariistrain Iran2的序列相似度达94%;NN6为X.bovienii,与X.bovieniistrain USAR01的序列相似度达99%;NN7为X.cabaniltasii,与X.cabaniltasiistrain USTX62的序列相似度达99%;NN8为X.bovienii,与X.bovieniistrain Kamchatka的序列相似度达99%;NN11为P.luminescens,与P.luminescensstrain VITICRI的序列相似度达94%;NN13为P.temperata,与P.temperatastrain SN187的序列相似度达100%;NN20为X.bovienii,与X.bovieniistrain SLK-1的序列相似度达99%。利用MEGA 7.0的邻接法构建的基于16S rDNA序列的系统发育树见图4。

图4 基于16S rDNA序列构建的系统进化树Fig.4 Phylogenetic tree based on 16S rDNA sequence
2.3 共生菌对植物病原真菌菌丝生长的抑制效率
从图5可知:9株共生菌对植物病原真菌有不同程度的抑菌作用。NN6对Guy2菌丝生长的抑制效率为93.57%,对NBC1和NPC1菌丝生长的抑制效率分别为63.81%和77.31%,对FON1和NFOC1的抑制效率为62.30%和56.12%,优于其他测试菌株。NN8与NN6的抑制效率相似,但稍弱于NN6。其余7株共生菌的抑真菌能力较为一致,在对不同真菌的处理中各有优势。将共生菌对真菌的抑制效率划定为等级范围,从表1可知,NN6与NN8是综合抑制效率最高的2株共生菌。

图5 共生菌对真菌的抑制效率(左)及真菌菌落大小(右)Fig.5 Inhibition rate of symbiotic bacteria on fungi(left)and morphologic of fungal colonies(right)Cuy2. 稻瘟病菌Magnaporthe grisea;FON1. 尖孢镰刀菌西瓜专化型Fusarium oxysporum f. sp. niveum;NFOC1. 尖孢镰刀菌黄瓜专化型Fusarium oxysporum f. sp. cucu mbrum;NBC1. 灰葡萄孢菌Botrytis cinerea;NPC1. 辣椒疫霉Phytophthora capsici.

表1 9株昆虫病原线虫共生菌对5种病原真菌的拮抗作用Table 1 Antagonistic effects of 9 EPN symbiotic strains against 5 pathogenic fungi
2.4 NN6和NN8发酵液、菌悬液和无菌滤液的稀释液对真菌的抑制效率
根据NN6和NN8发酵液的吸光值测定结果与其稀释平板涂布法统计结果,得出稀释倍数与D600、CFU值的对应关系。发酵原液的D600值为0.820,菌体数量为2.7×107CFU·mL-1;2倍稀释液的D600值为0.435,菌体数量为1.45×107CFU·mL-1;5倍稀释液的D600值为0.153,菌体数量为5.13×106CFU·mL-1;10倍稀释液的D600值为0.058,菌体数量为1.97×106CFU·mL-1。
9株共生菌发酵液对5种真菌的拮抗作用测试结果均高于45%,NN6和NN8的综合抑制效率最高。为了进一步比较这2株共生菌的生防潜力,将NN6和NN8发酵液离心过滤,获得菌悬液和无菌滤液,5倍稀释液的菌体数量接近微生物菌剂的常用浓度(5.0×106CFU·mL-1)。
2.4.1 对真菌菌丝生长的抑制效率从图6可知:NN6和NN8发酵液、菌悬液和无菌滤液在5倍稀释后对5种真菌的菌丝生长均有抑制作用。在对Guy2、FON1、NFOC1和NBC1的抑菌试验中,NN6发酵液的抑制效率分别为23.25%、16.70%、26.80%和27.50%,NN8发酵液的抑制效率分别为22.30%、16.15%、23.00%和 23.00%,对同一真菌NN6与NN8发酵液的抑制效率均无显著性差异。而在NPC1的抑菌测试中,NN6发酵液的抑制效率为51.99%,显著高于NN8(45.46%)。在无菌滤液的抑菌效果对比发现,NN8对NFOC1的抑制效率为18.80%,显著高于NN6的5.90%,其他处理组无显著性差异。NN6菌悬液对5种真菌的抑制效率为9.70%~29.87%,NN8菌悬液对5种真菌的抑制效率为10.80%~31.82%。

图6 菌株NN6和NN8对植物病原真菌菌丝生长的抑制效率Fig.6 Inhibition rate of NN6 and NN8 on mycelium growth of plant pathogenic fungi1、4分别代表NN6和NN8无菌滤液的5倍稀释液;2、5分别代表NN6和NN8菌悬液的5倍稀释液;3、6分别代表NN6和NN8发酵液的5倍稀释液。1,4 represent 5-fold dilution of sterile filtrate of NN6 and NN8,respectively;2,5 represent 5-fold dilution of bacterial cell suspension of NN6 and NN8,respectively;3,6 represent 5-fold dilution of fermentation broth of NN6 and NN8,respectively.
2.4.2 对镰刀菌分生孢子萌发的相对抑制效率图7结果显示:共生菌的发酵液和无菌滤液对FON1分生孢子萌发均有抑制作用(图7-A),其中NN8发酵液的抑制效率为82.58%,与NN6发酵液的抑制效率(83.14%)无显著差异,而NN8无菌滤液的抑制效率达72.15%,显著高于NN6无菌滤液(46.69%)。5倍稀释后,发酵液与无菌滤液的抑制效果仍然存在,而菌悬液始终无抑制作用。在对NFOC1的抑制试验中,NN8发酵液的抑制效率为88.16%,显著高于NN6发酵液(81.79%),无菌滤液的抑制效率高于60%,但无显著差异(图7-C)。此外,NN8的菌悬液对分生孢子的萌发也表现出一定的抑制作用,抑制效率达19.19%。

图7 菌株NN6和NN8对镰刀菌属真菌分生孢子萌发的相对抑制效率Fig.7 Relative inhibition rate of NN6 and NN8 on conidia germination of Fusarium spp.左边表示抑制效率;右边表示萌发状态。NN6-5×、NN8-5×分别代表NN6和NN8发酵液各组分的5倍稀释液;NN6-1×、NN8-1×分别代表NN6和NN8发酵液的各组分。The left figures indicate the antifungal efficiency;The right figures indicate the germination status. NN6-5×,NN8-5× represent 5-fold dilution of NN6 and NN8,respectively. NN6-1×,NN8-1× represent 1-fold dilution of NN6 and NN8,respectively.
3 讨论
本研究采用3种方法从9种EPN中分离出共生菌,研磨法是比较传统的分离方法,但由于线虫IJ时期一般滞育不取食,体外包裹着体鞘,对不良环境的耐受能力强[28-29],增加了完全磨碎IJ的难度。本研究结果表明,研磨法分离到的单菌落数量较少,为了使体表消毒彻底,要从线虫的卵开始消毒,操作步骤多、繁琐,耗时。血淋巴涂布法是在线虫侵染大蜡螟18 h后,于无菌条件下采集大蜡螟的血淋巴液,并划线接种于NBTA平板。这种方法操作步骤少,不需要太多试剂与器材,但血淋巴液暴露在空气中会发生黑化反应[30],影响后续的观察与单菌落的选择。本研究在此基础上进行了优化,增加EPN的侵染时间,待昆虫被致死后直接从虫尸中分离共生菌,周期的增长也让昆虫体内的共生菌大量繁殖并成为优势菌群。结果表明,该方法高效可行,污染风险低,可为其他昆虫病原线虫共生菌的高效分离提供参考。
利用16S rDNA序列信息构建9株EPN共生菌的系统进化树,确定这些共生菌的种属,共生关系与前人报道的一致[31-32]。抗真菌试验结果表明,9株共生菌对5种植物病原菌均有不同的抑菌能力,其中NN6和NN8综合抑制能力最强。相比YL001和YL002菌株对于稻瘟菌的抑制效率都有显著优势,相比YL001对尖孢镰刀菌黄瓜专化型的抑制效率也更高[33]。Isaacson等[34]研究结果表明Xenorhabdussp. RIO对灰葡萄孢有较强抑制能力,但对尖孢镰刀菌无抑制效果。马丽丽等[35]筛选出的共生菌能抑制番茄叶霉病菌,但不抑制尖孢镰刀菌。能高效抑制本研究所测试的5种真菌的共生菌并不多见,因此NN6和NN8具有良好的研究价值。
本研究中,NN6和NN8发酵液、菌细胞悬液和无菌滤液对5种真菌的菌丝生长均有抑制作用,其中无菌滤液的抑菌效果与X.bovieniiSN52、SN269等菌株相似[36]。YL002菌株发酵液的抑制效率也显著高于其无菌滤液[10],这表明无菌滤液不是共生菌发酵液抑制效率的全部来源,但致病杆菌属和发光杆菌属细菌都未被报道具有类似于黏细菌属的捕食器[37],所以研究菌细胞发挥抑菌作用的途径或许需要对细菌表面微观结构进行进一步的解析。因镰刀菌孢子可以在植物病残体上或土壤中越冬[38],其引发的病害一直难以根除,而NN6和NN8的发酵液与无菌滤液对镰刀菌孢子的萌发抑制均表现出良好效果,对FON1和NFOC1分生孢子的相对抑制效率超过70%,其中NN8对NFOC1的孢子萌发抑制效果显著好于NN6。
综上所述,本研究分离得到的9株共生菌在镰刀菌等多种植物病原菌的生物防治中具有良好的应用前景和开发价值,X.bovieniiNN6对稻瘟菌、灰葡萄孢和辣椒疫霉的抑制效果最好,而X.bovieniiNN8对尖孢镰刀菌的生物防治效果最好。
