中性粒细胞与淋巴细胞比值、淋巴细胞与单核细胞比值、血小板与淋巴细胞比值对食管鳞癌患者预后的预测价值
2021-05-24段义龙郭长青曹新广刘虹彦王文佳
段义龙,郭长青,曹新广,刘虹彦,王文佳
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
食管鳞癌是上消化道的上皮源性恶性肿瘤之一,占我国食管癌组织分型的90%[1]。有关我国恶性肿瘤流行病学调查显示,食管癌的发病率位居第六,死亡率位居第四[2]。治疗食管癌的主要手段为根治性食管癌切除术和彻底的淋巴结清扫,但即使行治疗性切除,多数患者的总生存期并未延长。全身炎症反应与肿瘤的进展有关,宿主对肿瘤的炎症反应会导致肿瘤的增殖和转移[3-4]。作为反映炎症的血清学标志物,中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)与阴茎癌、非小细胞肺癌、胰腺癌、结肠癌等多种恶性肿瘤的预后有关[5-8]。然而,只有少数文献报道炎症标志物与食管鳞癌患者预后的关系[9]。本研究探讨NLR、LMR、PLR对食管鳞癌患者预后的预测价值。
1 资料与方法
1.1 病例资料选取2014年1月至2015年6月郑州大学第一附属医院收治的290例食管鳞癌患者。纳入标准:(1)经组织学证实的食管鳞癌;(2)术前7 d内行血常规检查;(3)随访资料完整。排除标准:(1)术前已行新辅助治疗;(2)术前证实有感染;(3)合并其他恶性肿瘤、自身免疫性疾病;(4)确诊前使用过促白细胞生成药物。根据UICC/AJCC第八版食管癌分期系统对淋巴结转移个数、肿瘤浸润深度、肿瘤分化程度进行分级。根据世界卫生组织对食管肿瘤的分类进行组织学分型。290例患者年龄35~86岁,中位年龄62岁,其他一般资料见表1。N3期患者仅有5例,故将N2期与N3期合并为1个变量。
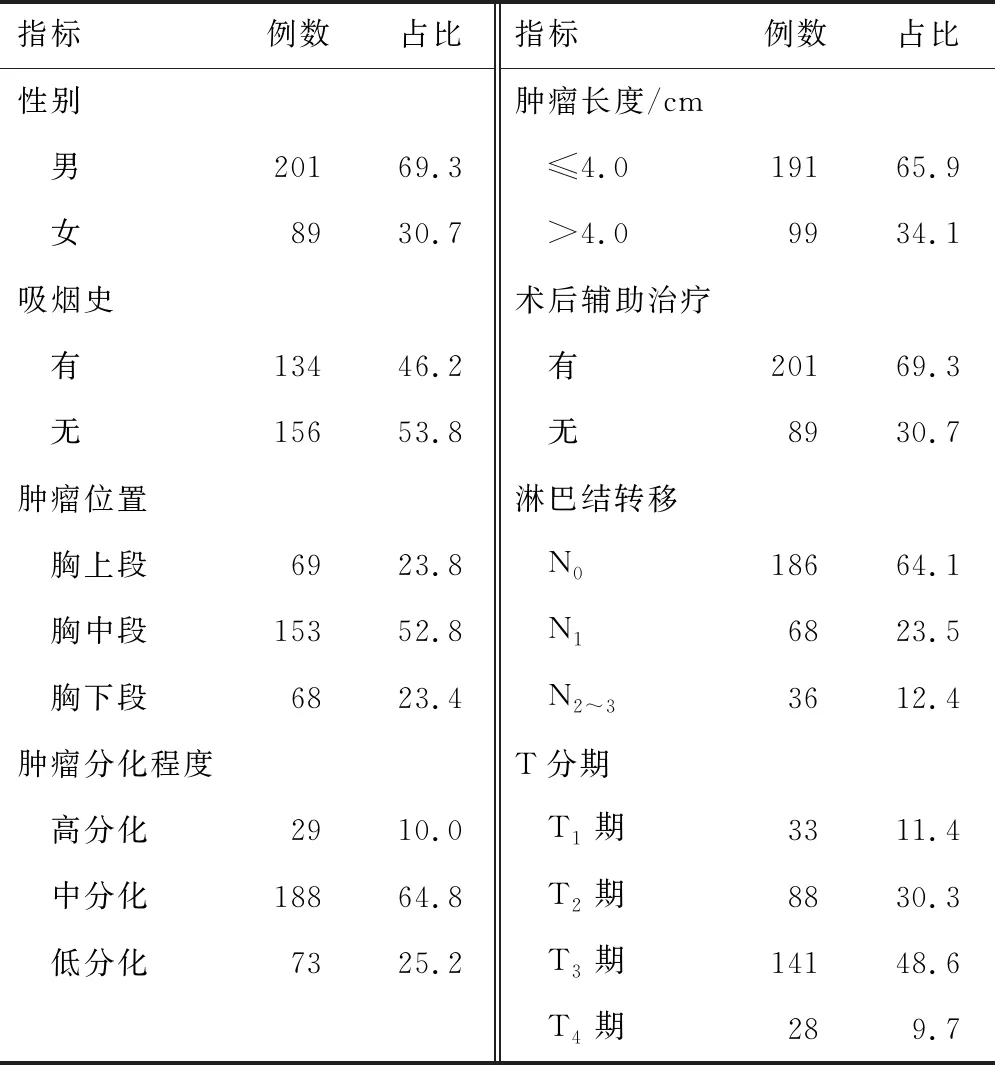
表1 患者的一般资料(n,%)
1.2 研究内容基于患者的生存状态和生存时间,使用X-tile软件分别得到NLR、LMR、PLR的最佳截断值为2.25、2.88、143.85。以不同指标的最佳截断值为标准,分别将患者分为低NLR组(NLR≤2.25,174例)和高NLR组(NLR>2.25,116例),低LMR组(LMR≤2.88,74例)和高LMR组(LMR>2.88,216例),低PLR组(PLR≤143.85,213例)和高PLR组(PLR>143.85,77例)。
1.3 随访以末次病程记录为依据或者进行电话回访,随访至2020年6月30日,中位随访时间为68.3个月。记录手术当日至患者死亡或随访截止日期为总生存期,中位生存期为40个月(范围为4~78个月)。
1.4 统计学方法采用X-tile软件寻找NLR、LMR、PLR的最佳截断值。采用SPSS 25.0统计软件进行数据处理。利用Reverse Kaplan-Meier法计算中位随访时间;借助Kaplan-Meier法对PLR、LMR、NLR不同组绘制生存曲线,使用log-rank检验进行验证;使用Cox回归分析临床指标对食管鳞癌的预后价值。P<0.05为差异有统计学意义。
2 结果
2.1 NLR、LMR、PLR与食管鳞癌患者预后的关系低NLR组5 a生存率(44.3%)较高NLR组(14.7%)高(P<0.05),见图1;低LMR组5 a生存率(12.2%)较高LMR组(39.4%)低(P<0.05),见图2;低PLR组5 a生存率(36.6%)较高PLR组(20.8%)高(P<0.05),见图3。
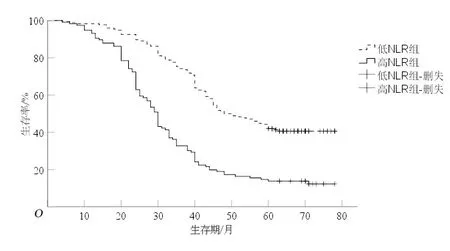
图1 低NLR组和高NLR组生存曲线比较
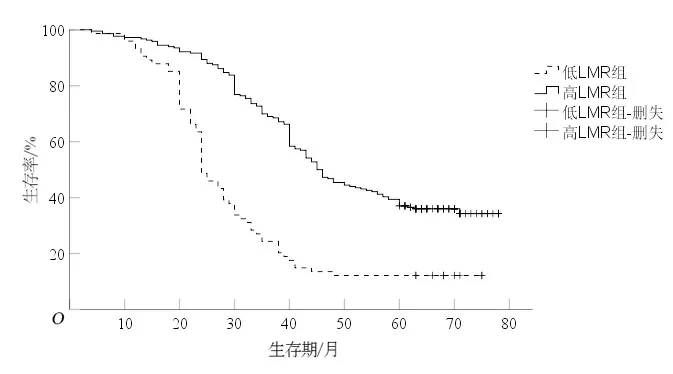
图2 低LMR组和高LMR组生存曲线比较
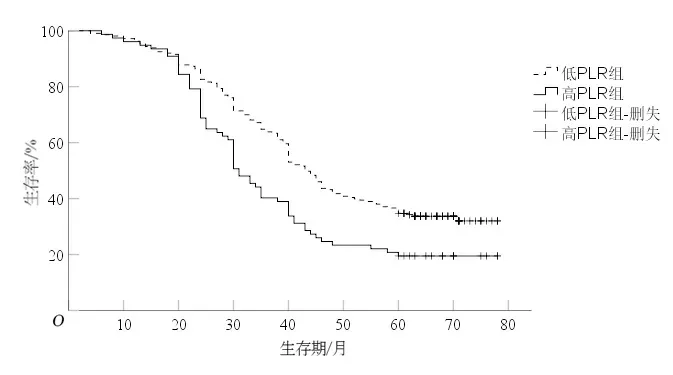
图3 低PLR组和高PLR组生存曲线比较
2.2 食管鳞癌预后的影响因素以60岁为分界点对年龄进行分类处理,年龄≤60岁122例(42.1%),年龄>60岁168例(57.9%)。将年龄、表1中指标及NLR、LMR、PLR直接纳入Cox回归分析,结果显示,性别、吸烟史、肿瘤长度、术后辅助治疗、PLR、肿瘤位置、肿瘤分化程度不是影响患者预后的独立因素(P>0.05),年龄、NLR、LMR、T分期、N分期是影响患者预后的独立因素(P<0.05)。年龄>60岁、NLR>2.25、LMR≤2.88、T分期高和N分期高,提示患者预后较差。见表2。
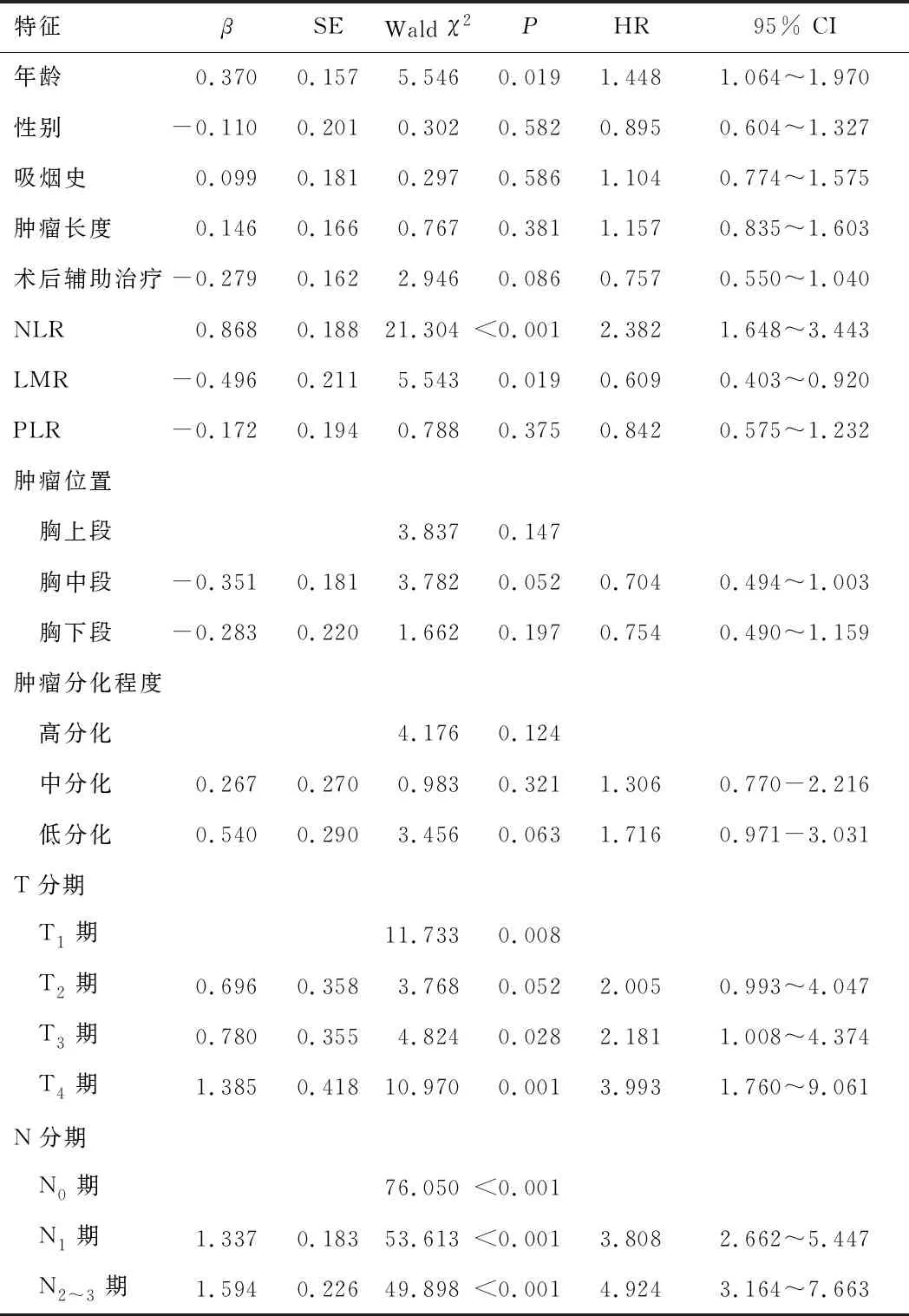
表2 食管鳞癌患者预后的影响因素
3 讨论
尽管目前针对食管癌的外科技术和围手术期处理措施有了很大的进步,但该病复发率仍较高,生存率仍然很低[10]。早期识别高危患者并选择最佳的治疗方案至关重要。NLR、LMR和PLR是容易被获得的炎症标志物,在多种癌症中被研究。
肿瘤细胞通过产生趋化因子(如CXCL1)、细胞因子(如肿瘤坏死因子-α、γ干扰素)和黏附蛋白,将中性粒细胞招募到肿瘤微环境中。肿瘤相关中性粒细胞(tumor-associated neutrophils,TANs)通过分泌弹性蛋白酶促进肿瘤细胞的增殖。TANs可释放基质金属蛋白酶(matrix metalloproteinases,MMP)(如MMP-9)、乳铁蛋白、组织蛋白酶G等,发挥促肿瘤作用[11]。N2型TANs还可通过增强MMP-9表达使细胞外基质的血管内皮生长因子释放增加,进一步促进肿瘤血管增生。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)为来源于单核细胞的巨噬细胞,存在于肿瘤微环境中。TAMs通过合成白细胞介素-6、白细胞介素-17、白细胞介素-23等细胞因子促进肿瘤的血管生成和转移,抑制细胞毒性T细胞反应[12]。淋巴细胞可以清除残留的肿瘤细胞和微转移灶[13]。血小板的激活与血管内皮生长因子水平相关,其水平上调可诱导血管生成,改变微血管通透性,促进肿瘤生长和远处转移[10]。炎症细胞数目的变化导致NLR相对升高,LMR相对降低,这会促进肿瘤的生长和转移。
本研究验证了NLR、LMR是影响患者总生存期的独立因素。低NLR患者的总生存期较长,高NLR组死亡风险是低NLR组的2.382倍;高LMR患者的总生存期较长,高LMR组死亡风险是低LMR组的0.609倍。多因素分析显示,NLR、LMR、年龄、T分期和N分期是食管鳞癌预后的独立危险因素。由表2可知,患者死亡风险随着肿瘤浸润深度、淋巴结转移分级的增加而升高,低T分期、无淋巴结转移与较长的生存期有关。既往研究表明,淋巴结转移、肿瘤浸润深度等可以预测食管鳞癌患者的预后[14-15],本研究结果与之相符。陈万青等[16]对2013年中国恶性肿瘤登记数据分析显示,年龄≥60岁的发病人数和死亡人数占所有调查人群的58.96%和71.80%。本研究发现,高年龄段食管鳞癌患者死亡风险是低年龄段的1.448倍。针对老年人群,应加强食管鳞癌的防治工作。本研究发现,PLR与食管鳞癌的预后无关。然而,Sun等[9]研究发现高NLR、高PLR和低LMR与食管鳞癌的整体生存率和无事件生存率有关。需要进行多中心的前瞻性研究以便更准确地证实上述结果。
年龄、NLR、LMR、T分期、N分期为预测食管鳞癌患者预后的指标。年龄>60岁、NLR>2.25、LMR≤2.88、T分期高和N分期高,提示患者预后较差。早期识别预后不良患者,制定个体化治疗方案,对降低食管鳞癌死亡率和延长患者总生存期非常重要。
