3种水质调控方式下参池沉积物—水界面N、P通量的研究
2021-05-24雷兆霖党子乔张东升孙亚慧李乐洲张津源王玉龙
雷兆霖,党子乔,张东升,3,孙亚慧,李乐洲,张津源,王玉龙,周 玮
( 1.大连海洋大学 水产与生命学院,辽宁 大连 116023; 2.全国水产技术推广总站,中国水产学会, 北京 100000; 3.大连海洋大学,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023; 4.大连海洋大学 经济管理学院,辽宁 大连 116023 )
沉积物作为上覆水营养盐重要的源和汇,是影响养殖池塘水质的重要因素。沉积物—水界面N、P通量的变化是研究界面营养盐储存、收支、循环的直接手段,可以直观反映水体的营养条件和水质状态,对评价池塘初级生产力水平、调控养殖池塘水质、保护养殖生态系统具有重要意义[1-3]。沉积物—水界面N、P通量的研究,国内多见于21世纪初,目前已广泛应用于海洋和陆地水域的水质环境研究和和水域生态系统研究[4-5]。汪雅露[6]对胶州湾沉积物—海水界面营养盐的迁移研究发现,夏季沉积物为水体无机氮(NO3--N:2.35×108,NO2--N:6.35×107,NH4+-N:1.34×109mmol/d)的源,冬季的表现为无机氮(NO33--N:6.39×107,NO23--N:-1.49×107,NH4+-N:1.33×108mmol/d)和无机磷(PO43--P:-2.20×107mmol/d)的汇,无机氮交换通量与有机质矿化扩散、间隙水无机氮含量和表层沉积物叶绿素a季节变化有关。董慧等[7-8]对多个湖泊和河口沉积物—水界面的N、P营养盐通量比较,证明高温、贫氧条件下有机物矿化可促进沉积物PO43--P和NH4+-N的释放,促进NO3--N、NH4+-N、PO43--P通量交换,NO2--N表现相反。杨平等[9]发现,养殖期间沉积物N、P营养盐释放能力减弱,中后期表现为对NO3--N[(1.87±1.15) mg/(m2·h)]、NO2--N[(1.58±0.51) mg/(m2·h)]和PO43--P[(1.22±0.62) mg/(m2·h)]的吸收。皮坤等[2]研究了池塘沉积物—水界面N、P营养盐通量变化与环境因子的相关关系,指出NOx--N与上覆水溶解氧水平呈正相关,NH4+-N和PO43--P释放通量与上覆水溶解氧水平呈负相关,以上N、P营养盐通量均与pH、温度呈正相关。蒋增杰等[10]对唐岛湾网箱养殖区沉积物—水界面溶解无机氮扩散通量研究发现,上覆水和沉积物间隙水中无机氮均以NO3--N为主,NO2--N在间隙水和上覆水中的含量表现为逐步积累,其扩散释放影响养殖水质。然而,针对仿刺参(Apostichopusjaponicus)养殖池塘沉积物—水界面N、P通量的研究相对较少。
仿刺参养殖多以池塘养殖为主,N、P的沉积与释放对养殖水质、仿刺参生长有重要影响[11-12]。现有海参养殖池塘水质管理方式多以自然纳潮、微孔曝气增氧技术为主[13]。自然纳潮换水模式改善水质,但无法有效去除池底有机物易造成沉积危害养殖生产[14]。微孔曝气增氧技术多应用于虾蟹养殖,通过气泡雾化扩散可影响曝气管微孔3~4 m范围,有效提升底层溶解氧至6.3 mg/L,但因其建设、维护成本较高等问题制约该技术的应用发展[15-16]。近年来本项目组开发了以表底层水质强制交换结合生物包的生物净化为主要机理的养水机技术。研究发现,养水机水质调控方式对参池底质环境调控作用显著,可抑制有机物积累,有利于间隙水内源性营养盐释放,硝化作用和N、P消解[17-18]。相关数据表明,养水机管理模式具有打破水体分层、“肥水促活”、增产增效的效果,可将成活率提高到95%以上,单产提高到30%[16]。但目前对诠释产生这一效果的理论依据不够充分。笔者通过对3种水质调控作用下仿刺参池塘沉积物—水界面N、P通量的研究,探究不同水质调控方式下的养殖池塘沉积物—水界面物质流动规律。
1 材料与方法
1.1 试验池塘
试验池塘位于大连宝发海珍品有限公司3个南北走向的605 m×85 m标准矩形海参池塘,分别为自然池塘(N 39.7866°,E 123.3208°)、微孔曝气池塘(N 39.7873°,E 123.3255°)和养水机池塘(N 39.7870°,E 123.3230°)。池塘泥沙底质底部铺设网礁,南北各一排进水闸门,每月根据潮汐变化换水3~5 d,冬季结冰后无换水。试验池塘内海参规格、密度相当,试验期间均不投饵、不投药,统一管理。
自然纳潮池塘无其他养殖装置。
微孔曝气池塘底部铺设微孔曝气装置,装置由微孔曝气盘、总供气管和空压机(0.1 kW/667 m2)组成,池塘缺氧即开始工作。
养水机池塘最深处(南端)安置养水机(750 W)一台,每日21:00至翌日9:00工作12 h,冬季正常工作。养水机[CN200620006141.5]主要由4部分组成,分别为进水组件[CN201621364576.7]、生物包、水动力装置和养殖池塘专用喷头[CN201410415402.8](图1),设备介绍及工作机理参考文献[13-14,16,19];微孔曝气设备介绍及工作机理参考文献[20-22]。
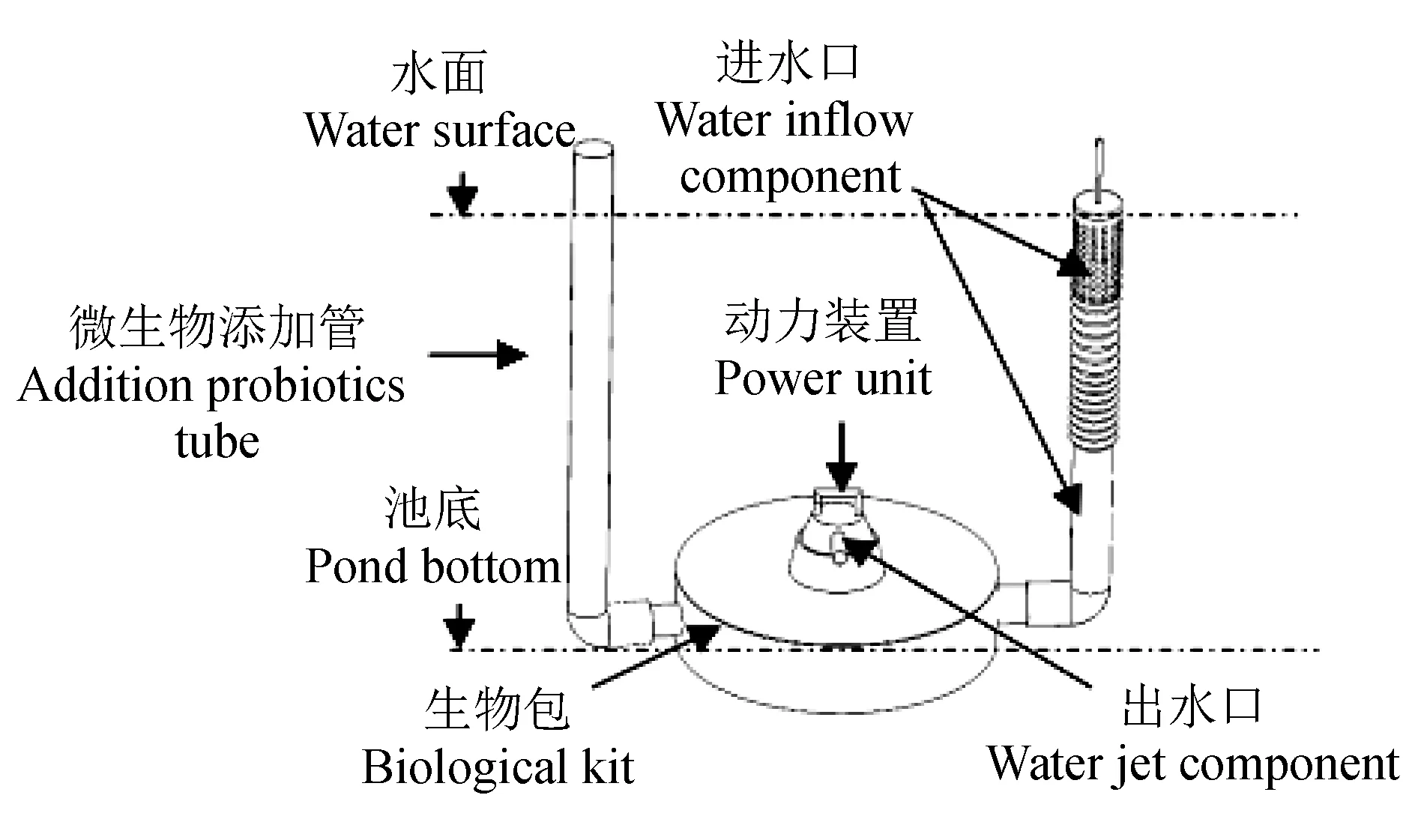
图1 养水机模拟图Fig.1 Simulation diagram of water quality regulator unit
1.2 试验方法
1.2.1 样品采集
试验时间为2015年10月—2016年9月,每月各池塘换水前3~5 d进行采样。试验点为池塘最深处,在此附近设3个平行采样点。采用实验室培养法测定沉积物—水界面N、P通量,操作如下:在不同养殖池塘内各采集3组原状沉积物样品(使用王友绍等[23]设计的无扰动沉积物采集器)置于玻璃培养容器(直径10 cm,高25 cm)内。用有机玻璃采水器采集底层水样。采集的沉积物样和底层水样迅速送回实验室,同时将沉积物样品的高度调整至10 cm。将采样管静置4 h,充分沉降后以虹吸法将上覆水用采集的底层水(用医用纱布过滤)进行置换,培养管内水柱约15 cm时密封培养容器口(放有磁力搅拌子)。培养容器置于水浴培养箱中,黑暗条件下培养4 h。位于培养箱中央的磁力搅拌器带动每个培养容器内的磁力搅拌子(位于沉积物上方7 cm处),缓慢匀速地搅动(60 r/min),以便培养管内溶解氧和营养盐分布均匀。
1.2.2 样品测定
水体NO3-、NO2-、NH4+和PO43-质量浓度按照GB 17378.4—2007《海洋监测规范》[24]中规定的方法进行测定,每组样品重复测定3次。
1.3 计算方法
营养盐通量计算公式:
式中,F为营养盐通量[mg/(m2·d)];Δρ为培养前后培养器上覆水中营养盐质量浓度的变化(空白对照校正)
(mg/L);V表示培养器中上覆水的体积(m3);S表示培养器底部横截面积(m2);t表示培养时间(d)。计算结果正值表示营养盐由沉积物向上覆水释放,负值表示营养盐被沉积物吸收。
1.4 数据处理
使用Excel 2013、SPSS 21.0对试验数据进行处理并制图。
2 结 果
2.1 3种水质调控方式下参池沉积物—水界面NOx-通量
3种参池沉积物—水界面NOx-通量变化趋势基本一致,波动范围自然纳潮池塘为-36.0~10.8 mg/(m2·d)、微孔曝气池塘为-12.0~8.4 mg/(m2·d)、养水机池塘为0.6~5.4 mg/(m2·d),周年极差比较养水机池塘最小(R自:46.8>R微:20.4>R养:4.8)(图2)。2015年10、11月,2016年1、2、6、9月NOx-正通量期间,养水机池塘NOx-通量速率[4.2、5.4、1.8、1.8、3.6、1.8 mg/(m2·d)]较另两池塘低且差异显著(P<0.05)。2016年3、7、8月自然纳潮池塘[-31.8、-36.0、-33.6 mg/(m2·d)]和微孔曝气池塘[-10.8、-12.0、-6.0 mg/(m2·d)]出现显著负通量(P<0.05),养水机池塘NOx-通量为正通量但出现低值[0.6、3.6、0.6 mg/(m2·d)]。
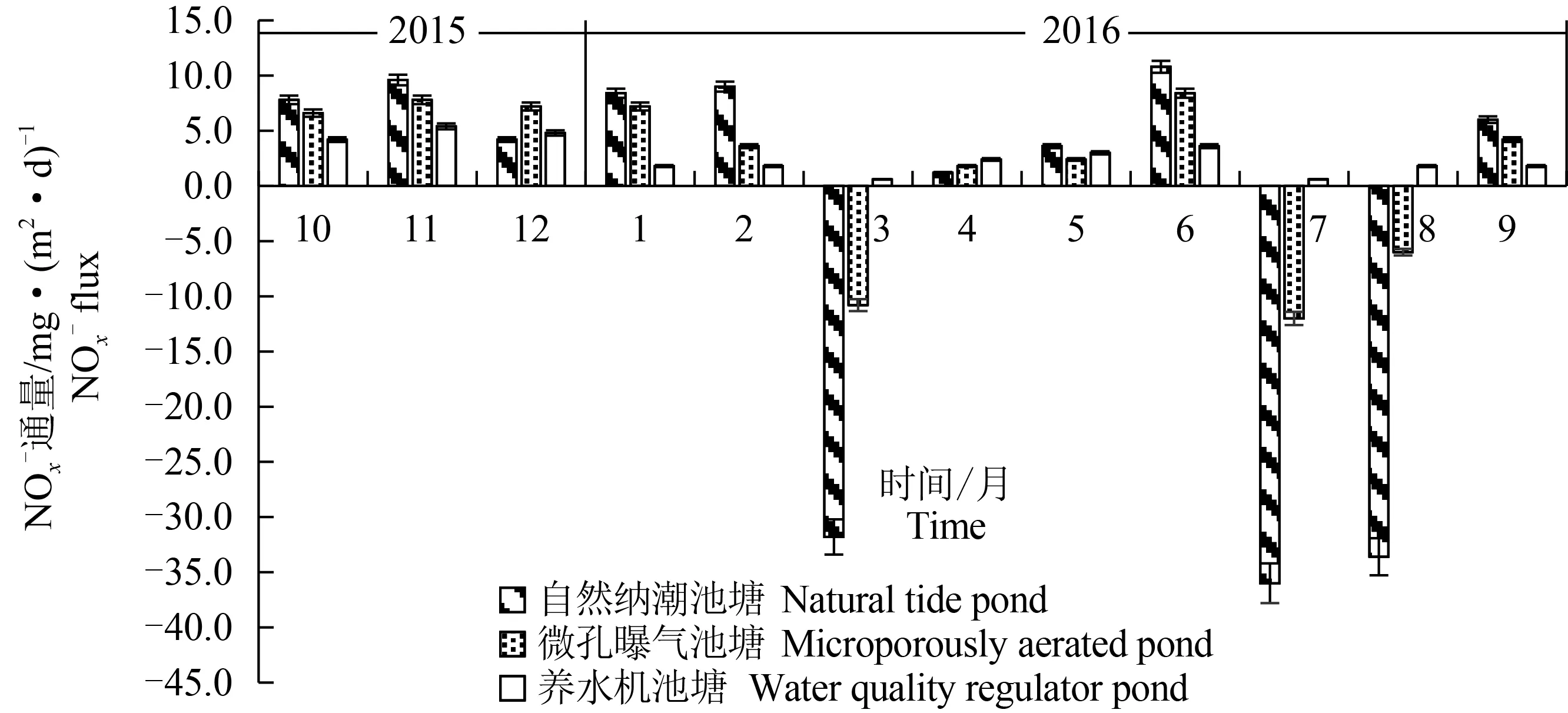
图2 3种水质调控方式下参池沉积物—水界面NOx-通量年动态变化Fig.2 Annual dynamic changes in NOx- flux in the sediment-water interface of sea cucumber A. japonicus ponds under three water quality control methods
2.2 3种水质调控方式下参池沉积物—水界面NH4+通量
3种参池沉积物—水界面NH4+通量变化趋势基本一致,波动范围自然纳潮池塘为-102.6~71.4 mg/(m2·d)、微孔曝气池塘为-90.6~78.0 mg/(m2·d)、养水机池塘为5.4~81.6 mg/(m2·d),周年极差比较养水机池塘最小(R自:174.0>R微:168.6>R养:76.2)(图3)。正通量显著性差异比较,2016年1月自然纳潮池塘NH4+通量[71.4 mg/(m2·d)]最大(P<0.05),2016年4、5月养水机池塘NH4+通量[81.6、65.4 mg/(m2·d)]最大(P<0.05)。2016年3月自然纳潮池塘NH4+通量速率[-80.4 mg/(m2·d)]较另两池塘大且方向为负,此时差异显著(P<0.01),7、8月自然纳潮[-102.6、-101.4 mg/(m2·d)]和微孔曝气池塘[-90.6、-90.0 mg/(m2·d)]较养水机池塘出现极显著负通量(P<0.01),养水机池塘NH4+通量为低正通量[17.4、19.8 mg/(m2·d)]。
2.3 3种水质调控方式下参池沉积物—水界面的PO43-通量
3种参池沉积物—水界面PO43-通量变化方向和趋势基本一致,波动范围自然纳潮池塘为18.6~76.2 mg/(m2·d)、微孔曝气池塘为30.0~73.2 mg/(m2·d)、养水机池塘为29.4~50.4 mg/(m2·d),周年极差比较养水机池塘最小(R自:57.6>R微:43.2>R养:21.0)(图4)。2016年3、8月微孔曝气池塘PO43-通量[55.2、64.8 mg/(m2·d)]较另两池塘大且差异显著(P<0.01),自然纳潮池塘[35.4、44.4 mg/(m2·d)]和养水机池塘[33.6、47.4 mg/(m2·d)]无显著差异(P>0.05);自然纳潮池塘7月PO43-通量[76.2 mg/(m2·d)]最大且差异显著(P<0.05)。
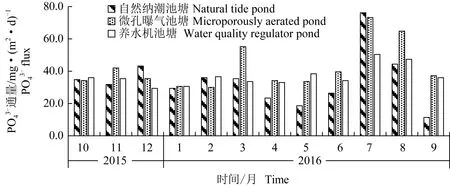
图4 3种水质调控方式下参池沉积物—水界面PO43-通量周年变化Fig.4 Annual change in PO43- flux in the sediment-water interface of sea cucumber A. japonicus ponds under three water quality control methods
2.4 试验期间3种水质调控方式下参池产量
试验期间3种水质调控方式下参池产量对比:养水机>微孔曝气>自然纳潮(表1)。

表1 试验期间3种水质调控方式下参池产量Tab.1 Yields of sea cucumber in culture ponds underthree water quality control methods
3 讨 论
3.1 3种水质调控方式对NOx-通量的作用效果比较
相关研究发现,沉积物—水界面NOx-扩散通量受界面营养盐质量浓度差[25]影响外,同时与水温、溶解氧[2,5,20]、氧化还原环境[3]、水动力条件[26]和沉积物有机质含量[27]、微生物活性[28]等因素有关。
本试验中,参池沉积物—水界面NOx-通量变化趋势基本一致,均于化冰期(3月)和夏季(7、8月)显著降低,自然纳潮和微孔曝气池塘该时期均出现显著负通量,养水机池塘周年表现为正通量。相关研究报道中池塘沉积物—水界面NOx-通量与本试验结果一致,多于夏季NOx-由上覆水向沉积物扩散(负通量)且具季节变化趋势[1,3,25]。本试验中,2016年3、7、8月自然纳潮池塘和微孔曝气池塘出现极显著负通量(P<0.01),养水机池塘NOx-出现低的正通量,分析原因与养水机池塘水层交换能力较强有关,此时底层增氧使底泥耗氧率[696、726、718 mg/(m2·d)]、沉积物有机质含量(0.91%、1.03%、0.98%)及脲酶活性(195.51、95.00、113.36 U/g)均低于另两池塘[17-18,28-29],促进NOx-通量向上扩散形成正通量[27]。2015年10、11月和2016年1、2、6、9月NOx-正通量期间,养水机池塘NOx-通量速率较另两池塘低且差异显著(P<0.05),其原因在于养水机池塘水体扰动促进水层垂直交换,实现底层增氧、CO2含量降低[14,16,19],高氧化还原环境下pH相对降低[3],养水机池塘pH较另两池塘小[30],水中氨毒性影响最小;试验池塘均为限制性富营养化水体[30],养水机池塘沉积物碱性磷酸酶、蛋白酶活性显著低于另两池塘[14,18],降低NOx-通量速率的同时可减少富营养化发生几率[31]。
养水机池塘打破水体分层能力较强,促进上下水层交换[16],研究团队发现养水机池塘溶解氧波动最小(8.9 mg/L)且处于较高水平[18,30],沉积物有机质含量(0.84%)、微生物活性(4.47 U/g)较低且波动最小(0.28%、1.02 U/g)[17-18],故3种池塘NOx-通量极差比较养水机池塘最小(R自>R微>R养)。
3.2 3种水质调控方式对NH4+通量的作用效果比较
本试验参池沉积物—水界面NH4+通量变化趋势基本一致,均于化冰期和夏季出现显著降低,自然纳潮池塘该时期表现为显著负通量,微孔曝气池塘夏季表现为显著负通量,养水机池塘周年均表现为正通量。相关研究报道中池塘沉积物—水界面NH4+通量变化趋势与本研究相似,多出现在夏季发生沉降(负通量)且具季节变化趋势[26,32-33]。根据上文对NOx-的相关讨论,分析造成以上原因有四:一是沉积物—水界面NH4+质量浓度梯度差为通量变化直接因素[1,25,27];二是沉积物氧化还原环境间接影响NH4+通量[26];三是沉积物有机质含量低NH4+通量多表现为底泥吸收[32,34];四是水体扰动强度与NH4+交换通量呈负相关[3]。
3种池塘正通量显著性差异比较,2016年1月自然纳潮池塘NH4+通量最大(P<0.05),2016年4、5月养水机池塘NH4+通量最大(P<0.05)。分析原因:1月自然纳潮池塘溶解氧水平相对较低,相对低的氧化还原电位抑制硝化作用,NH4+增多向上覆水释放;养水机打破水体跃层、降低沉积物—水界面NH4+质量浓度差[16],鲁晓倩[30]平行观测,4月(11.5 ℃)、5月(22.1 ℃)温度持续升高,养水机池塘藻类生物量(9.21、12.85 mg/L)较另两池塘大,藻类繁殖交换至底层利用NH4+,产生负质量浓度差形成正通量。
本试验中,2016年3月自然纳潮池塘NH4+通量较另两池塘大且方向为负,7、8月自然纳潮和微孔曝气池塘出现极显著负通量(P<0.01),养水机池塘NH4+出现低的正通量。分析原因:当沉积物提供NH4+未能满足该界面硝化作用所需时表观通量为负[35],3月自然纳潮池塘为NH4+负通量,与此时沉积物硝化作用较强有关,沉积物有机质含量低表现为底泥对NH4+的吸收[34],因该池塘沉积物有机质含量(1.29%)相对较高,故排除沉积物有机质含量对NH4+通量的影响。林青等[13]报道该时期底栖硅藻生物量养水机池塘(13.50 mg/L)>微孔曝气池塘(12.15 mg/L)>自然纳潮池塘(11.87 mg/L),鲁晓倩[30]观测发现,7、8月养水机池塘50~150 cm水层初级生产力[1.76、3.93 g/(m2·d)]较另两池塘大,证明7、8月养水机池塘水体扰动能力强,表层藻类交换至底层,间隙水溶解氧水平(5.88、7.78 mg/L)较另两池塘大[18]。养水机池塘NH4+通量周年极差较另两池塘小(R自>R微>R养),原因与NOx-通量极差相似[16-18,30]。
3.3 3种水质调控方式对PO43-通量作用效果比较
在本试验观测周期内,3种池塘沉积物—水界面PO43-通量均表现为正,变化趋势基本一致。众多研究结果中的PO43-通量变化趋势与本试验结果一致,多于夏季出现最大值[24,32],并指出沉积物—水界面PO43-通量扩散受多种因素影响,主要受界面PO43-质量浓度差、氧化还原环境、扰动作用及沉积物有机质含量等因素影响[24,34,36-37]。相关研究发现,溶解氧含量与氧化还原电位呈对数线正相关,pH与氧化还原电位呈线性负相关,温度与溶解氧呈负相关[38]。本试验中,2016年3、8月微孔曝气池塘PO43-通量较另两池塘大且差异极显著(P<0.01),自然纳潮池塘和养水机池塘无显著差异(P>0.05);自然纳潮池塘7月PO43-通量较另两池塘大且差异显著(P<0.05)。其原因为:自然纳潮池塘7月(0.68 mg/L)和微孔曝气池塘3月(0.355 mg/L)、8月(0.755 mg/L)界面负营养盐质量浓度差均达到最大,促进沉积物PO43-向上覆水中释放[18,39]。如前所述,养水机池塘水体在受到扰动的情况下,形成稳定的氧化—还原环境,底栖藻类繁殖促进间隙水增氧[13,18],抑制沉积物PO43-向上覆水中释放。
相关研究发现,pH与碱性磷酸酶活性呈正相关[27],碱性磷酸酶活性越大沉积物中磷的释放能力越大,水体环境越差[40]。魏亚南等[14]研究发现,养水机池塘沉积物碱性磷酸酶周年极差(0.550 mg/g)最小,平均值(0.244 mg/g)最低。养水机因搅动作用强,水中PO43-质量浓度周年极差(0.035 mg/L)较小、平均值(0.024 mg/L)最小[41],间隙水溶解氧极差(17.11 mg/L)较小、平均值(11.315 mg/L)最大[18]。本试验结果显示,3种池塘PO43-通量极差比较养水机池塘最小(R自>R微>R养),说明养水机池塘水体环境较好。
3.4 3种水质调控方式下参池亩产比较
在本试验观测周期内,养水机调控方式下参池产量(1275 kg/hm2)显著高于其他2种方式,自然纳潮最低。试验期间3种池塘仿刺参规格、密度相当,统一管理。团队研究发现,养水机调控方式下仿刺参成活率高达95%[14,16],目前参池产量研究相对较少,现有研究发现2012—2014年辽宁省仿刺参出塘量分别为783.75、1011.38、888.75 kg/hm2 [42],低于养水机池塘平均产量,试分析参池亩产差异原因与水质调控方式有关。
综上所述,养水机较其他两种水质调节方式有较强的水体扰动能力,降低化冰期和夏季升温底层缺氧的风险、富营养化程度[43],增加底栖藻类生物量有利于海参觅食[44],结合试验期间3种调控方式下参池产量情况,发现养水机调控方式在沉积物—水界面N、P通量作用效果方面较好。
