p53 基因重组杆状病毒载体的构建与表达的研究
2021-05-24廖致红代小丽吴春凤刘志华李丽敏沈开元
廖致红,代小丽,吴春凤,刘志华,李丽敏,徐 鹏,沈开元
(柳州市人民医院检验科 广西 柳州 545001)
杆状病毒是一种基因组为80 ~160 kb 的环状DNA 双链病毒。根据包涵体的形态和病毒诱导的细胞病理学特征,杆状病毒分为核多角体病毒属(nucleopolyhedrovirus,NPV)和颗粒病毒属(granulovirus, GV)。杆状病毒表达系统(baculovirus expression vector systerm, BEVS)是一种利用杆状病毒作为载体,转染昆虫培养细胞或虫体中表达外源蛋白的真核表达系统。杆状病毒具有宿主专一性,其在自然条件下不能感染脊椎动物,生物安全性好;利用真核生物昆虫的细胞作为宿主,表达的外源蛋白能够进行正确的蛋白加工和修饰;病毒本身基因组大,容纳量高,而且能够携带多个基因;这些优点使得BEVS 成为一项成熟、安全、经济、高效的蛋白质表达技术,广泛用于生物防治、临床医疗、药品开发等领域[1¯3]。本研究构建重组杆状病毒载体后,将p53 基因转染至该载体,并调控其在肝癌细胞特异表达,为临床实现p53 基因精准治疗肝癌奠定基础。现将结果报道如下。
1.资料与方法
1.1 细胞培养及复苏
实验所用细胞株为HepG2、LO2,按细胞培养方法进行培养及冻存。
1.2 p53 过表达载体构建
1.2.1 细胞总RNA 提取及逆转录 取适量HepG2、LO2 细胞置于Trizol 裂解液(索莱宝,R1100)中,按照说明书进行总RNA 提取后,按照逆转录试剂盒PrimeScript ™ RT Master Mix 说明书进行逆转录操作,所得cDNA 置于¯20℃保存待用。
1.2.2 过表达质粒载体pB513B¯1 提取以及纯化 使用质粒小量提取试剂盒(Solarbio,D1100)提取质粒,按照说明书完成质粒提取以及纯化。
1.2.3 PCR 体系和反应条件 使用引物扩增基因CDS区域外源片段。反应体系和PCR 扩增条件参照说明书执行,引物由上海生工设计,见表1。

表1 扩增的引物序列
1.2.4 DNA 酶切实验 对外源片段和过表达质粒载体进行酶切。使用全氏金公司的限制性内切酶和反应Buffer,操作按照说明书进行。
1.2.5 DNA 纯化以及回收实验 使用琼脂糖凝胶回收试剂盒(Solarbio,D2500¯01)和DNA 产物纯化试剂盒(Solarbio, D1300)进行DNA 的纯化和胶回收。
1.2.6 DNA 连接实验 将拥有粘性末端的外源片段和质粒载体进行连接反应。连接酶购自Promega 公司的T4 DNA 连接酶,操作按照说明书进行。
1.2.7 感受态细胞CaCl2化学转化实验 按照感受态细胞的操作说明书进行。
1.2.8 阳性克隆菌筛选验证 挑取单菌落培养于含抗生素的LB 液体培养基中,培养物送至上海生工进行测序,选取测序成功克隆菌使用EasyPure® HiPure Plasmid MiniPrep Kit 提取质粒,用于后续细胞转染。
1.3 细胞转染
实验分组HepG2:空白对照组、p53 过表达组LO2:空白对照组、p53 过表达组。细胞转染的操作程序按照汉恒Lipo Fiter3 转染试剂说明书进行。
1.4 稳定转染细胞株筛选
细胞转染或感染48 h 后,将细胞置于含有适当浓度(2μg/mL)嘌呤霉素的新鲜培养基中培养,待细胞稳定生长后,传代培养及冻存,进行后续实验。
1.5 细胞总RNA 提取及逆转录
参照1.2.1 的操作步骤进行。
1.6 实时荧光定量PCR 检测p53 基因mRNA 表达
反应体系和酶购自Takara 公司,引物由上海生工设计合成,反应条件根据Takara 公司的qPCR 说明书进行操作,见表2。

表2 qPCR 引物序列
1.7 MTT 法检测细胞增殖活性
按照实验步骤说明书进行操作。
1.8 流式技术检测细胞凋亡
按照实验步骤说明书进行操作。
1.9 ELISA 法检测p53 基因蛋白浓度
细胞悬液经反复冻融、离心后,经加样、加酶、温育、配液、洗涤、显色、终止等步骤后测定数值,最后通过标准曲线计算样品指标含量。
1.10 蛋白印迹法检测p53 基因蛋白表达
细胞蛋白提取及变性:取细胞培养皿,加入200~400μl RIPA¯PMSF,吹打混匀至细胞完全裂解。12 000 rpm 离心5 min,取上清采用BCA 法测定蛋白含量。经变性、电泳、转膜、一抗二抗孵育后显影。所有操作步骤按照说明书进行。
2.结果
2.1 p53 基因过表达重组质粒载体构建成功
选取阳性克隆进行DNA 测序,通过软件vector NTI 1.5.1比对序列,结果显示插入序列与数据库中序列一致。
2.2 p53 基因重组杆状病毒载体转染细胞
转染24 h 后使用倒置荧光显微镜进行观察转染效率,观察绿色荧光蛋白GFP 的表达,发现转染后两种细胞系的绿色荧光蛋白GFP 表达,表明转染成功。
2.3 稳定转染细胞株筛选
细胞转染48 h 后,将细胞置于含有适当浓度(2 μg/mL)嘌呤霉素的新鲜培养基中培养,进行筛选,细胞稳定生长后,绿色荧光蛋白GFP 表达稳定,表明稳定转染细胞株筛选成功。
2.4 实时荧光定量PCR(RT¯PCR)检测p53 基因mRNA 表达
经转染后,p53 基因在LO2 和HepG2 细胞株的mRNA的表达量均显著上升(P<0.05),表明p53 基因重组杆状病毒能够在离体肝癌细胞中靶向表达,见表3。
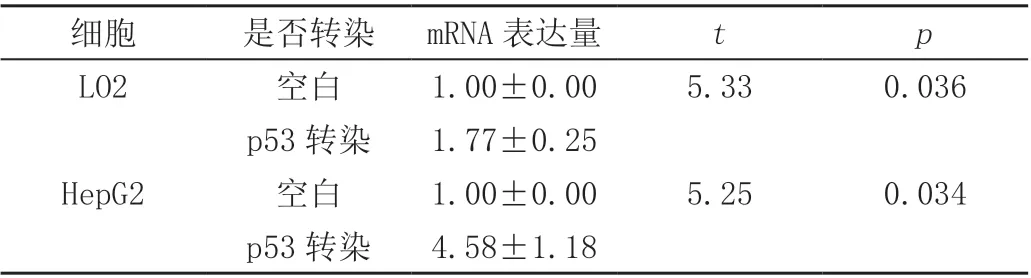
表3 p53 基因mRNA 在离体细胞中的表达(χ¯±s)
2.5 p53 基因重组杆状病毒抑制HepG2 细胞增殖
重组杆状病毒感染后,HepG2 细胞增殖率明显低于未转染的细胞,差异具有显著统计学意义(P<0.01),表明p53 基因重组杆状病毒能够抑制肝癌细胞的生长,见图1。
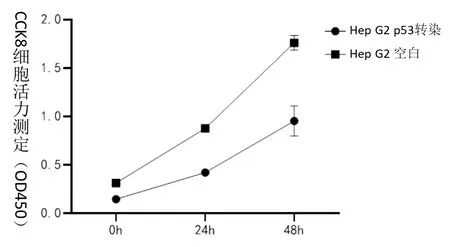
图1 CCK8 细胞活力测定显示p53 重组杆状病毒能够抑制肝癌细胞生长
2.6 p53 基因重组杆状病毒促进HepG2 细胞凋亡
重组杆状病毒感染后,HepG2 细胞凋亡率明显高于未转染的细胞,而在LO2 细胞系未观察到差异,表明p53基因重组杆状病毒能够促进肝癌细胞的凋亡。
2.7 p53 基因重组杆状病毒蛋白在HepG2 细胞靶向表达
ELISA 检测结果显示,在HepG2 细胞中检测到的p53基因重组杆状病毒蛋白浓度显著高于非感染的HepG2 细胞(P<0.01),而在LO2 细胞中未观察到相应变化,表明p53 基因重组杆状病毒蛋白在HepG2 细胞中靶向表达,见图2。
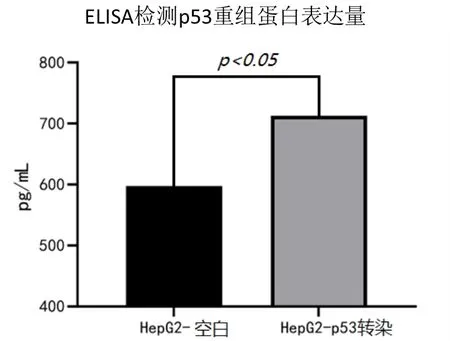
图2 ELISA 检测结果显示p53 基因重组杆状病毒蛋白在HepG2 细胞中靶向表达
2.8 蛋白印迹法结果表明p53 基因重组杆状病毒蛋白在HepG2 细胞靶向表达
Western blot 结果表明,与空白组相比,p53 基因重组杆状病毒蛋白在HepG2 细胞表达增高,但在LO2 细胞中的表达无显著差异(P>0.05),表明p53 基因重组杆状病毒蛋白在HepG2细胞,而非LO2细胞中靶向表达,见图3 和表4。
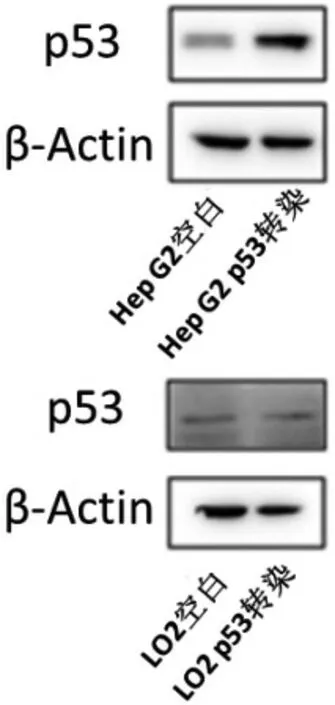
图3 Western blot 图显示p53 基因重组杆状病毒蛋白在HepG2 细胞靶向表达
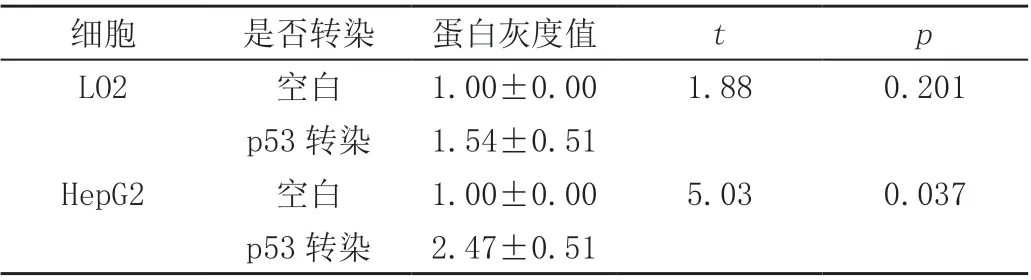
表4 p53 基因重组杆状病毒蛋白在离体细胞的灰度值分析
3.讨论
杆状病毒/昆虫细胞系统在学术界和工业中广泛用于生产真核蛋白,应用范围从结构分析、药物筛选、提供蛋白质生物学和癌症、病毒等的治疗方法[4¯5]。杆状病毒作为常见病毒载体的独特地方在于具有容纳大量异源DNA 的能力,并且能够将异源DNA 完整地递送至所选的宿主细胞。因此科学家们利用了这个强大的功能开发了多种产品,从而在异源蛋白表达过程中赋予了新功能。通过改变其向性,重组杆状病毒颗粒可用于在哺乳动物细胞和组织中高效递送定制的DNA。合成生物学的最新进展极大地促进了构建或重组杆状病毒基因组的构建,以用于基因编辑和基因组工程等方面[6¯7]。
杆状病毒载体在哺乳动物细胞基因传递中具有广泛应用前景,其优势在于杆状病毒不会在哺乳动物细胞中复制、其基因整合到哺乳动物基因组中的水平低,更重要的是杆状病毒载体具有强大的携带转基因能力(最多可38kb 的外源DNA)且无细胞毒性。因此,近几年来有科学家的研究焦点集中在使用杆状病毒载体运送外源DNA 用于癌症等治疗[8]。本研究选取宿主域狭窄的杆状病毒作为载体,以肝组织特异性启动子载脂蛋白A¯I 启动p53 基因,利用肝脏组织特异性启动子apoE 和miR¯122 反义序列双调控,构建了p53 基因重组杆状病毒。通过RT¯PCR 法检测p53 基因重组杆状病毒基因mRNA 在HepG2 细胞系中表达、ELISA 法检测p53 基因重组杆状病毒蛋白浓度、流式细胞术检测p53 基因重组杆状病毒蛋白诱导HepG2 细胞凋亡,MTT 法检测p53 基因重组杆状病毒蛋白抑制HepG2 细胞增殖、Western blot 技术检测p53 基因重组杆状病毒蛋白在HepG2 细胞中靶向表达,结果显示,在正常肝脏细胞LO2 细胞系中转染p53 基因重组杆状病毒,病毒基因mRNA 表达无明显改变,病毒蛋白在LO2 细胞系中的增殖无显著改变,无抑制LO2 细胞系凋亡的能力,但p53 基因重组杆状病毒基因mRNA 在HepG2 细胞中表达增加,病毒蛋白在HepG2 细胞中靶向表达,证明本研究p53 基因重组杆状病毒载体构建成功,可达到靶向治疗肝癌患者的目的。
国外研究显示,杆状病毒表达系统将靶DNA 插入杆状病毒包膜GP64 信号序列和成熟域之间,通过GP64 的跨膜区域将融合蛋白锚定在病毒的包膜中,从而将外源蛋白展示于病毒表面粒子,进一步增强其免疫识别和免疫反应性[9¯10]。本研究结果显示,杆状病毒载体携带的外源DNA(p53 基因)具有良好的生物安全性,易于操作以插入外源DNA 片段,表达的重组蛋白很容易纯化等,与国外的研究一致[11¯13],表明具备了杆状病毒载体携带外源DNA 达到肝癌替代治疗的应用价值。
综上所述,本研究构建的p53 基因重组杆状病毒载体具有安全性、经济性和便利性的独特优势,在未来肝细胞癌的基因治疗中具有巨大的潜力。
