lncRNA HOXD-AS1通过靶向miR-133a-3p调控PI3K/AKT/mTOR轴影响宫颈癌细胞增殖和凋亡
2021-05-23刘海娟谢锦霞
刘海娟,谢锦霞
(西安市人民医院妇产科,西安 710068;*通讯作者,E-mail:13629267550@163.com)
宫颈癌是常发病于女性的恶性肿瘤之一,发病率及死亡率高,且不断上升,严重威胁女性的健康,因此寻找新的宫颈癌治疗和诊断的分子标志物对于其临床具有重要意义[1,2]。长链非编码RNA(lncRNA)是长度大于200个核苷酸的RNA,随着高通量测序技术的发展,越来越多的lncRNA被报道在肿瘤组织中差异表达,并可调控肿瘤的增殖、转移及凋亡[3-5]。已有研究表明lncRNA HOXD-AS1在肿瘤的发展过程中发挥重要作用,可调控神经母胶质瘤、膀胱癌、前列腺癌[6-8],但是lncRNA HOXD-AS1在宫颈癌中的作用及调控机制尚无明确研究,本研究探究lncRNA HOXD-AS1对宫颈癌细胞增殖和凋亡的影响及机制,旨在为宫颈癌的临床治疗提供帮助。
1 材料与方法
1.1 材料
人正常宫颈上皮细胞HCerEpic、人宫颈癌细胞HeLa和C33A购自中科院上海细胞库;MTT试剂购自Amresssco公司;细胞凋亡检测试剂盒(沈阳万类生物技术有限公司);Lipofectamine 2000转染试剂盒;双荧光素酶基因载体及双荧光素酶基因报告检测试剂盒(汉恒生物技术有限公司);qPCR试剂盒、cDNA合成试剂盒购自福麦斯生物技术有限公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bax蛋白、分裂半胱氨酸蛋白酶(cleaved Caspase-3)、细胞周期蛋白D1(cyclin D1)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、磷酸化的PI3K(phospho-PI3K, p-PI3K)、蛋白激酶B(protein kinase B,又称AKT)、磷酸化的AKT(phospho-AKT, p-AKT)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、磷酸化的mTOR(phospho-mTOR, p-mTOR)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)一抗,山羊抗兔二抗购自沈阳万类生物技术有限公司,cDNA Synthesis试剂盒及PCR试剂盒购自福麦斯生物技术有限公司,流式细胞仪购自美国Beckman公司。
1.2 细胞培养
HCerEpic细胞、HeLa和C33A细胞均复苏并培养于含10%胎牛血清的RPMI-1640培养基中,于37 ℃、5%CO2的培养箱中培养,培养至细胞汇合率达80%时,使用胰蛋白酶消化并传代。
1.3 细胞转染
取对数生长期的HeLa细胞接种于6孔板中,分为miR-133a-3p mimic组、negative control(NC)组和miR-133a-3p inhibitor组,每孔细胞数为1×105,根据转染试剂盒说明书,分别将miR-133a-3p mimic、negative control(NC)、miR-133a-3p inhibitor与转染试剂混合,然后在不含胎牛血清的RPMI-1640培养基中与HeLa细胞共孵育8 h,再用完全培养基培养24 h后即获得转染细胞株。
将对数生长期的HeLa细胞接种至6孔板中,分为si-HOXD-AS1组和si-NC组,然后根据脂质体2000转染试剂说明书分别转染lncRNA HOXD-AS1 siRNA以及negative control,主要步骤为:HeLa细胞生长至70%时,按说明书将siRNA质粒与脂质体2000转染试剂混合,室温共孵育20 min后加入细胞培养基中,共孵育48 h后进行后即获得转染细胞株。
将对数生长期的HeLa细胞接种至6孔板中,分为si-NC组、si-HOXD-AS1组和si-HOXD-AS1+miR-133a-3p inhibitor组,si-NC组和si-HOXD-AS1组按照上述方法转染negative control和lncRNA HOXD-AS1 siRNA,si-HOXD-AS1+miR-133a-3p inhibitor组细胞先转染lncRNA HOXD-AS1 siRNA,再转染miR-133a-3p inhibitor。
1.4 MTT法检测细胞增殖能力
取si-NC组、si-HOXD-AS1组和si-HOXD-AS1+miR-133a-3p inhibitor组HeLa细胞接种至96孔板中,细胞密度为1×105/ml,每孔100 μl,细胞完全贴壁后,分别于24,48,72 h时每孔加入20 μl 5 mg/ml MTT溶液,于培养箱中培养6 h,然后吸除细胞培养液,每孔加入150 μl二甲亚砜溶液,于摇床上充分混匀,反应完全后,在酶标仪OD490 nm处检测吸光度值,OD值越大细胞增殖能力越强。
1.5 流式细胞术检测细胞凋亡
分别取3×105个si-NC组、si-HOXD-AS1组、si-HOXD-AS1+miR-133a-3p inhibitor组HeLa细胞接种于6孔板中,每组3个复孔,根据细胞凋亡检测试剂盒说明书,每孔取5×105个细胞于离心管中,用500 μl的Binding Buffer重悬细胞成单细胞悬液,而后添加5 μl的Annexin Ⅴ-FITC和5 μl的PI染料,混匀后室温避光孵育15 min,并设置Annexin Ⅴ-FITC和PI单阳性管用于调荧光补偿,空白管用于调电压;使用流式细胞仪检测上述各样品的荧光值,使用FlowJo v5.573软件分析细胞凋亡数。
1.6 双荧光素酶基因报告实验检测HOXD-AS1对miR-133a-3p的调控作用
miRcode数据库预测HOXD-AS1 3′UTR区域与miR-133a-3p结合位点,构建野生型(HOXD-AS1-WT)和突变型基因靶点的HOXD-AS1的3′UTR-荧光素酶表达载体(HOXD-AS1-MUT),然后按照1.3中转染方法,将HOXD-AS1-WT和HOXD-AS1-MUT转染至HeLa细胞,稳定表达后,再将miR-133-3p mimic和miR-NC分别转染至HOXD-AS1-WT和HOXD-AS1-MUT HeLa细胞,根据双荧光素酶基因报告检测试剂盒进行双荧光素酶报告实验,测定实验重复3次。
1.7 qRT-PCR检测HOXD-AS1的表达
使用Trizol提取RNA,具体步骤为:1×106个细胞加入1 ml Trizol裂解5 min,取上述细胞裂解液加入200 μl氯仿,静置5 min后,于12 000g,4 ℃离心15 min,转移上层水相,加入500 μl异丙醇,12 000g,4 ℃离心10 min,去上清,1 ml 75%乙醇清洗RNA沉淀后,20 μl RNA-free水重悬RNA沉淀,55 ℃水浴10 min,即为细胞中总RNA,使用核酸定量仪检测总RNA含量。根据cDNA Synthesis试剂盒指示配制反应体系,将提取的细胞RNA逆转为cDNA,然后利用核酸定量仪对cDNA进行定量。然后根据qPCR试剂盒指示配制反应体系,进行qPCR反应,采用GAPDH作为内参,反应后采用2-ΔΔCt法计算基因表达水平。引物序列见表1。

表1 HOXD-AS1、GAPDH引物序列
1.8 Western blot检测Bcl-2、Cyclin D1、Bax、cleaved Caspase-3、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达水平
每组取3×105个细胞接种于6孔板中,细胞长满后,每孔细胞加入120 μl的RIPA蛋白裂解液和1.2 μl PMSF蛋白酶抑制剂,冰上裂解30 min后,12 000 r/min,4 ℃离心10 min,取上清,即为细胞总蛋白。BCA蛋白定量后蛋白沸水浴加热变性,然后进行SDS-PAGE凝胶电泳,转膜,用5%的脱脂牛奶对聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)膜封闭2 h,然后以1 ∶1 000稀释后的Bcl-2、Cyclin D1、Bax、cleaved Caspase-3、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR、GAPDH一抗4 ℃孵育过夜,TBST洗膜后二抗室温孵育1.5 h,再用TBST洗膜后按照ECL试剂盒说明书配制发光液,并将PVDF膜浸入发光液中反应30 s,曝光并拍照,用ImageJ软件对曝光结果进行定量分析。
1.9 统计学分析

2 结果
2.1 lncRNA HOXD-AS1高表达于宫颈癌细胞
qRT-PCR检测结果显示,相比于人正常宫颈上皮细胞HCerEpic,宫颈癌细胞HeLa和C33A、SiHa、Caski中lncRNA HOXD-AS1表达均显著升高(P<0.001),HeLa细胞中表达水平最高,在HeLa细胞中转染siRNA抑制lncRNA HOXD-AS1表达(见图1),用于后续研究。
2.2 lncRNA HOXD-AS1调控宫颈癌细胞增殖
MTT检测细胞增殖结果显示,相比于转染si-NC的细胞,转染si-HOXD-AS1表达后,HeLa细胞的增殖能力显著下降(P<0.001,见图2)。

与HCerEpic相比,* * * P <0.001与si-NC组相比,###P <0.001图1 qRT-PCR检测lncRNA HOXD-AS1的表达水平Figure 1 Expression of lncRNA HOXD-AS1 by qRT-PCR
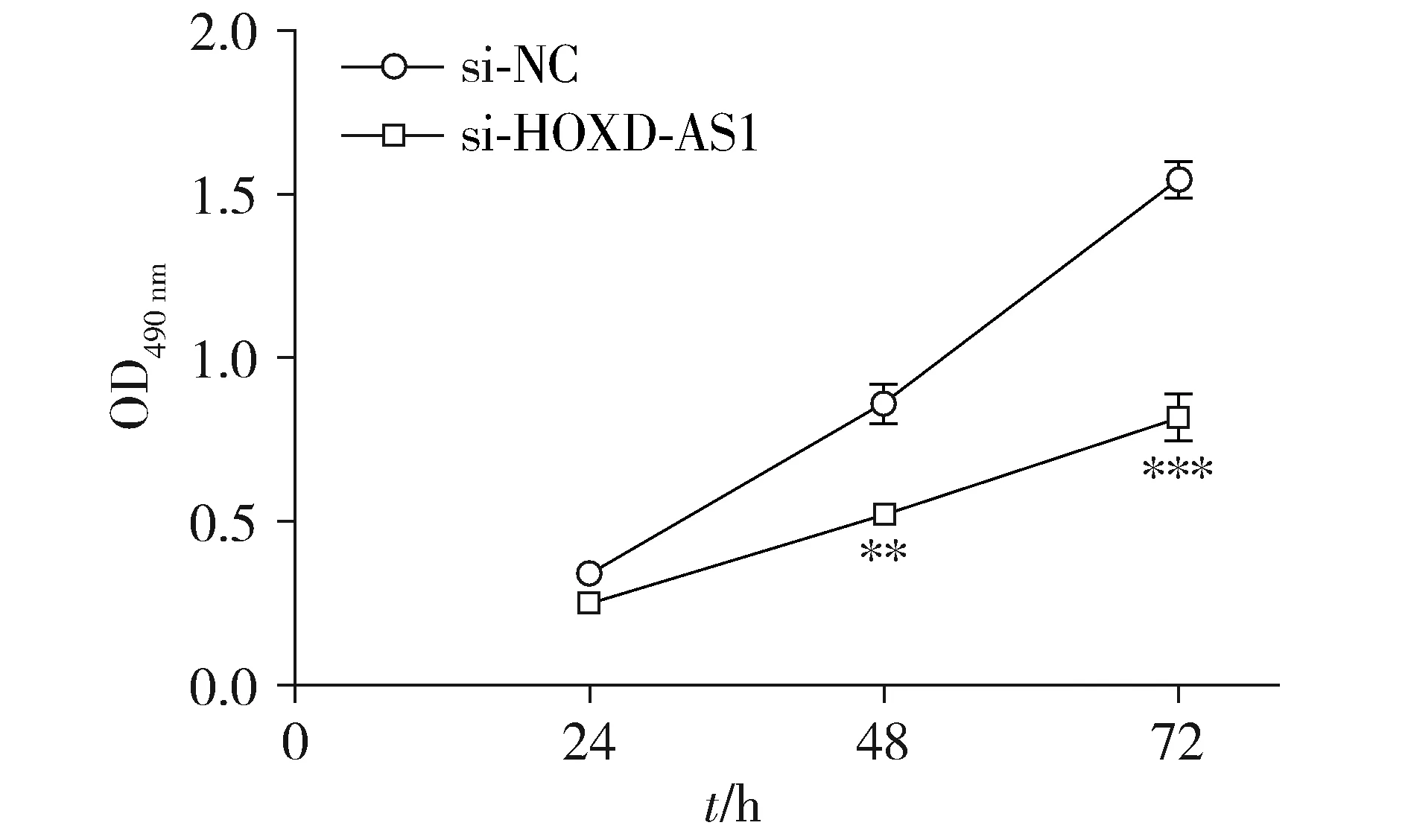
与si-NC组相比,* * P <0.01,* * * P <0.001图2 lncRNA HOXD-AS1对HeLa细胞增殖能力的影响Figure 2 Effect of lncRNA HOXD-AS1 on HeLa cell proli-feration
2.3 lncRNA HOXD-AS1调控宫颈癌细胞凋亡
流式细胞术检测细胞凋亡结果显示,转染si-NC后HeLa细胞的凋亡率为(3.17±0.24)%,转染si-HOXD-AS1后HeLa细胞的凋亡率为(25.70±0.25)%,si-HOXD-AS1组细胞凋亡显著高于si-NC组(见图3)。Western blot检测凋亡相关蛋白表达结果显示,相比于si-NC组,si-HOXD-AS1组抑凋亡蛋白Bcl-2和Cyclin D1表达显著下调(P<0.01),促凋亡蛋白Bax、cleaved Caspase-3表达显著增加(P<0.001,见图4)。
2.4 lncRNA HOXD-AS1靶向miR-133a-3p
运用miRcode数据库预测到miR-133a-3p与lncRNA HOXD-AS1 3′非翻译区(3′Untranslated Regions,3′UTR)存在结合位点(见图5)。双荧光素酶活性检测结果显示,与miR-NC组相比,miR-133a-3p mimic组WT-HOXD-AS1细胞中荧光活性显著降低(P<0.001,见图6),MUT-HOXD-AS1细胞中荧光活性无显著变化。qPCR检测结果显示,相比于si-NC组,si-HOXD-AS1组HeLa细胞中miR-133a-3p表达显著增加(P<0.001,见图7)。

图3 lncRNA HOXD-AS1对HeLa细胞凋亡水平的影响Figure 3 Effect of lncRNA HOXD-AS1 on HeLa cell apoptosis
2.5 lncRNA HOXD-AS1靶向miR-133a-3p调控宫颈癌细胞增殖
MTT检测结果显示,在48 h和72 h,相比于si-NC组,si-HOXD-AS1组HeLa细胞的增殖能力显著降低(P<0.001),而si-HOXD-AS1+miR-133a-3p inhibitor组细胞的增殖能力显著高于si-HOXD-AS1组(P<0.01,见图8)。
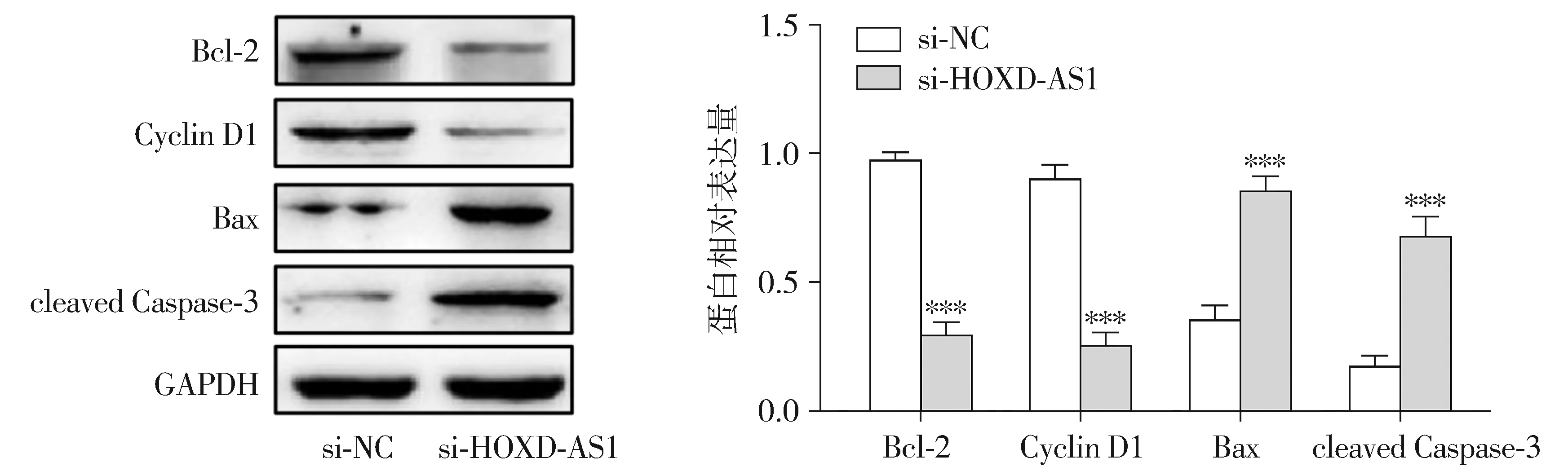
与si-NC组相比,* * * P <0.001图4 lncRNA HOXD-AS1对HeLa细胞凋亡蛋白表达的影响Figure 4 Effect of lncRNA HOXD-AS1 on the expression of apoptotic proteins in HeLa cells

图5 lncRNA HOXD-AS1与miR-133a-3p结合位点Figure 5 Binding site between lncRNA HOXD-AS1 and miR-133a-3p

与miR-NC组相比,* * * P <0.001图6 双荧光素酶基因报告实验验证lncRNA HOXD-AS1与miR-133a-3p的靶向关系Figure 6 Verification of the targeting relationship between lncRNA HOXD-AS1 and miR-133a-3p by dual luciferase gene report experiment
2.6 lncRNA HOXD-AS1靶向miR-133a-3p调控宫颈癌细胞凋亡
流式细胞术检测结果显示,转染si-NC组细胞凋亡率为(10.30±0.39)%,si-HOXD-AS1组细胞凋亡率为(20.23±1.34)%,si-HOXD-AS1组显著高于si-NC组(P<0.001);si-HOXD-AS1+miR-133a-3p inhibitor组细胞凋亡率为(13.3±0.50)%,显著低于si-HOXD-AS1组(P<0.01,见图9)。

与si-NC组相比,* * * P <0.001图7 lncRNA HOXD-AS1对miR-133a-3p表达的影响Figure 7 Effect of lncRNA HOXD-AS1 on expression of miR-133a-3p

与si-NC组相比,* * * P <0.001;与si-HOXD-AS1组比较,###P <0.01图8 lncRNA HOXD-AS1和miR-133a-3p对HeLa增殖的影响Figure 8 Effect of lncRNA HOXD-AS1 and miR-133a-3p on HeLa cell proliferation

与si-NC组相比,* * * P <0.001;与si-HOXD-AS1组比较,##P <0.01图9 lncRNA HOXD-AS1和miR-133a-3p对HeLa凋亡的影响Figure 9 Effect of lncRNA HOXD-AS1 and miR-133a-3p on HeLa apoptosis
2.7 lncRNA HOXD-AS1靶向miR-133a-3p调控PI3K/AKT/mTOR信号通路
Western blot检测结果显示,相比于si-NC组,si-HOXD-AS1组细胞PI3K、AKT、mTOR磷酸化水平显著降低(P<0.01);相比于si-HOXD-AS1组,si-HOXD-AS1+miR-133a-3p inhibitor组细胞PI3K、AKT、mTOR磷酸化水平显著升高(P<0.01,见图10)。

与si-NC组相比,* * * P <0.001;与si-HOXD-AS1组相比,##P <0.01,###P <0.001图10 lncRNA HOXD-AS1和miR-133a-3p对PI3K/AKT/mTOR信号通路的影响Figure 10 Effect of lncRNA HOXD-AS1and miR-133a-3p on PI3K/AKT/mTOR signaling pathway
3 讨论
宫颈癌是一种常见的发病率高的女性恶性肿瘤,其发病机制复杂,治疗效果有限。有研究表明,分子靶向药物或可在肿瘤的治疗中发挥作用[9],随着高通量测序和基因芯片技术的发展,越来越多的非编码RNA被发现在肿瘤的发生和发展中发挥调控作用,lncRNA作为非编码RNA的一种,是一种转录组的重要部分,功能复杂,可调控肿瘤等疾病的病理进程。研究表明,lncRNA可在肿瘤组织中差异表达,通过转录调控、表观修饰调控基因的表达,进而影响肿瘤的生长、转移、耐药等[10-13]。lncRNA HOXD-AS1已经被报道在多种肿瘤中发挥调控作用,Yang等[14]研究发现,lncRNA HOXD-AS1能够通过抑制HOXD3诱导的整联蛋白β3转录激活和MAPK/AKT信号通路传导调控大肠癌的生长和转移。Wang等[15]研究发现,HOXD-AS1通过miR-608/FZD4轴促进卵巢癌的细胞增殖、迁移和侵袭。亦有研究表明[6-8],HOXD-AS1可作为神经母胶质瘤转移的生物标志物,亦可作为膀胱癌的治疗靶点,也可调控前列腺癌的增殖以及化疗耐药性。HOXD-AS1对宫颈癌的影响尚未明确研究,本文探究了HOXD-AS1对宫颈癌细胞增殖和凋亡的影响及机制,旨在为宫颈癌的临床治疗提供帮助。
本研究通过qPCR检测发现HOXD-AS1高表达于宫颈癌细胞HeLa和C33A,提示HOXD-AS1可能影响宫颈癌的病理进程。HOXD-AS1在HeLa细胞中表达最高,所以我们转染siRNA抑制HeLa细胞中HOXD-AS1表达,结果发现抑制其表达后HeLa细胞增殖能力显著下降,细胞凋亡水平显著增加,抑凋亡蛋白Bcl-2和Cyclin D1表达显著下调,促凋亡蛋白Bax、cleaved Caspase-3表达显著增加,说明HOXD-AS1能够影响宫颈癌细胞的生长,所以本文又进一步探究了HOXD-AS1调控宫颈癌增殖和凋亡水平的机制。
在哺乳动物中lncRNA多通过调控miRNA的表达而调控各种病理生理过程,研究表明[16,17],HOXD-AS1可通过调控miR-186-5p影响卵巢癌的进展,亦可通过调控miR-421表达调控乳腺癌进程。本研究通过miRcode数据库预测到miR-133a-3p为HOXD-AS1靶向结合的miRNA,又通过双荧光素酶报告基因实验验证了二者的靶向关系,转染siRNA抑制HOXD-AS1表达后发现miR-133a-3p表达上调,所以我们推测HOXD-AS1可通过调控miR-133a-5p表达促进宫颈癌的生长,并且同时抑制宫颈癌细胞HOXD-AS1和miR-133a-3p表达,HeLa细胞的增殖能力显著增加,细胞凋亡水平显著下调,进一步说明HOXD-AS1能够通过靶向调控miR-133a-3p的表达影响HeLa细胞的增殖和细胞凋亡。
PI3K/AKT/mTOR信号通路是调控肿瘤生长和转移的关键通路,已有研究表明,PI3K/AKT/mTOR信号通路的激活可显著抑制肿瘤细胞的凋亡,主要机制为PI3K/AKT/mTOR信号通路激活后可调控caspase家族蛋白如caspase-3、caspase-9的表达而抑制细胞凋亡;并且AKT激活后可磷酸化Bad的Ser136/Ser112残基,Bad磷酸化后再与Bcl-2解聚,游离的Bcl-2可发挥抗凋亡的作用[18,19]。本研究发现,HOXD-AS1能够调控凋亡相关蛋白Bcl-2、Cyclin D1、Bax和cleaved Caspase-3表达,所以本文探究了HOXD-AS1对PI3K/AKT/mTOR信号通路的影响,结果显示,抑制HOXD-AS1表达后HeLa细胞中PI3K、AKT、mTOR磷酸化水平均显著下调,而抑制HOXD-AS1表达的同时抑制miR-133a-3p的表达,PI3K、AKT、mTOR磷酸化水平亦被显著上调,说明HOXD-AS1能够通过靶向miR-133a-3p而影响PI3K/AKT/mTOR信号通路的激活。
综上所述,HOXD-AS1可促进宫颈癌细胞的增殖,抑制宫颈癌细胞凋亡,其机制为通过靶向miR-133a-3p影响PI3K/AKT/mTOR信号通路的激活。
