帕金森病伴RBD患者睡眠结构与认知功能及自主神经功能症状的相关性*
2021-05-21张靖吴小云王俊男贾婕安志恒刘冬
张靖,吴小云,王俊男,贾婕,安志恒,刘冬
(张家口市第一医院1.神经内一科,2.神经外科,3.呼吸三科,河北 张家口075000;4.陆军第八十一集团军医院 门诊部,河北 张家口075000)
帕金森病(Parkinson's disease, PD)是临床中最常见的神经类疾病之一,属于一种神经退行性病变,其发病机制主要是由于各种原因导致的中脑黑质发生病理性改变,正常情况下中脑有黑质纹状体,但随着年龄的增长黑质纹状体会慢慢地退化、减少,当减少到一定程度,就会出现帕金森病,其主要表现是静止性震颤、运动迟缓[1-3]。大多数帕金森病患者都伴有睡眠障碍,快速眼动期睡眠行为障碍(rapid eye movement sleep disorder,RBD)就是其中最常见的一种。RBD 是一种睡梦中的暴力行为,是会随着梦境一直做活动的运动,主要表现为患者丧失正常状态下伴有的肌张力抑制,在老年群体中多发,且与脑血管疾病、精神压抑、过度饮酒等有关[4-6]。有研究显示,帕金森病伴RBD 常伴有睡眠结构异常、神经功能损伤与认知功能障碍,而近几年对于帕金森病伴RBD 睡眠结构与认知功能及自主神经功能症状的报道较少[7]。基于此,本研究通过探究帕金森病伴RBD 患者睡眠结构与认知功能及自主神经功能症状的关系,为临床治疗提供依据。
1 资料与方法
1.1 一般资料
选取2017年6月—2019年6月在张家口市第一医院就诊的160 例帕金森病患者,根据其是否伴有RBD 分为研究组(帕金森病伴RBD)80 例与对照组(单纯帕金森病患者)80 例。
纳入标准:①符合中华医学会、中华医学会杂志社、中华医学会全科医学分会等编写的《帕金森病基层诊疗指南(2019年)》[8]中的帕金森病诊断标准;②年龄<80岁;③心功能分级≤Ⅱ级;④临床资料完整,能够配合完成本次研究者;⑤知情并签署知情同意书者。排除标准:①合并感染性疾病者;②恶性肿瘤者;③免疫系统疾病者;④血液系统疾病;⑤存在严重心律失常或瓣膜疾病者;⑥智力或认知障碍不能配合本研究者。
1.2 观察指标
采用视频- 多导睡眠监测技术(videopolysomnography, v-PSG) 检测两组患者的睡眠结构;对所有研究对象采用多导睡眠视频脑电检测仪(广州尼高力科学仪器有限公司,NT9200 型)检测患者的睡眠结构,睡眠分期结果根据2.0.3 版美国睡眠医学学会(American academy of sleep medicine,AASM)睡眠分期规则。两组患者均检测两夜。检测项目包括非快速眼动(non-rapid eye movement,NREM)1+2 期睡眠比例、NREM3+4 期睡眠比例、快速眼动(rapid eye movement, REM)期睡眠比例、睡眠潜伏期、REM 睡眠潜伏期、REM 睡眠周期、总睡眠时间(total sleep time, TST)、觉醒指数和睡眠效率(sleep efficiency,SE)[9]。
采用简易精神状态检查量表(mini-mental state examination, MMSE)和蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)评估两组患者的认知功能:指导患者填写MMSE 评估量表与MoCA 评估量表,其中MMSE 包括时间定向力、地点定向力、延迟记忆、即刻记忆、注意力及计算、视空间和语言;MoCA 包括执行功能、注意与集中、语言、记忆、抽象思维、视结构技能、计算和定向力。分数越高,认知能力越好[10-11]。
采用帕金森病患者自主神经功能症状评定量表(SCOPA-AUT)评估患者的自主神经功能症状。观察项目包括消化、泌尿、心血管、体温调节、交感副交感、生殖[12]6 大自主神经系统共23 条症状,每条0~3 分,满分69 分,评分越高,表明自主神经功能障碍越重。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以例(%)表示,比较用χ2检验;相关性分析用Pearson 法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
两组患者性别构成、年龄、文化程度及临床分型比较,差异无统计学意义(P>0.05)。见表1。
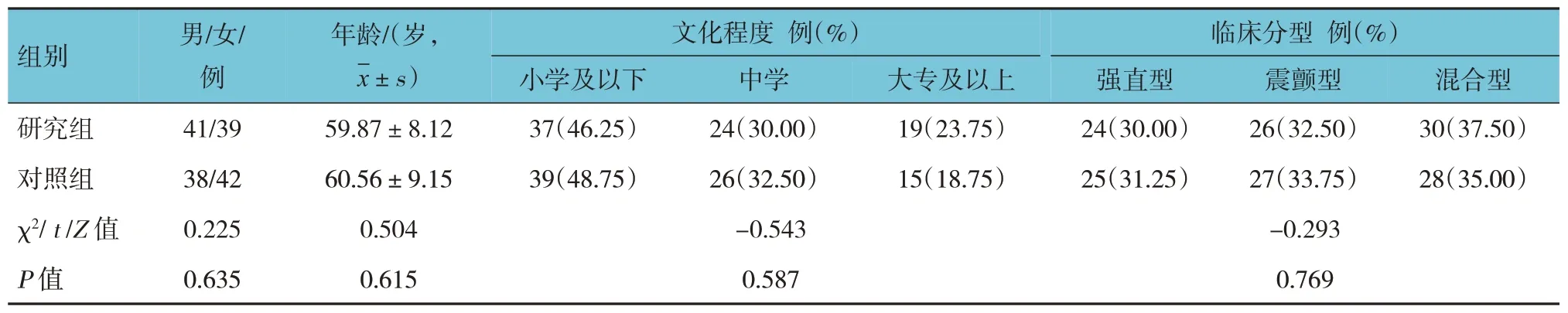
表1 两组患者临床资料比较 (n=80)
2.2 两组患者睡眠结构比较
两组NREM1+2 期睡眠比例比较,经χ2检验,差异有统计学意义(P<0.05),研究组高于对照组;两组睡眠潜伏期和REM 睡眠潜伏期比较,经t检验,差异有统计学意义(P<0.05),研究组长于对照组;两组REM 睡眠周期、TST、SE 比较,差异有统计学意义(P<0.05),研究组数值小于对照组。见表2。
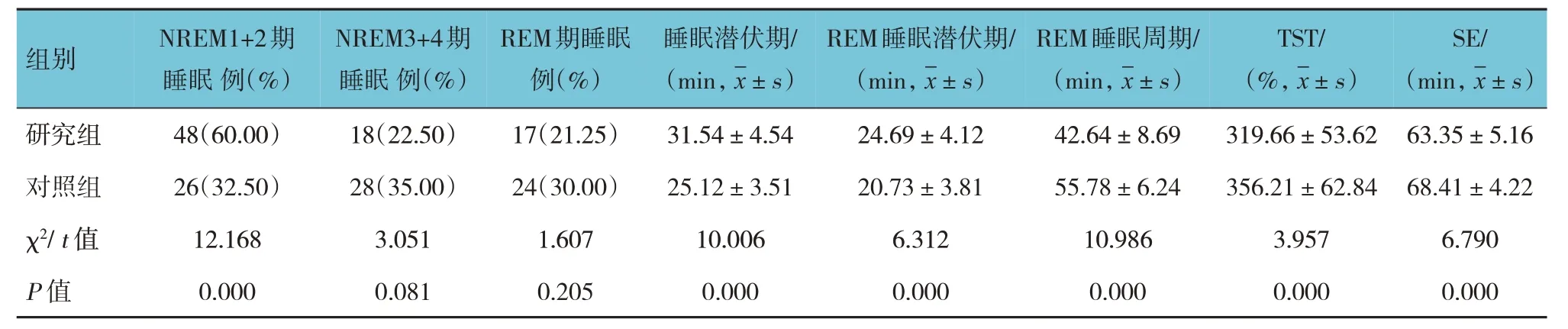
表2 两组患者睡眠结构比较 (n=80)
2.3 两组患者认知功能比较
两组患者认知功能比较,经t检验,差异有统计学意义(P<0.05),研究组MMSE、MoCA 评分均低于对照组。见表3。
表3 两组患者认知功能比较 (n=80,分,±s)
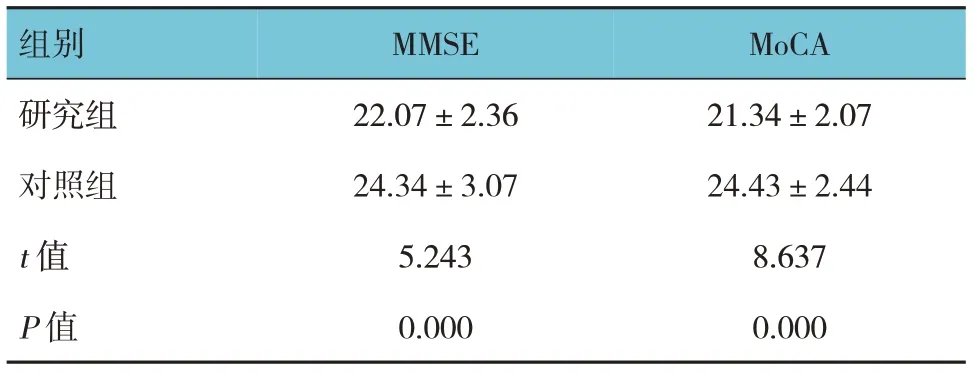
表3 两组患者认知功能比较 (n=80,分,±s)
组别MMSE MoCA研究组对照组t 值P 值22.07±2.36 24.34±3.07 5.243 0.000 21.34±2.07 24.43±2.44 8.637 0.000
2.4 两组患者自主神经功能症状评分比较
两组患者自主神经功能症状评分比较,采用t检验,差异有统计学意义(P<0.05),研究组消化系统、泌尿系统、心血管系统评分均高于对照组。见表4。
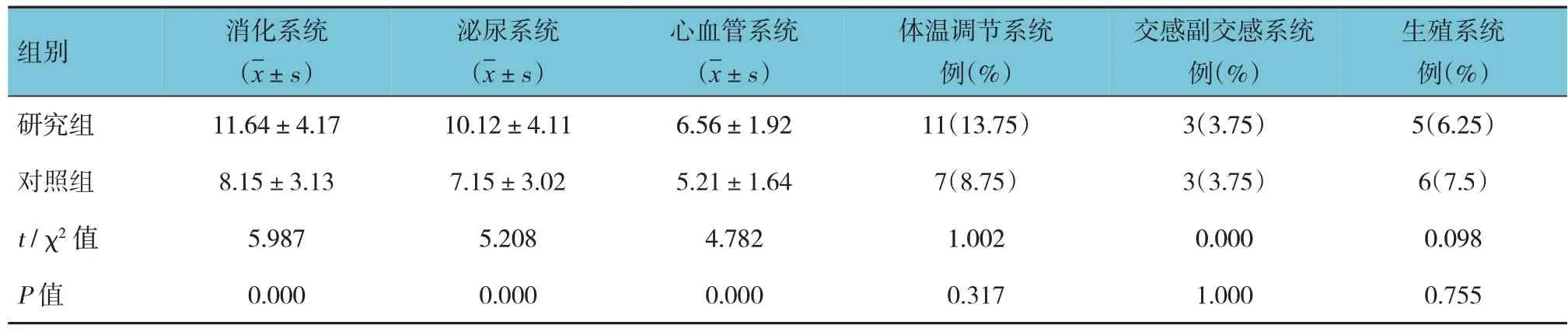
表4 两组患者自主神经功能症状评分比较 (n=80)
2.5 睡眠结构与自主神经功能症状评分的相关性
相关性分析结果显示,NREM1+2 期睡眠比例与体温调节系统呈负相关(r=-0.341,P<0.05);NREM3+4 期睡眠比例与泌尿系统评分呈负相关(r=-0.344,P<0.05);睡眠潜伏期与消化系统、泌尿系统、心血管系统评分呈正相关(P<0.05);REM 睡眠潜伏期与消化系统、泌尿系统、心血管系统评分呈正相关(P<0.05);REM 睡眠周期与消化系统、泌尿系统、心血管系统评分呈正相关(P<0.05);TST 与消化系统、泌尿系统、心血管系统评分呈正相关(P<0.05);SE 与消化系统、泌尿系统、心血管系统评分呈正相关(P<0.05)。可见表5。
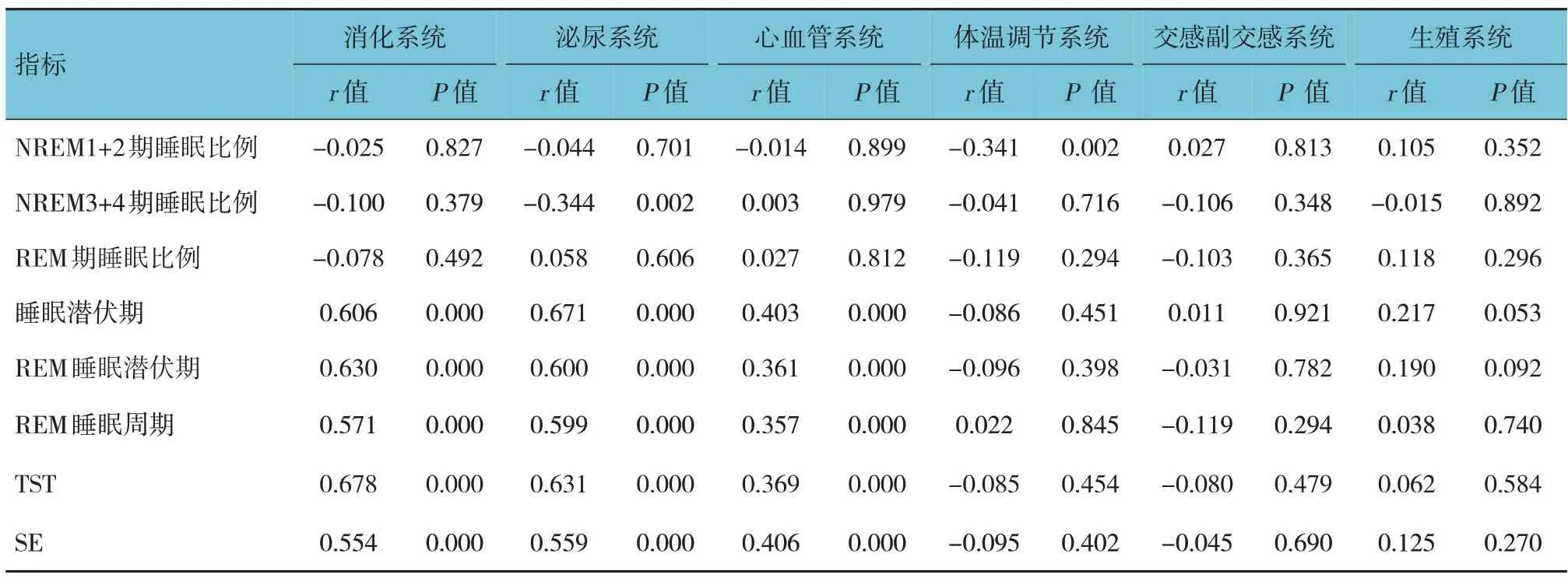
表5 睡眠结构与自主神经功能症状的相关性分析结果
3 讨论
PD 主要表现为患者动作变慢,尤其是开始动作时存在一定的困难且主动的运动功能也逐渐丧失。除运动外,其语言及饮食上都存在明显症状,例如吐字不清晰,吞咽困难等[13-15]。大多PD 患者都伴有睡眠障碍,RBD 是最常见的一种,睡眠分快速眼球运动睡眠和非快速眼球运动,做梦一般是处于睡眠分快速眼球运动睡眠,此时大脑皮层处于活跃状态,除了呼吸肌以外,其他骨骼都处于放松状态,若肌张力在梦境和睡眠后不降低,且随着梦境出现肢体活动,这就被称为睡眠分快速眼球运动睡眠障碍[16-18]。
有病理学研究结果显示,PD 与RBD 存在相关性,当PD 患者的中脑发生损伤时,患者会发生睡眠障碍,既往研究也证实长期睡眠不佳会导致认知功能下降,但目前对PD 伴RBD 患者睡眠结构与认知功能及自主神经功能症状的关系尚未完全阐明[19-20]。
本研究结果显示,NREM3+4 期睡眠比例与MoCA、泌尿系统评分呈负相关;睡眠潜伏期与MMSE、MoCA、消化系统、泌尿系统、心血管系统评分呈正相关;REM 睡眠潜伏期与MMSE、MoCA、消化系统、泌尿系统、心血管系统评分呈正相关;REM 睡眠周期与MMSE、MoCA、消化系统、泌尿系统、心血管系统评分呈正相关;TST 与MMSE、MoCA、消化系统、泌尿系统、心血管系统评分呈正相关;SE 与MMSE、MoCA、消化系统、泌尿系统、心血管系统评分呈正相关。可知,睡眠结构与认知功能及自主神经功能(消化系统、泌尿系统、心血管系统)存在一定相关性。吴俊丽的研究结果显示,观察组MMSE 与MoCA 评分同NREM3+4 期睡眠比例、REM 期睡眠比例、REM 睡眠周期、TST 和SE 呈正相关,与NREM1+2 期睡眠比例、睡眠潜伏期、REM 睡眠潜伏期和觉醒指数呈负相关[21]。病理学证实PD 主要表现黑质纹状体多巴胺代谢障碍,而REM 患者纹状体脑血流灌注发生异常,此外研究发现PD 患者额叶前端皮质多巴胺投射系统对认知功能起重要作用[22]。因此推测PD 伴REM 患者发生认知损害,且有大鼠实验结果显示,迷走神经背核的胆碱能神经元数目减少伴路易小体聚集,造成胃肠道神经的支配动力下降,电生理监测发现其胃动力明显减弱,从而产生便秘、消化不良等症状;且尸检证明PD 患者的脑干已经出现迷走及舌咽神经核团的损伤[23-25]。本研究表明RBD 与认知及自主神经相关性显著,这可能是因为大脑广泛受累,RBD 是脑干神经核团受累导致出现认知损害,因此认知功能下降;路易小体最先出现在嗅球及迷走神经运动背核,且外周自主神经节同样参与该过程,引发与RBD 相关的脑干改变,包含脑桥蓝斑,所以RBD 的PD 患者多存在自主神经功能紊乱的情况,相关性显著。
综上所述,睡眠结构与认知功能及自主神经功能(消化系统、泌尿系统、心血管系统)存在一定相关性,可推断PD 伴RBD 患者睡眠结构紊乱出现认知功能障碍和自主神经功能症状的风险更高。
