基于任务态fMRI的rTMS促进脑卒中伴运动功能障碍患者运动功能恢复及其机制的研究*
2021-05-21包元飞杜朝品顾玉玲陈小东
包元飞,杜朝品,顾玉玲,陈小东
(南通大学附属南通第三医院1.神经内科,2.康复科,3.影像科,江苏 南通226000)
脑卒中在临床被分为出血性脑卒中与缺血性脑卒中,目前已经成为全世界范围内致残的主要原因之一[1]。脑卒中患者接受标准的康复治疗后,大部分仍会有不同严重程度的运动功能障碍[2],对患者的生活产生较大的影响,给患者家庭、社会带来较大的负担。有研究认为[3],脑卒中为高异质性,目前临床上对脑卒中后发生运动功能障碍的机制尚不明确,使现有的康复治疗脑卒中合并运动功能障碍的效果并不理想,大多数患者预后不良。目前随着影像技术的不断发展,神经病学领域中经颅磁刺激的应用逐渐广泛,且已经证实脑卒中运动功能的恢复与神经可塑性有关,但其作用的具体机制尚未完全明确[4]。因此本研究对脑卒中伴运动功能障碍的患者行重复经颅磁刺激(repeated transcranial magnetic stimulation, rTMS)治疗, 在任务态功能性磁共振成像(functional magnetic resonance imaging, fMRI)的基础上分析rTMS对脑卒中伴运动功能障碍患者运动功能恢复的影响,并探讨其机制。
1 资料与方法
1.1 研究对象
选取2017年1月—2019年1月南通大学附属南通第三医院收治的脑卒中伴运动功能障碍患者120 例。按照完全随机化设计将所有患者随机分为高频组、低频组和假刺激组,每组40例。高频组:男性24例,女性16 例;年龄45~70 岁,平均(57.5±1.5)岁;病灶位于皮层5 例,皮层下29 例,皮层+皮层下6 例。低频组:男性20 例,女性20 例;年龄45~70 岁,平均(57.6±1.3)岁;病灶部位位于皮层7 例,皮层下26 例,皮层+皮层下7 例。假刺激组:男性18 例,女性22 例;年龄45~70 岁,平均(57.8±1.6)岁;病灶部位位于皮层8 例,皮层下25 例,皮层+皮层下7 例。3 组患者的性别构成、平均年龄、病灶部位等一般资料比较,差异无统计学意义(P>0.05),具有可比性(见表1)。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书,本研究经中国临床试验注册中心注册批准(ChiCTR-IOR-14005363)。纳入标准:①均为缺血性卒中;②MRI检查显示梗死病灶区分布在大脑动脉供血区;③发病时间≤15 d;④单侧上肢运动功能障碍。排除标准:①存在感觉性失语、癫痫、忽视等症状;②TMS、MRI 禁忌证者;③认知功能障碍者;④合并患有其他神经系统类疾病者;⑤有肿瘤史、脑外伤史、癫痫家族史;⑥心、肺、肝、肾功能不全者;⑦长期酗酒或长期服用镇静药物、抗抑郁药物等可改变皮层兴奋性的药物者。
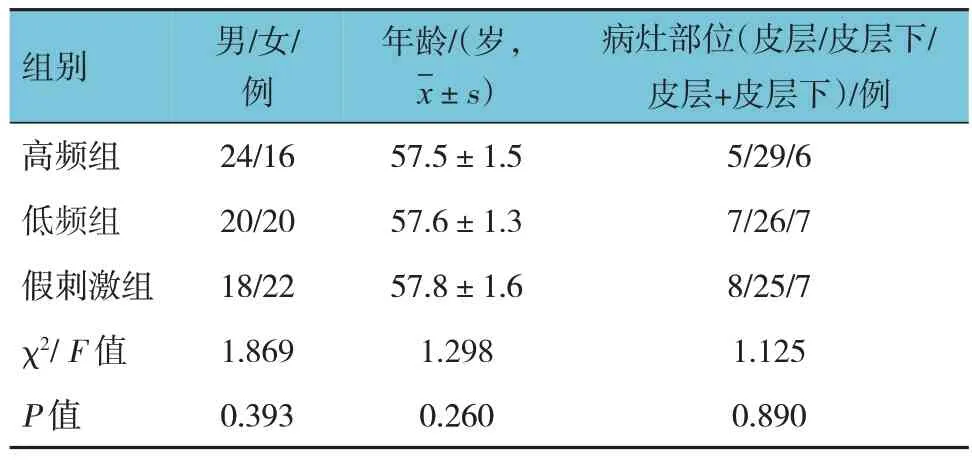
表1 3组患者一般资料比较 (n=40)
1.2 方法
1.2.1 治疗方法所有患者均行统一基础康复治疗方案:①脑卒中二级预防,包括合理膳食、控制血压、血脂、血糖及抗血小板聚集药物的应用。②康复评定与治疗,包括物理疗法、作业疗法、言语评定与治疗、构音障碍的评定与治疗、吞咽障碍的评定与治疗、认知功能评定与治疗、心理评定与治疗等。③rTMS 参照国际联邦临床生理学指南的安全性推荐参数进行设定,rTMS 设备均使用深圳英智科技有限公司的S-100A 型脉冲磁场刺激仪。高频组患者使用高频rTMS 治疗,采用10 Hz 刺激患侧半球的M1区,刺激强度为100%静息运动阈值,刺激时间持续4 s,间隔40 s,共行30 次,总刺激量1 200 个脉冲,总刺激时间22 min。低频组患者使用低频rTMS治疗,采用1 Hz刺激患者键侧半球的M1区,刺激强度为100%静息运动阈值,刺激时间持续120 s,间隔40 s,共行10 次,总刺激量1 200 个脉冲,总刺激时间26 min。假刺激组患者行rTMS 假刺激治疗,刺激参数、频率、时间、部位同低频组,将线圈反转置于患者头颅表面,形成相同的刺激声音,为无效刺激。3 组患者均连续刺激5 d,并在每日刺激后行常规康复训练,包括Rood 方法、Bobath 技术、PNF技术、Brunnstrom 技术加快患者运动功能的恢复,并根据患者情况制订促进原发病恢复、预防卒中再发的治疗方案。
1.2.2 上肢功能评价使用Fugl-Meyer 评定量表(运动功能)(FMA)对两组患者治疗前、治疗后5 d、治疗后3 个月的上肢运动功能进行评价,内容包括患者上肢、手、腕、协调能力等4 个方面,每个方面评分为0~2 分,总分为66 分,分数越高说明患者运动功能越好。使用Wolf 运动功能测试量表(WMFT)对患者治疗前后上肢功能进行评价,内容包括前臂与手放到指定位置的能力、前臂回收能力、侧方伸肘能力及手抓握和精细动作评定等,共15 项,计分为6 个等级,分别计为0~5 分,总分75 分,分数越高说明患者上肢功能越好。
1.2.3 运动功能评价使用卒中患者运动功能评估量表(MAS)对两组患者治疗前、治疗后5 d,治疗后3 个月的运动功能进行评价,内容包括患者整体运动能力和任务完成能力,共9 项,计分为6 个等级,分别计为0~5 分,总分48 分,分数越高说明患者整体运动功能越好。
1.2.4 平衡功能评价使用Berg 平衡量表(BBS)对两组患者治疗前、治疗后5 d,治疗后3 个月的平衡能力进行评价,内容分为坐位、站立位、闭目、弯腰等各种体位下维持平衡的能力,共14 项,计分为5 个等级,分别计为1~5 分,总分56 分,分数越高说明患者平衡功能越好。
1.2.5 运动皮层兴奋性评价使用单脉冲TMS 检测运动诱发电位(motor evoked potential, MEP)对患者双侧半球运动皮层兴奋性进行评价,在患者侧拇短展肌上能持续获得稳定、最大MEP 振幅的运动皮质区,即可确定为TMS 的最佳刺激点。对刺激强度进行调整后行最大MEP,记录患者患侧半球MEP 潜伏期和MEP 最大振幅。
1.2.6 fMRI 数据采集使用3.0T 的GE 750 磁共振扫描成像系统,标准的头颅32 通道线圈,使用常规的MRI、3D 高分辨T1W1解剖像、任务态fMRI 对患者进行全脑扫描。任务态fMRI 扫描使用单次激发平面回波成像序列,采用组块设计,让患者患手、健手均做拇指与食指的对指运动,患手做被动运动,共做5 次,15 个组块,每个组块持续20 s,扫描5 min。在MATLAB 7.14平台上采用SPM8、DPARSFA软件处理任务态fMRI 数据,分析患者治疗前后任务态fMRI的变化。
1.3 统计学方法
数据分析采用SPSS 23.0 统计软件。计量数据以均数±标准差(±s)表示,多组间的比较采用单因素方差分析或重复测量的方差分析,进一步两两比较采用LSD-t检验,重复测量分析之时间维度的多次比较按Bonferroni 校正法调整检验水准α'=0.025;计数资料以例(%)表示,比较采用χ2检验或校正χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3组患者治疗前后上肢FMA、WMFT评分比较
3 组患者治疗前后上肢FMA、WMFT 评分比较,采用重复测量设计的方差分析,结果:①不同时间点的上肢FMA、WMFT 评分有差异(F=3 456.019 和1 350.245,均P=0.000);②3 组的上肢FMA、WMFT评分有差异(F=278.158 和451.921,均P=0.000);③3 组的上肢FMA、WMFT 评分变化趋势有差异(F=88.131 和93.738,均P=0.000)。进一步两两比较,低频组、高频组治疗后的上肢FMA、WMFT 评分较假刺激组升高(P<0.05);3 组治疗后5 d 和治疗后3 个月的上肢FMA、WMFT 评分比治疗前升高(P<0.025)。见表2。
表2 3组患者治疗前后上肢FMA、WMFT评分比较 (n=40,±s)
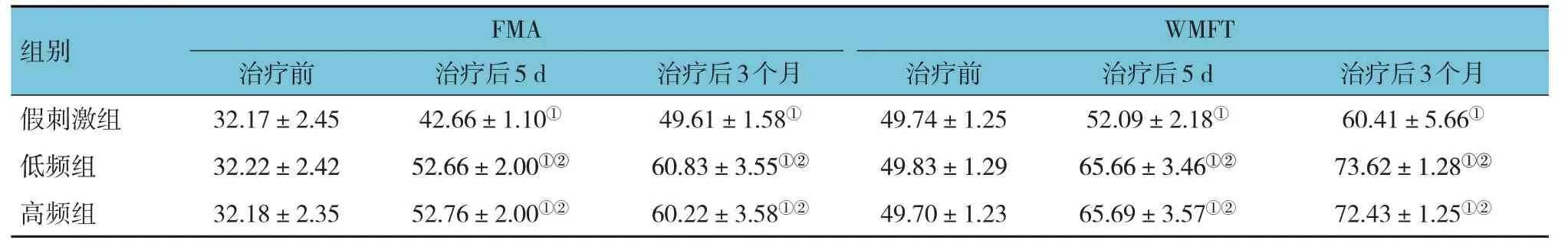
表2 3组患者治疗前后上肢FMA、WMFT评分比较 (n=40,±s)
注:①与组内治疗前比较,P <0.025;②与假刺激组同时间点比较,P <0.05。
组别假刺激组FMA WMFT治疗后3个月60.41±5.66①治疗后5 d 42.66±1.10①治疗前32.17±2.45治疗后3个月49.61±1.58①治疗前49.74±1.25治疗后5 d 52.09±2.18①低频组高频组73.62±1.28①②72.43±1.25①②52.66±2.00①②52.76±2.00①②32.22±2.42 32.18±2.35 60.83±3.55①②60.22±3.58①②49.83±1.29 49.70±1.23 65.66±3.46①②65.69±3.57①②
2.2 3组患者治疗前后MAS、BBS评分比较
3组患者治疗前后MAS、BBS评分比较,采用重复测量设计的方差分析,结果:①不同时间点的MAS、BBS 评分有差异(F=863.382 和3 479.644,均P=0.000);②3 组的MAS、BBS 评分有差异(F=438.563 和317.284,均P=0.000);③3 组的MAS、BBS 评分变化趋势有差异(F=109.768和72.441,均P=0.000)。进一步两两比较,低频组、高频组治疗后的MAS、BBS 评分较假刺激组升高(P<0.05);3组治疗后5 d和治疗后3个月的MAS、BBS评分较治疗前升高(P<0.025)。见表3。
表3 3组患者治疗前后MAS、BBS评分比较 (n=40,±s)

表3 3组患者治疗前后MAS、BBS评分比较 (n=40,±s)
注:①与组内治疗前比较,P <0.025;②与假刺激组同时点比较,P <0.05。
组别假刺激组MAS BBS治疗后3个月38.59±2.58①治疗前36.87±1.24治疗后5 d 38.58±2.50①治疗后3个月41.11±3.55①治疗前25.46±0.70治疗后5 d 32.55±1.50①低频组高频组45.17±1.22①②45.22±1.23①②36.99±1.24 36.86±1.24 48.53±3.63①②49.71±3.65①②55.81±2.29①②55.37±2.20①②25.39±0.71 25.38±0.68 38.65±2.28①②39.53±2.27①②
2.3 3组患者治疗前后大脑皮层兴奋性变化
3组患者治疗前后患侧半球MEP潜伏期和最大振幅比较,采用重复测量设计的方差分析,结果:①不同时间点的患侧半球MEP 潜伏期和最大振幅有差异(F=3 735.704 和28.080,均P=0.000);②3 组患侧半球MEP 潜伏期和最大振幅有差异(F=557.442 和5.525,P=0.000 和0.005);③3 组患侧半球MEP 潜伏期和最大振幅变化趋势有差异(F=142.544 和6.852,均P=0.000)。进一步两两比较,与假刺激组比较,低频组、高频组治疗后的患侧半球MEP潜伏期延长、MEP最大振幅下降(P<0.05);3 组治疗后5 d 和治疗后3 个月的患侧半球MEP 潜伏期比治疗前延长,MEP最大振幅下降(P<0.025)。见表4。
表4 3组患者治疗前后大脑皮层兴奋性变化比较 (n=40,±s)

表4 3组患者治疗前后大脑皮层兴奋性变化比较 (n=40,±s)
注:①与组内治疗前比较,P <0.025;②与假刺激组同时点比较,P <0.05。
组别假刺激组MEP潜伏期/ms MEP最大振幅/mV治疗后3个月24.46±0.54①治疗前1.12±0.02治疗后5 d 1.35±0.08①治疗后3个月1.98±0.01①治疗前25.48±2.46治疗后5 d 25.08±1.99低频组高频组23.46±1.20①②23.62±1.03①②1.13±0.03 1.10±0.01 2.00±0.10①②2.01±0.16①②2.60±0.19①②2.64±0.20①②25.48±2.43 25.56±2.42 24.29±0.65①②24.14±0.68①②
2.4 3 组患者治疗前后患手运动时脑激活任务态fMRI的变化
3 组患者治疗前后患手运动时脑激活任务态fMRI 变化见图1:与治疗前比较,假刺激组患者治疗后患侧运动区激活物无明显改善,低频组患者患侧运动区激活增加(红黄色块,面积变大趋亮),健侧运动区激活减小(蓝色块,亮度变小趋无),高频组患者患侧运动区激活显著增加(红黄色块,面积变大趋亮)。
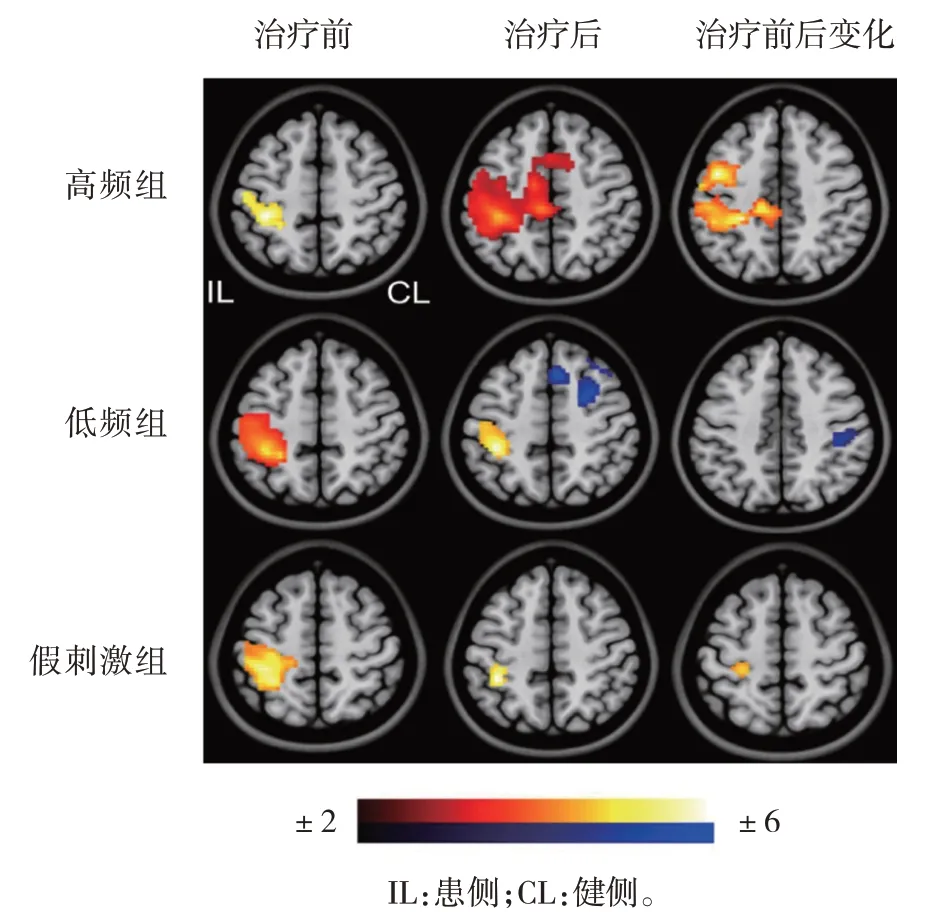
图1 3组患者治疗前后患手运动时脑激活任务态fMRI的变化
2.5 3 组患者治疗前后患手运动时脑激活任务态fMRI的组间变化
3 组患者治疗前后患手运动时脑激活任务态fMRI 组间变化见图2:治疗前3 组患者脑激活程度相近;治疗后与治疗前相比3 组患者双侧M1、辅助运动区(supplementary motor area, SMA)均被激活(红黄色块,面积变大趋亮)。治疗后高频组与假刺激组比较,高频组患者患侧M1、SMA 明显正向激活(红黄色块,面积变大趋亮);治疗后低频组与假刺激组比较,低频组患者患侧M1 明显负向激活(蓝色块,亮度变小趋无);治疗后高频组与低频组比较,两组患者双侧M1、SMA 均明显正向激活(红黄色块,面积变大趋亮)。
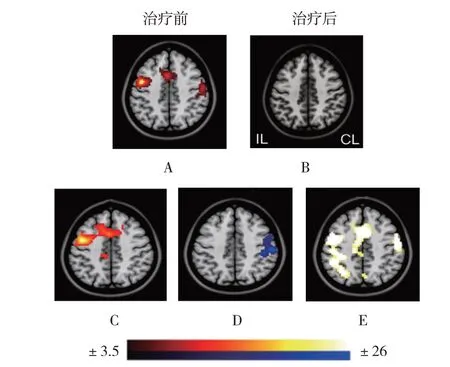
图2 3组患者治疗前后患手运动时脑激活任务态fMRI的组间变化
3 讨论
随着康复治疗的广泛应用,脑卒中伴运动功能障碍患者逐渐接受康复治疗,通过对患者行个体化的康复训练,患者的运动功能障碍得到一定程度的改善,但仍有部分患者在康复治疗中出现下肢康复容易,上肢康复困难的状况,导致多数患者患侧上肢功能无法具备肢体实用功能[5]。
TMS 属于一种无痛、无创、安全的非侵入性磁刺激技术,一方面可用于神经康复治疗,另一方面可对神经功能进行评估,被称为“21世纪四大脑科学技术”[6]。rTMS 是一种在TMS 的基础上发展而来,通过对刺激频率进行调节(其中低频率对神经元进行刺激,高频率对兴奋神经元进行刺激),进而对大脑神经可塑性、皮层兴奋性进行调节,最终促进脑卒中伴运动功能障碍患者运动功能的恢复[7-9]。有研究认为[10],rTMS 的作用原理为磁生电、电生磁,通过作用于神经系统,对颅内电生理活动、代谢活动发生改变,调节皮质兴奋性,进而改善脑局部血流、脑代谢,最终改善神经系统活动,促进神经功能恢复。另外有研究认为[11-13],rTMS 治疗的目的为降低健侧脑、增加患侧脑的兴奋性,最终对患侧脑的抑制降低。孔培培等[14]认为低频rTMS 可改善缺血性脑卒中恢复期患者的认知功能与肢体运动功能,并提升其执行能力。范真真等[15]发现,对脑卒中抑郁患者行高频rTMS 联合高压氧治疗可改善患者抑郁症状。另外梁绮婷等[16]认为高频rTMS 可改善脑卒中患者的感觉功能和上肢功能。rTMS 可改善脑卒中患者的运动功能障碍已被越来越多的研究证实,但目前临床上对rTMS 改善脑卒中患者运动功能障碍的具体作用机制尚不明确,导致不同的个体接受rTMS 治疗的变异性增大,使得其在脑卒中患者恢复治疗中的应用仍存在局限性。本研究中使用rTMS 对脑卒中伴运动功能障碍患者进行治疗,结果显示,使用高频rTMS、低频rTMS 治疗的患者与rTMS 假刺激患者比较,其上肢功能、运动功能及平衡功能均得到显著改善,且使用高频、低频治疗的患者上述功能恢复情况无差异。结果说明,rTMS 可促进脑卒中伴运动功能障碍患者运动功能的恢复。
近年来,随着功能影像技术的不断发展,fMRI 是目前脑功能研究的一个热点,因fMRI 具有空间、时间分辨率高、可重复、无辐射损伤及可以重复检测等优点。理论意义上认为,凡以反映器官功能状态成像为目标的磁功能成像技术都应称之为功能磁共振成像。观察脑神经元活动和神经通路的fMRI,包括水平依赖成像、脑代谢测定技术成像、神经纤维示踪技术如弥散张量和磁化转移成像,目前已经广泛应用于临床神经功能的评估中[17-18]。目前研究认为[19]脑卒中伴运动功能障碍患者运动皮层神经活动异常,运动皮层功能障碍,通过刺激患者脑M1 区来调节运动皮层神经活动、促进运动皮层功能重组,进而改善患者的运动功能障碍。而fMRI 可分析局部脑区活动,可反映出脑内神经元自发活动强度[20]。本研究对脑卒中伴运动功能障碍患者行rTMS 与常规治疗,并利用任务态fMRI 对治疗机制进行分析,结果显示,rTMS 促进脑卒中伴运动功能障碍患者运动功能恢复机制与皮层兴奋性、局部神经活动有关,经任务态fMRI 分析了患者治疗后的大脑运动皮层重组表现,发现患者局部脑运动区神经活动改善,进一步分析高频、低频的具体机制发现,高频rTMS可通过提高受损半球皮层兴奋性、局部神经活动来促进脑卒中伴运动功能障碍患者运动功能的恢复,而低频rTMS 可通过降低受损半球皮层兴奋性、局部神经活动来促进脑卒中伴运动功能障碍患者运动功能的恢复。本研究样本量较小,因此本研究的结论还需后续实验来进一步证实,通过设置rTMS 的有效参数以获得最佳的治疗效果。
综上所述,基于任务态fMRI 检测发现,rTMS促进脑卒中伴运动功能障碍患者运动功能恢复的机制可能与改善患者大脑皮层兴奋性、局部神经活动有关。
