丁苯酞注射液联合双重抗血小板对急性进展性脑梗死的疗效及其机制探讨*
2021-05-21叶佳媚林青彭飞飞
叶佳媚,林青,彭飞飞
(台州市第一人民医院 神经内科,浙江 台州318020)
缺血性脑血管疾病是危害人类健康的常见疾病之一,约2/3 的脑血管疾病患者会遗留不同程度的功能障碍,严重影响患者的生活质量及身心健康[1]。急性进展性脑梗死(acute progressive cerebral infarction, APCI)是临床常见缺血性脑血管疾病之一,约占脑梗死总患者的30%,具有发病急骤、病情严重、进展迅速等特点,发病6 h 左右即可呈现进行性加重,致残率及致死率均较高[2]。早期静脉溶栓是治疗APCI 最有效的方法,但大部分患者在就诊时已错过最佳溶栓治疗时间窗,已出现严重脑组织坏死及神经元损伤,而单纯抗凝、抗血小板治疗虽然可在一定程度上控制梗死灶面积的扩大,但存在较大的个体疗效差异[3]。因此,如何延缓APCI 病情进展、抑制脑细胞凋亡、改善临床预后成为当前临床研究的热点。丁苯酞氯化钠注射液是人工合成消旋正丁基苯酞制成的抗脑组织缺血的药物,具有较强的抗脑缺血、减轻脑水肿、抑制神经细胞凋亡、抗血小板聚集及抗脑血栓形成等作用,近年来主要用于急性缺血性脑卒中的治疗[4-5]。但对于病情具有进行性加重特性的APCI 患者,使用丁苯酞氯化钠注射液是否具有明显获益,尤其是对认知功能、神经功能的保护作用并不明确。
同型半胱氨酸(homocysteine,Hcy)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)均属于炎症细胞趋化因子,已被证实与动脉粥样硬化及缺血性脑血管疾病的发生、发展有关;血管内皮细胞钙黏蛋白(vascular endothelial cadherin,VE-cadherin)是维持血管内皮细胞极性及完整性的关键黏附蛋白,在维持血管内皮细胞功能中具有重要意义[6]。6-酮-前列腺素F1α(6-keto-prostaglandin F1α, 6-keto-PGF1α)过表达可诱导炎症因子聚集,激活氧化应激性因子,加重脑组织炎症损伤;晚期血小板活化因子正血小板α-颗粒膜糖蛋白(CD62P)则可增加血小板的聚集、黏附能力,加速血小板性血栓形成;血栓素B2 (Thromboxane B2, TXB2)过表达则可增加血栓形成能力,诱导脑血管痉挛及狭窄,被证实与脑缺血性损伤有关[7]。目前关于丁苯酞对上述因子影响的研究甚少,其是否能够通过调节上述因子的表达而治疗APCI 尚不明确。本研究对APCI 患者应用丁苯酞氯化钠注射液联合双重抗血小板治疗,从血小板形成、炎症及血管内皮细胞相关因子变化方面评估其治疗价值并探讨其可能机制,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月—2019年10月台州市第一人民医院收治的APCI 患者204 例为研究对象。将患者按随机数字表法分为对照组与观察组,每组102 例。纳入标准:符合中国急性缺血性脑卒中诊治指南2018[8]中急性脑梗死相关诊断标准,经CT 和/或MRI 检查确诊;入院72 h 内任意1 次美国国立卫生研究院卒中量表(NIHSS)评分增加≥2 分视为APCI,且经CT、MRI 除外脑出血、梗死后出血、短暂性脑缺血发作、严重感染、心功能不全等所致病情进展[9];发病至就诊时间24~72 h;年龄40~75 岁;无意识障碍;患者或其亲属知情同意并签署知情同意书。排除标准:病情快速进展并出现意识障碍者;病程7 d 后急性脑梗死复发、短暂性脑缺血发作、心源性脑栓塞患者;症状性出血转化者;入院时血压>180 mmHg/110 mmHg,随机血糖>11.1 mmol/L,颅内动脉超声检查显示斑块狭窄率>60%者;发热或肺部感染者;使用脑血管扩张剂或24 h入量<1 500 ml者;合并急性冠状动脉综合征、自身免疫性疾病、结缔组织疾病、恶性肿瘤及其他脏器系统功能异常者;近期使用抗炎药物、免疫抑制剂者;脑出血或有出血倾向者、凝血功能异常者;既往有精神神经系统病史者;行急诊溶栓治疗或介入治疗者;对本研究用药过敏或过敏性体质者。剔除标准:研究期间出现严重不良事件或并发症者;治疗期间出现症状性出血转化者;主动退出或放弃治疗者。两组患者的性别、年龄、病程、基础疾病等比较,差异无统计学意义(P>0.05),见表1。本研究获得医院伦理委员会审核批准。
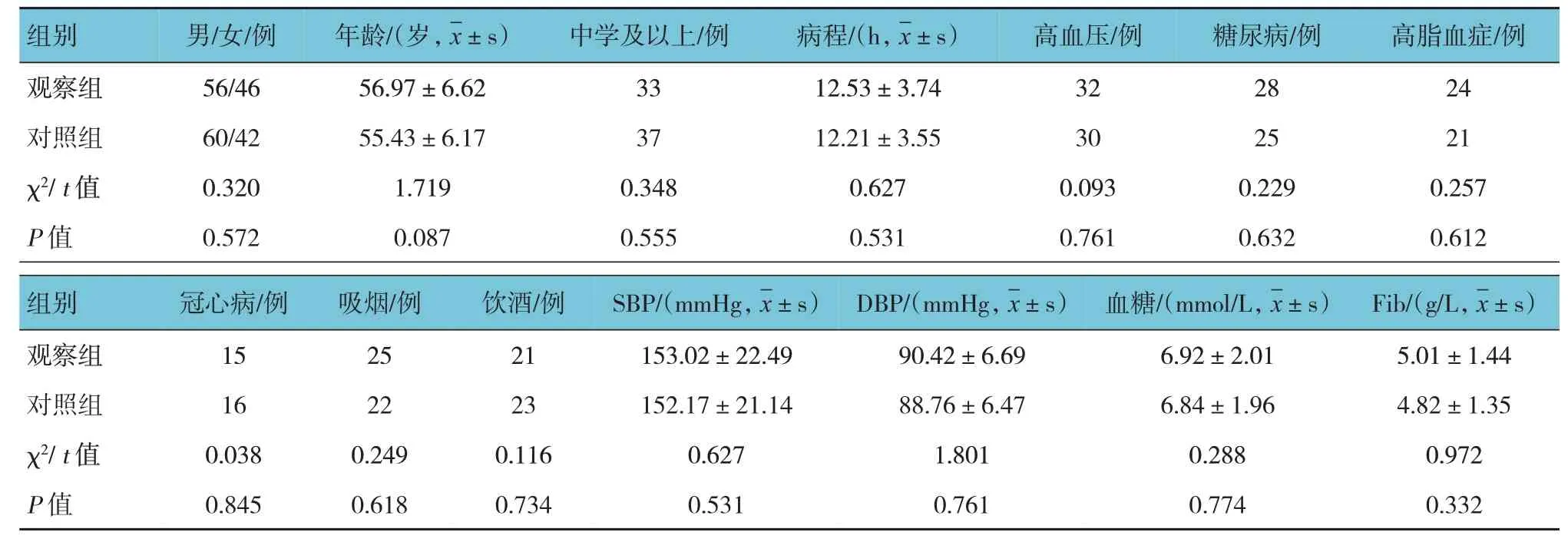
表1 两组患者一般资料比较 (n=102)
1.2 治疗方法
两组患者入院后均参照中国急性缺血性脑卒中诊治指南2018[8]予以规范化基础治疗,包括调节血糖、血脂、血压,维持水电解质平衡及酸碱平衡,缓解脑水肿、营养神经、抗氧自由基等。对照组采用双重抗血小板治疗:阿司匹林口服,100 mg/次,1 次/d;氯吡格雷口服,首剂量300 g,次日起改为75 mg/次,1次/d;阿托伐他汀钙口服,40 mg/次,1 次/d。观察组在对照组基础上,应用丁苯酞氯化钠注射液(石药集团恩必普药业有限公司,国药准字H20100041,规格:丁苯酞25 mg+氯化钠0.9 g/100 ml)静脉滴注50 min 以上,100 ml/次,2 次/d,2 次用药时间间隔不低于6 h。两组疗程均为2 周。
1.3 观察指标
1.3.1 功能状态评估分别于治疗前及治疗后2 周、治疗后30 d 进行神经功能、日常生活活动能力及认知功能状态评价。①采用NIHSS 量表[10]评价神经功能状态,包括15 个项目,总分0~42 分,得分越高则神经功能缺损程度越重。②采用Barthel指数(BI)[11]评价日常生活活动能力,包括10 个项目,总分0~100 分,得分越高则日常生活活动能力越好,依赖性越低。③采用简易智能精神状态检查量表(MMSE)[12]和蒙特利尔认知功能评估量表(MoCA)[13]评价认知功能状态。MMSE 量表包括30 个项目,得分越高则表示认知功能状态越好,MMSE 截断值判定是否存在认知功能障碍,初中及以上≤24 分,小学≤20 分,文盲≤17 分。MoCA 量表包括8 个维度共11 个条目,总分30 分,得分>26 分表示正常,得分越高则认知功能状态越好。
1.3.2 血液指标检测于治疗前及治疗后2 周,分别采集外周静脉血2 管各2 ml。一管采用EDTA-Na(9∶1)抗凝,1 500 r/min 离心10 min 分离血浆,保存于-20℃冰箱中统一测定;采用放射免疫分析法检测血浆6-keto-PGF1α、CD62P、TXB2。另一管采用肝素钠抗凝,3 000 r/min 离心10 min,分离血清保存于-20℃冰箱中统一测定;采用颗粒免疫透射比浊法测定血清Hcy 的水平,采用酶联免疫吸附试验(ELISA)测定血清MCP-1、VE-cadherin 的质量浓度。
1.3.3 安全性评价观察并记录用药期间不良反应发生情况,如出血、恶心、呕吐、头晕、皮疹等。治疗前及治疗后各进行1 次常规体格检查,主要检查血生化、大便常规及心电图等,重点观察有无肝、肾功能异常情况。
1.4 随访及预后评估
治疗后随访90 d,采用改良Rankin 量表(mRS)评价预后,量表分为0~5 分6 个等级,得分≤2 分为预后良好,>2 分为预后不良。
1.5 统计学方法
数据分析采用SPSS 22.0 统计学软件,计数资料以构成比或率(%)表示,比较采用χ2检验;计量资料以均数±标准差(±s)表示,比较采用t检验或重复测量设计的方差分析;P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后NIHSS、BI、MMSE、MoCA评分比较
治疗前,两组的NIHSS、BI、MMSE、MoCA 评分比较,差异无统计学意义(P>0.05)。治疗前、治疗后2 周、治疗后30 d,两组的NIHSS、BI、MMSE、MoCA 评分比较,采用重复测量设计的方差分析,结果:①不同时间点的NIHSS、BI、MMSE、MoCA 评分有差异(F=13.364、22.301、19.254 和18.721,均P=0.000);②两组的NIHSS、BI、MMSE、MoCA 评分有差异(F=23.014、36.192、30.144 和28.926,均P=0.000),治疗后观察组的NIHSS 评分低于对照组,而BI、MMSE、MoCA 评分高于对照组;③两组的NIHSS、BI、MMSE、MoCA 评分变化趋势有差异(F= 16.413、28.794、22.195 和21.034,均P=0.000)。见表2。
表2 两组治疗前后NIHSS、BI、MMSE、MoCA评分比较(n=102,±s)
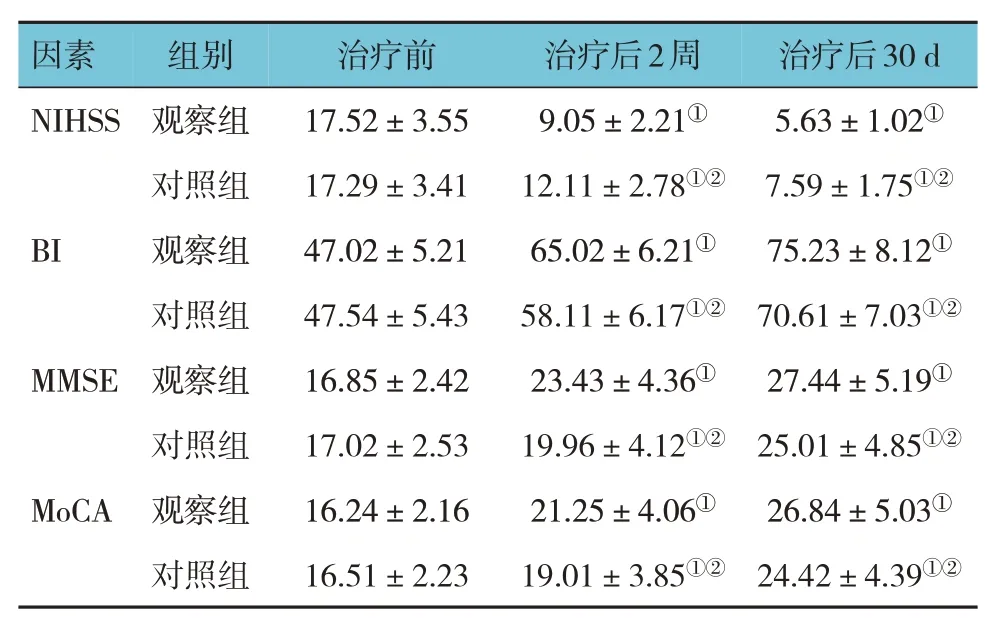
表2 两组治疗前后NIHSS、BI、MMSE、MoCA评分比较(n=102,±s)
注:①与治疗前比较,P <0.05;②与观察组比较,P <0.05。
因素治疗后30 d 组别治疗前治疗后2周NIHSS 5.63±1.02①7.59±1.75①②75.23±8.12①70.61±7.03①②27.44±5.19①25.01±4.85①②26.84±5.03①24.42±4.39①②BI MMSE MoCA观察组对照组观察组对照组观察组对照组观察组对照组17.52±3.55 17.29±3.41 47.02±5.21 47.54±5.43 16.85±2.42 17.02±2.53 16.24±2.16 16.51±2.23 9.05±2.21①12.11±2.78①②65.02±6.21①58.11±6.17①②23.43±4.36①19.96±4.12①②21.25±4.06①19.01±3.85①②
2.2 两组治疗前后血浆6-keto-PGF1α、CD62P、TXB2差值的比较
两组患者治疗前后血浆6-keto-PGF1α、CD62P、TXB2 差值比较,经独立样本t检验,差异有统计学意义(P<0.05),治疗后两组血浆6-keto-PGF1α、CD62P、TXB2 水平均下降,观察组下降的程度大于对照组。见表3。
表3 两组治疗前后血浆6-keto-PGF1α、CD62P、TXB2差值的比较 (n=102,±s)
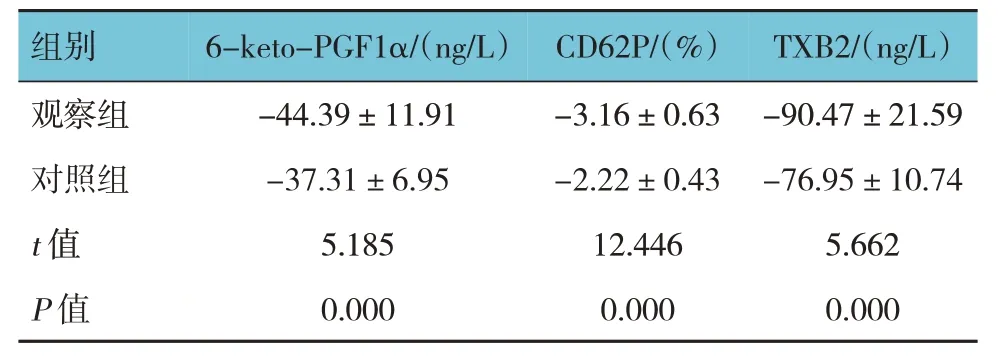
表3 两组治疗前后血浆6-keto-PGF1α、CD62P、TXB2差值的比较 (n=102,±s)
组别6-keto-PGF1α/(ng/L)CD62P/(%)TXB2/(ng/L)观察组对照组t 值P 值-44.39±11.91-37.31±6.95 5.185 0.000-3.16±0.63-2.22±0.43 12.446 0.000-90.47±21.59-76.95±10.74 5.662 0.000
2.3 两组治疗前后血清Hcy、MCP-1、VE-cad‐herin差值的比较
两组患者治疗前后血清Hcy、MCP-1、VEcadherin 差值比较,经独立样本t检验,差异有统计学意义(P<0.05),治疗后两组血清Hcy、MCP-1、VE-cadherin 均下降,观察组下降的程度大于对照组。见表4。
表4 两组治疗前后血清Hcy、MCP-1、VE-cadherin差值的比较 (n=102,±s)
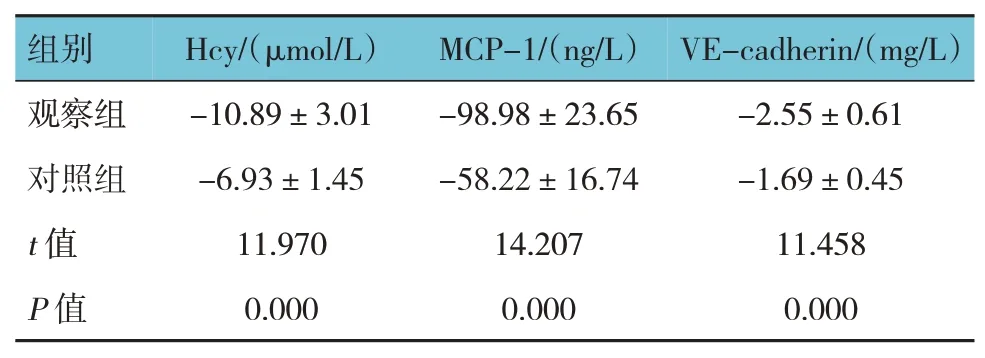
表4 两组治疗前后血清Hcy、MCP-1、VE-cadherin差值的比较 (n=102,±s)
组别Hcy/(μmol/L)MCP-1/(ng/L)VE-cadherin/(mg/L)观察组对照组t 值P 值-10.89±3.01-6.93±1.45 11.970 0.000-98.98±23.65-58.22±16.74 14.207 0.000-2.55±0.61-1.69±0.45 11.458 0.000
2.4 两组不良反应比较
用药期间,两组患者均未发生严重不良反应,无肝肾功能损伤。观察组1 例轻度牙龈出血,2 例恶心,1 例头晕,不良反应率为3.92%;对照组1 例轻度牙龈出血,1 例头晕,不良反应率为1.96%。两组不良反应发生率比较,差异无统计学意义(χ2=0.161,P=0.688)。
2.5 两组临床预后比较
观察组98 例、对照组96 例完成90 d 随访,共失访10 例,失访率为4.90%。观察组预后良好(mRS ≤2 分)77 例(78.57%),预后不良(mRS >2 分)21 例(21.43%);对照组预后良好(mRS ≤2 分)61 例(63.54%),预后不良(mRS >2 分)35 例(36.46%)。两组预后良好率比较,差异有统计学意义(χ2=4.785,P=0.029),观察组高于对照组。
3 讨论
APCI 是最复杂也是最具破坏性的神经系统疾病之一,动脉粥样硬化斑块不稳定、脑缺血后多细胞因子激活、炎症介质大量释放、氧自由基损伤等在APCI 的发生、发展中具有促进作用[14]。目前,关于APCI 的治疗首选时间窗内溶栓治疗,但国内治疗率较低,且溶栓治疗也存在较高的出血性转化风险[15]。双重抗血小板治疗主要是联用阿司匹林和氯吡格雷进行抗血小板治疗,能够较好地抑制血小板聚集,恢复脑组织血流灌注,有利于神经功能的修复。但在脑组织血流灌注恢复过程中,容易出现缺血再灌注损伤,甚至导致神经细胞损伤加重[16]。该过程涉及机制复杂,包括自由基损伤、炎症反应、兴奋性氨基酸毒性、细胞内钙超载、能量代谢障碍、细胞凋亡等[17]。因此,在注重缺血再灌注恢复的同时,如何抑制脑细胞凋亡,挽救缺血半暗带濒死神经元是改善APCI 预后的关键。丁苯酞是由我国自主研发的一种脑保护制剂,化学结构与左旋芹菜甲素相同,主要活性成分为dl-3-正丁基苯酚。已有研究证实[18-19],丁苯酞具有神经保护作用,对缺氧、缺血所致神经细胞损伤具有保护效应,可抑制神经细胞凋亡,并可改善脑缺血后神经功能障碍及认知功能障碍。但其具体作用机制尚不完全明确,目前主要认为与其抑制血小板聚集和血栓形成作用有关。丁苯酞可直接或间接保护低氧、缺血低灌注区脑细胞的线粒体结构及功能,从而改善脑组织能量代谢[20]。此外,丁苯酞还具有抑制细胞内钙超载、抑制兴奋性氨基酸释放、抗氧化及保护血脑屏障等作用,有利于减轻脑水肿,缓解或改善神经功能损伤[17]。
本研究中,观察组在对照组基础上应用丁苯酞进行治疗,结果显示,观察组治疗后2 周、治疗后30 d 时NIHSS 评分均低于对照组,BI 评分均高于对照组。90 d 随访显示,观察组的预后良好率达78.57%,高于对照组的63.54%,提示丁苯酞能够提高治疗效果,更好地改善APCI 患者的神经功能缺损,促进日常生活活动能力的康复并改善临床预后。认知功能损伤是缺血性脑血管疾病尤其是APCI 后的常见问题,突出表现为记忆力、语言功能下降。文献报道脑卒中后6 个月内患者的认知功能损害率高达44%~74%,是远期认知功能损害或痴呆的高危因素[21]。本研究采用MMSE 和MoCA 评分评价患者的认知功能状态,结果显示,两组治疗前MMSE、MoCA 评分均低于临界值,治疗后2周、治疗后30 d 时逐步回升,积极治疗有利于促进认知功能的恢复。治疗后观察组的MMSE、MoCA评分高于对照组,提示丁苯酞可能改善APCI 患者认知功能状态,在一定程度上逆转APCI 后认知功能损害。但随着随访时间的延长,两组患者的MMSE 评分差异是否会继续扩大或缩小仍需进一步深入研究。安全性方面,两组均未见过敏反应、心肝肾功能损害,仅小部分患者出现轻微牙龈出血、恶心、头晕反应,均可耐受且未影响疗程,观察组与对照组的不良反应发生率比较差异无统计学意义,提示加用丁苯酞不会导致副反应明显升高,用药安全性较好。
丁苯酞治疗APCI 对神经功能、认知功能的保护机制极为复杂,既往多认为与减轻脑水肿及血-脑脊液屏障受损、改善脑灌注、抗细胞凋亡、减少氧化应激反应及抑制炎症反应有关[22]。临床研究显示[23],炎症介质或相关因子刺激在APCI 的发生及其后续病理生理改变过程中具有关键性作用,抑制炎症损伤可能是APCI 治疗的重要措施。6-keto-PGF1α是一种前列腺素酶家族相关因子,具有诱导炎症因子聚集、加重氧化应激性损伤等作用,其高表达可加重神经元鞘膜损伤,介导神经纤维电生理异常,影响脑神经功能的恢复[24]。CD62P 可增加血小板的富集能力及黏附能力,其高表达促进血小板性微血栓的形成[25]。TXB2 是一种血栓烷素相关因子,其过表达可激活纤维蛋白原并促进其交联,进而加速血栓的形成,进一步加重脑血管粥样硬化性病变,加速脑血管狭窄、痉挛[26]。临床研究显示[27],在脑组织低氧、缺血状态下,6-keto-PGF1α和TXB2 高表达是诱导血小板聚集及血栓形成的始动因素之一。杨旭等[28]研究证实,ACI 患者血浆中6-keto-PGF1α、CD62P 及TXB2 高表达,且与梗死灶大小、病情严重程度、临床预后密切相关,抑制上述因子表达可能有助于疾病的控制。本研究中,两组治疗后血浆6-keto-PGF1α、CD62P 及TXB2均降低,证实6-keto-PGF1α、CD62P 及TXB2 过表达参与了APCI 的发生发展,随着病情控制可逐步下降。而观察组治疗后血浆6-keto-PGF1α、CD62P 及TXB2 下降的程度均大于对照组,提示丁苯酞的应用能更好地抑制或阻断血小板聚集及血栓形成,缓解脑血管粥样硬化性病变进程。
炎症刺激可损伤血管内皮细胞,导致脂质沉积及单核细胞趋化、聚集,通过吞噬脂质而形成泡沫细胞,加速动脉粥样硬化进程[29]。血管内皮损伤是动脉粥样硬化最早期改变,而MCP-1 可刺激单核巨噬细胞聚集于受损血管内皮局部,并促进其渗透和转化成为巨噬细胞,后者可吞噬脂质而形成泡沫细胞,加速脑组织损伤[30]。同时,MCP-1过表达可刺激T 淋巴细胞、单核细胞及巨噬细胞的趋化聚集,参与粥样硬化斑块的形成并影响斑块的稳定性[31]。Hcy 也被证实在动脉粥样硬化性病变的发生、发展中具有重要作用,其高表达可促进氧化应激反应及血管平滑肌细胞增殖,还可刺激泡沫细胞的生成,与APCI 及其继发性病理生理变化有关[32]。VE-cadherin 是维持血管内皮细胞结构及功能完整性的重要因子,其过表达可能导致内皮屏障功能受损,血管通透性增加,则更容易遭受炎症细胞侵袭[33]。周晓艳等[34]研究显示,急性脑梗死患者血清中Hcy、MCP-1 和VE-cadherin 高表达,且在APCI 患者血清中表达更高。刘秀兰等[35]研究提示,丁苯酞可抑制炎症因子表达及炎症损伤,促进APCI 患者神经功能的恢复并保护其认知功能。本研究中,两组患者治疗后血清Hcy、MCP-1 和VE-cadherin 均明显下降,而观察组的下降程度大于对照组,提示APCI 患者具有Hcy、MCP-1 和VE-cadherin 过表达,使用丁苯酞联合双重抗血小板治疗可能通过下调Hcy、MCP-1 和VEcadherin 表达而发挥其保护效应。
综上所述,6-keto-PGF1α、CD62P、TXB2、Hcy、MCP-1 和VE-cadherin 在APCI 中高表达,并参与动脉粥样硬化斑块形成及血管内皮损伤进程,使用丁苯酞联合双重抗血小板治疗可能通过抑制上述因子表达而发挥作用,有利于改善APCI 患者的神经功能,逆转或延缓认知功能损伤,改善近期预后。但本研究样本有限,且缺乏体外模型研究论证,丁苯酞对APCI 患者神经功能及认知功能的保护机制还有待进一步深入研究。
