基于转录组学探讨益肾降浊汤对环孢素A肾毒性的作用及机制※
2021-05-21郑登勇阮杏林王建挺丘余良阮诗玮
●郑登勇 阮杏林 王建挺 丘余良 阮诗玮▲
环孢素A(cyclosporine A,CsA)目前广泛用于治疗实体器官移植及自身免疫性疾病,显著延长了移植器官的存活时间和患者的生命,但CsA的急慢性肾毒性制约其临床应用[1]。急性肾毒性与CsA损伤血管内皮细胞,导致肾血管收缩,肾脏血流灌注不足,肾小球滤过率下降有关;慢性肾毒性与CsA上调转化生长因子-β(TGF-β),引起肾小管上皮细胞转分化、肾间质纤维化有关[2]。目前尚无肯定的可应用于临床的减轻CsA肾毒性的药物[3]。
中医认为,环孢素A 肾损伤系药毒伤肾,导致脾肾亏虚为本,湿浊血瘀为标[1,4]。益肾降浊汤系福建省名中医阮诗玮教授治疗慢性肾功能衰竭的经验方,临床已使用30 余年,疗效良好。益肾降浊汤“益肾健脾、降浊化瘀”之功效契合环孢素A肾损伤的病机,故课题检测益肾降浊汤对环孢素A诱导HK-2细胞损伤细胞活力的影响。鉴于中药复方成分复杂以及作用的多靶点,机制研究采用转录组测序(transcriptome sequencing,RNA-seq)技术分析益肾降浊汤治疗CsA 诱导HK-2 细胞损伤的差异表达基因,探讨益肾降浊汤减轻CsA肾毒性的可能靶点。
1 实验材料
1.1 实验细胞HK-2 细胞株(购自中国科学院细胞库)。
1.2 益肾降浊汤益肾降浊汤由太子参15 g、生黄芪30 g、生白术15 g、茯苓15 g、槲寄生15 g、怀牛膝15 g、桑椹15 g、丹参30 g、当归10 g、大黄9 g、六月雪15 g、车前子15 g、陈皮10 g 组成,所有中药饮片购自福建中医药大学附属人民医院中药房。浓煎为1.0 g/mL。YSJZT 用0.22 μm 无菌滤器过滤,分装放置-80 ℃冰箱保存备用。
1.3 主要试剂及仪器环孢素软胶囊(新山地明,批准文号J20140116,诺华制药)。Cell Count Kit-8(CCK-8)试剂(Cat:M4839-500Tests,Abmole BioScience)。胎牛血清(gibco 10099-141C);DME/F12 Medium(hyclone SH30023.01B);青霉素-链霉素(双抗)(100X)(hyclone SV30010);TRYPSIN 0.25%(1X)Solution(hyclone SH30042.01);TRIzol(上海生工B511311)。荧光相差倒置显微镜(NIKON ® ECLIPSE Ts2R-FL);二氧化碳培养箱(SANYO MCO-15AC)。
2 实验方法
2.1 细胞培养HK-2细胞株在DME/F12培养基(含10%胎牛血清及1%双抗)中培养,于37 ℃、5%CO2培养箱中培养。
2.2 益肾降浊汤对HK-2细胞活力的影响取对数生长期的HK-2细胞,按5×103个细胞/孔接种于96 孔板中(100 μl/孔),每组5 个复孔,放入培养箱内培养24 h 后更换培养液。给予各浓度益肾降浊汤的培养液(0.125 mg/mL、0.25 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL、4 mg/mL),同时设置正常对照和空白对照组(仅有培养基无细胞),置于培养箱内孵育48 h。各组干预完成后,每孔分别加入10 μlCCK-8试剂,孵育2 h后酶标仪检测450 nm处光密度值(OD值)。根据所测OD 值计算细胞活力(%)=(YSJZT 组-空白对照组)/(正常对照组-空白对照组)×100%。
2.3 CsA 对HK-2 细胞活力的影响取对数生长期的HK-2 细胞,按5×103个细胞/孔接种于96 孔板中(100 μl/孔),每组5 个复孔,放入培养箱内培养24 h后更换培养液。用环孢素A 软胶囊CsA 原液直接稀释在培养基,给予各浓度的CsA 培养液(4.2 μmol/L、8.4 μmol/L、12.6 μmol/L、16.8 μmol/L、21 μmol/L、42 μmol/L),同时设置正常对照和空白对照组(仅有培养基无细胞),置于培养箱内孵育24 h后更换为正常培养液继续孵育24 h。各组干预完成后,每孔分别加入10 μlCCK-8 试剂,孵育2 h 后酶标仪检测450 nm 处OD值。根据所测OD值计算细胞活力(%)=(CsA组-空白对照组)/(正常对照组-空白对照组)×100%。
2.4 益肾降浊汤对环孢素A诱导HK-2细胞损伤细胞活力的影响取对数生长期的HK-2细胞,按5×103个细胞/孔接种于96 孔板中(100 μl/孔),每组5 个复孔,放入培养箱内培养24 h 后更换培养液。根据CCK-8检测各浓度YSJZT和CsA影响HK-2细胞活力的结果,选择合理的CsA 浓度诱导HK-2 细胞损伤模型,孵育24 h后更换为正常培养液继续孵育24 h。并选择合理的YSJZT浓度干预CsA诱导HK-2细胞损伤模型48 h。同时设置正常对照和空白对照组(仅有培养基无细胞)。各组干预完成后,每孔分别加入10 μl CCK-8试剂,孵育2 h后酶标仪检测450 nm处OD值。根据所测OD值计算细胞活力(%)=(CsA组或者YSJZT组-空白对照组)/(正常对照组-空白对照组)×100%。
2.5 细胞形态学改变选择对数生长期的HK-2 细胞按105个/孔种入6孔板(2 mL/孔)。分3组:正常对照组(NC 组)、模型组(C 组,CsA 16.8 μmol/L)和治疗组(T组,YSJZT 0.5 mg/mL+CsA 16.8 μmol/L),药物浓度根据“2.3”和“2.4”CCK8 检测结果选择,干预措施同“2.4”。各组干预完成后,相差显微镜下(200×)观察各组细胞形态改变。
2.6 转录组测序选择对数生长期的HK-2 细胞按105个/孔种入6 孔板(2 mL/孔)。分为NC 组、C 组(CsA 16.8 μmol/L)和T 组(YSJZT 0.5 mg/mL+CsA 16.8 μmol/L),YSJZT对CsA诱导HK-2细胞损伤模型干预措施同“2.4”。各组干预完成后,采用Trizol 法提取HK-2 细胞总RNA,Agilent 2100 进行RNA 定量及质检。构建单链环状DNA 文库,文库质检合格后通过DNBSEQ 测序平台进行测序。由深圳华大基因股份有限公司完成。
2.7 差异表达基因筛选及交集DEG 功能富集分析采用DESeq进行比对组间显著差异基因分析,筛选比对组间差异表达基因,显著差异表达基因筛选条件为:|log2(fold change)|≥1;且Qvalue<0.05。利用基因本体(Gene Ontology,GO)数据库和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库,对交集的DEG进行GO功能与信号通路富集分析,以校正P<0.05为显著性阈值。
2.8 统计学方法采用Graphpad prism 8.0软件进行分析,实验数据中的计量资料以均数±标准差(±s)表示,多组间比较采用One-Way ANOVA 分析,P<0.05表示差异有统计学意义。
3 结果
3.1 益肾降浊汤对HK-2细胞活力的影响各浓度YSJZT 处理48 h 后,0.125 mg/mL、0.25 mg/mL、0.5 mg/mL 对HK-2 细胞活力无明显抑制,各组细胞活力分别为(103.20±1.98)%、(99.15±2.19)%、(97.42±3.58)%;1 mg/mL、2 mg/mL、4 mg/mL对HK-2细胞活力有统计学意义的抑制作用,各组细胞活力分别为(91.07±4.59)%、(89.45±1.70)%、(92.49±1.99)%。结果见图1a。所以后续实验选择YSJZT 0.125 mg/mL、0.25 mg/mL、0.5 mg/mL 三个浓度。
3.2 CsA 对HK-2 细胞活力的影响经过各浓度CsA处理24 h后,撤掉CsA继续培养24 h,4.2 μmol/L、8.4 μmol/L 对HK-2 细胞活力无抑制,各组细胞活力分别为(96.96±4.52)%、(88.36±6.24)%;12.6 μmol/L、16.8 μmol/L、21 μmol/L、42 μmol/L 对HK-2 细胞活力均有统计学意义的抑制,各组细胞活力分别为(84.18±7.36)%、(81.34±9.47)%、(28.68±13.97)%、(0.33±0.21)%。结果见图1b。所以后续实验选择CsA 16.8 μmol/L诱导HK-2细胞损伤模型。
3.3 益肾降浊汤对CsA诱导HK-2细胞损伤细胞活力的影响与NC 组比较,CsA 16.8 μmol/L 模型组HK-2 细胞活力显著降低,其细胞活力为(76.48±3.16)%;与模型组比较,YSJZT 0.125 mg/mL、0.25 mg/mL、0.5 mg/mL治疗后HK-2细胞活力明显提升,各组的细胞活力分别为(86.59±10.10)%、(87.64±5.91)%、(89.70±5.15)%。结果见图1c。根据不同浓度YSJZT对CsA 诱导HK-2 损伤细胞活力的恢复情况,故课题后续实验选择YSJZT 0.5 mg/mL对模型进行干预。
3.4 益肾降浊汤对CsA诱导HK-2细胞损伤形态的影响NC 组细胞形态正常;C 组为CsA 诱导HK-2 细胞损伤模型组,相差显微镜下HK-2 细胞内发现大量大小不等的空泡及部分钙化点;T 组为益肾降浊汤治疗组,HK-2细胞内空泡及钙化改善不明显。见图2。

图1 益肾降浊汤对CsA诱导HK-2细胞损伤细胞活力的影响
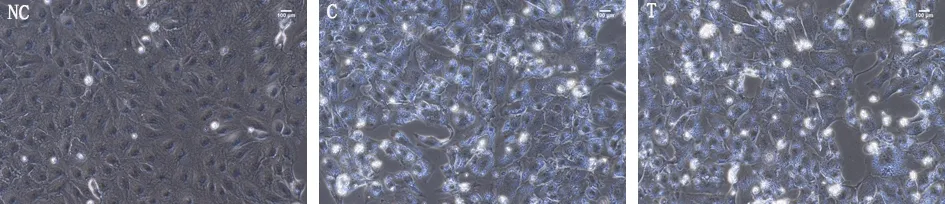
图2 相差显微镜下观察益肾降浊汤对环孢素A诱导HK-2细胞损伤形态的影响(200×)
3.5 各比对组间差异表达基因情况RNA-seq测序结果发现,C 组与NC 组比对得到显著差异表达基因1410个(其中上调基因812个、下调基因598个),见图3a 和图3b。T 组与C 组比对得到显著差异表达基因127 个(其中上调基因71 个、下调基因56 个),见图4a和图4b。为明确YSJZT 减轻CsA 肾毒性的主要靶基因,将T 组比对C 组上调DEG 交集C 组比对NC 组下调DEG,得到36 个DEG;将T 组比对C 组下调DEG 交集C 组比对NC 组上调DEG,得到30 个DEG,见图5a和图5b。
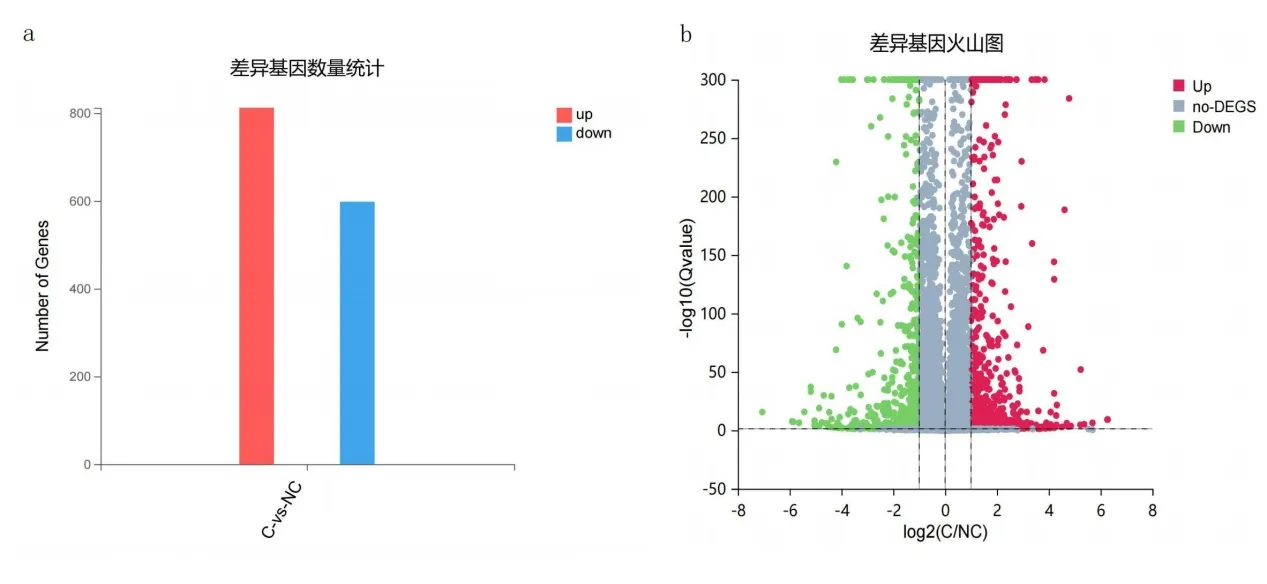
图3 模型组比对正常对照组差异表达基因柱状图及火山图
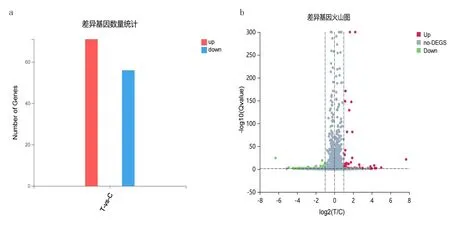
图4 益肾降浊汤治疗组比对模型组差异表达基因柱状图及火山图
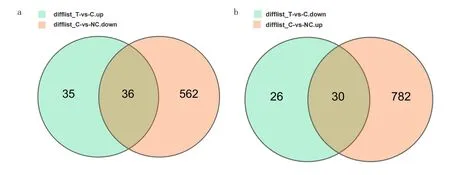
图5 不同比对组间交集基因韦恩图
3.6 差异表达基因GO 功能富集分析交集得到的66 个DEG 进行GO 功能富集分析,从细胞组分(cellular component)、生物过程(biological process)和分子功能(Molecular Function)三大功能类别中各选取富集最显著的10个GO term绘制柱状图。通过GO功能富集分析可看出益肾降浊汤治疗后显著回调的差异基因功能主要集中在生物学过程中的雌激素代谢过程(estrogen metabolic process)、表皮生长因子受体信号通路(epidermal growth factor receptor signaling pathway,EGFR)、视黄醇代谢过程(retinol metabolic process);分子功能中的雌激素酮磺基转移酶活性(estrone sulfotransferase activity)、粒细胞巨噬细胞集落刺激因子受体绑定(granulocyte macrophage colonystimulating factor receptor binding);细胞组分中的主要变化在细胞外间隙(extracellular space)、质膜的组成部分(integral component of plasma membrane)。见图6。
结果发现,集落刺激因子2(Colony-Stimulating Factor 2,Csf 2)注释到分子功能的粒细胞巨噬细胞集落刺激因子受体绑定中;磺基转移酶1E 家族成员1(sulfotransferase family 1E member 1,Sult1E1)注释到分子功能的雌激素酮磺基转移酶活性及生物学过程的雌激素代谢过程中;上皮调节蛋白(epiregulin,EREG)注释到生物学过程的EGFR信号通路中。

图6 交集差异表达基因的GO富集分析三大功能类别柱状图
3.7 差异表达基因KEGG 通路富集分析差异表达基因KEGG通路富集分析以P<0.05为显著性阈值,对交集基因进行KEGG富集分析,以最显著变化的11个通路绘制气泡图,其中涉及的信号通路包括:甾类激素生物合成(Steroid hormone biosynthesis)、细胞色素P450 代谢的生物异源物质(Metabolism of xenobiotics by cytochrome P450)、药物代谢-细胞色素P450(Drug metabolism-cytochrome P450)、视黄醇的代谢(Retinol metabolism)、ErbB 信号通路(ErbB signaling pathway)、FcεRI 信号通路(Fc epsilon RI signaling pathway)T 细胞受体信号通路(T cell receptor signaling pathway)等。见图7。

图7 交集差异表达基因KEGG通路富集分析气泡图
结果发现,Csf 2注释到Fc epsilon RI 信号通路、T细胞受体信号通路;Sult1E1 注释到甾类激素生物合成通路;EREG注释到ErbB信号通路。
4 讨论
环孢素A 肾损伤属于中医学“关格”“腰痛”等范畴[1]。环孢素A 肾损伤系药毒伤肾,导致“脾肾亏虚”尤其是“肾精亏虚”;脾肾失运,导致湿浊内停;毒损肾络,瘀血内阻。脾肾亏虚、湿浊血瘀是CsA 肾损伤的根本病机[1,4]。益肾降浊汤主要用于慢性肾功能衰竭“脾肾气虚,湿浊血瘀”证。方中太子参、生黄芪、生白术、茯苓健脾益气、利水渗湿;槲寄生、怀牛膝、桑椹益肾;丹参、当归、怀牛膝活血化瘀;大黄、六月雪、车前子通腑降浊解毒;陈皮健脾理气、助运降逆。诸药共奏益肾健脾,降浊化瘀之功效。在前期的基础研究中,益肾降浊汤[5]及其院内制剂益肾降浊冲剂治疗5/6肾切除慢性肾功能衰竭大鼠,均能改善大鼠肾功能和抑制肾小管间质纤维化[6,7]。益肾降浊汤之功效契合CsA肾损伤的病机。
故课题检测益肾降浊汤对环孢素A诱导HK-2细胞损伤细胞活力的影响。如图1c所示,发现益肾降浊汤可回调环孢素A 引起的HK-2 细胞活性下降,因此益肾降浊汤是减轻环孢素肾毒性的有效药物。但YSJZT 对环孢素A 诱导HK-2 细胞损伤细胞内空泡改善不明显,可能与环孢素A撤药后YSJZT继续干预时间仍偏短有关。
RNA-seq测序结果发现模型组与NC组比对得到显著差异表达基因1410 个(其中上调基因812 个、下调基因598个);YSJZT治疗组与模型组比对得到显著差异表达基因127 个(其中上调基因71 个、下调基因56 个)。为明确YSJZT 减轻CsA 肾毒性的主要靶基因,将T 组比对C 组上调DEG 交集C 组比对NC 组下调DEG,得到36 个DEG;将T 组比对C 组下调DEG 交集C 组比对NC 组上调DEG,得到30 个DEG。对交集的66 个基因进行GO 富集分析,可看出YSJZT 治疗后显著回调的差异基因功能主要集中在生物学过程中的雌激素代谢过程、表皮生长因子受体信号通路、视黄醇代谢过程,分子功能中的雌激素酮磺基转移酶活性、粒细胞巨噬细胞集落刺激因子受体绑定。KEGG通路富集分析发现,涉及信号通路有甾类激素生物合成、ErbB 信号通路、FcεRIFc 信号通路、T 细胞受体信号通路等。提示益肾降浊汤减轻环孢素A 肾小管细胞毒性的作用机制比较广泛。
Csf 2在GO功能分类分子功能中的粒细胞巨噬细胞集落刺激因子受体绑定和KEGG pathway 富集的Fc epsilon RI 信号通路、T 细胞受体信号通路中发挥作用。肾损伤后巨噬细胞在肾内积聚,并经历由促炎(M1)表型向正常修复所需的选择性激活(M2)表型的转变。在人M1 巨噬细胞与HK-2 细胞共培养的培养基中Csf 2增加最多,Csf 2只由HK-2细胞分泌。重组人Csf 2 蛋白促进巨噬细胞由M1 向M2 表型转化。暴露于外源性Csf 2 后,M1 巨噬细胞诱导的HK-2 细胞凋亡和活性氧释放减弱。在盲肠结扎穿孔脓毒症小鼠腹腔注射Csf 2 中和抗体会加重肾损伤,抑制肾小管增殖,进而降低存活率。而重组小鼠Csf 2 蛋白可以挽救脓毒症小鼠[8]。慢性环孢素A肾毒性患儿肾活检组织病理发现间质巨噬细胞浸润[8],同时在慢性CsA肾毒性大鼠也发现肾间质巨噬细胞浸润,与肾间质纤维化密切相关[10]。本研究结果发现,环孢素A 干预HK-2细胞后Csf 2显著下调[log2(C/NC)=-2.043],益肾降浊汤治疗后显著回调[log2(T/C)=1.255],提示益肾降浊汤上调Csf 2 是其减轻环孢素A 肾毒性的可能靶点之一。
Sult1E1 在GO 分类分子功能中的雌激素酮磺基转移酶活性、生物学过程中的雌激素代谢过程和KEGG pathway 富集的甾类激素生物合成通路中发挥作用。研究表明雌激素可以减轻小鼠急性肾损伤(Acute Kidney Injury,AKI),雌激素Sult1E1 通过磺化和失活雌激素在雌激素稳态中发挥重要作用,在小鼠急性肾缺血再灌注损伤模型,Sult1E1 基因敲除或对其药理抑制减轻了雌雄小鼠AKI,与性激素的存在无关。Sult1E1 在AKI 的发病机制中具有新的功能[11]。本研究结果发现,环孢素A干预HK-2细胞后Sult1E1显著上调[log2(C/NC)=3.153],益肾降浊汤治疗后显著回调[log2(T/C)=-1.177],提示益肾降浊汤抑制Sult1E1可能是其减轻环孢素A肾毒性的作用机制之一。
EREG 在GO 分类生物学过程中的EGFR 信号通路和KEGG pathway 富集的ErbB 信号通路中发挥作用。Epiregulin 与表皮生长因子(Epidermal Growth Factor,EGF)在促进肾近端小管上皮细胞(renal proximal tubular cells,RPTC)增殖和迁移方面具有相当的作用。表皮调节蛋白是RPTC的一种有效的有丝分裂原,可能通过激活EGFR 和PI3K/Akt 通路促进肾脏再生[12]。本研究结果发现,环孢素A 干预HK-2 细胞后EREG显著下调[log2(C/NC)=-3.689],益肾降浊汤治疗后显著回调[log2(T/C)=1.653],提示益肾降浊汤上调EREG 可能是其减轻环孢素A 肾毒性的作用机制之一。但在体内过量的EGFR 和ErbB 信号激活是有害的[13],故益肾降浊汤在体内对EREG 的调控需要进一步研究,以全面了解YSJZT对EREG的调控。
综上,益肾降浊汤通过多靶点恢复环孢素A诱导HK-2细胞损伤的细胞活力,其中调控Csf 2、Sult1E1、EREG 多个靶基因及其相关信号通路,可能是益肾降浊汤减轻环孢素A 肾毒性的作用机制。以上分析的可能靶基因仍需要体内外实验进一步验证。
