人乳寡糖的研究进展
2021-05-21李晨晨李梦丽张涛
李晨晨,李梦丽,张涛
(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122)
人乳对婴幼儿来说是天然的滋养剂,对其生长发育具有非常显著的效果,并具有很多牛乳粉所没有的,促进健康成长的益生功能。其成分复杂且丰富,含有许多生物分子,如免疫球蛋白、先天性糖蛋白、生物活性肽、抗体、糖脂、游离脂肪酸、细胞因子和趋化因子等[1]。人乳中主要含有2种碳水化合物:乳糖和人乳寡糖(human milk oligosaccharides,HMOs)。乳糖是人乳的主要营养成分之一,具有很高的营养价值。HMOs是人乳中含量仅次于乳糖和脂类的第三大成分,它是200多种不易消化和非营养性碳水化合物的复杂混合物[2]。在研究人乳和牛乳之间的各种成分差异中发现,一个主要的差异是人乳中存在HMOs,而在牛乳和目前市场上的婴儿配方奶粉中则几乎没有。
20世纪30年代,低聚寡糖被认为是母乳中的双歧因子,于1954年GYÖRGY等[3]就发现并鉴定了母乳中最丰富的低聚寡糖。作为母乳中具有益生功能的成分,它可以调节肠道菌群环境,促进有益菌群的生长,还可以作为抗黏附抗菌剂,阻碍病菌与人体肠道黏膜细胞的结合,调节免疫系统,对促进大脑发育也有重要的作用。由于HMOs的种类繁多、结构复杂且大多数合成困难,目前市场上出现的婴幼儿配方奶粉中添加的大多是低聚半乳糖(galacto oligosaccharides,GOS)和低聚果糖(fructo oligosaccharide,FOS),以此来模拟HMOs的部分功能。目前在HMOs中,2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL)和乳酰-N-新四糖(lactoyl-N-neotetraose,LNnT)被广泛研究,与其他母乳低聚糖相比,这2种母乳低聚糖化学结构相对简单,在母乳中含量较为丰富。欧盟认定这两者作为新型食品,通过科学和技术资料得出2′-FL和LNnT可以1.2 g/L和0.6 g/L的质量浓度单独或组合添加到婴儿配方奶粉中。美国食品药品监督管理局也认证2′-FL和LNnT可作为安全的食品进行添加和使用[4]。由于HMOs的生物学效应,近期婴儿配方奶粉公司,如雀巢、强生等,对引入主要的HMOs至婴儿配方奶粉中产生了极大的兴趣,试图开发尽可能接近母乳的强化配方奶粉。但由于价格及合成水平等的限制,目前还没有形成工业化规模生产。随着科学的进一步发展,更多种类复杂的HMOs合成研究会越来越完善,市场化规模的生产也会逐步走向成熟。
1 人乳寡糖的结构与功能
1.1 HMOs的结构组成
HMOs是由3~14个单糖组成的低聚糖,主要以游离形式存在于母乳中,其基本单体分为以下5种,分别是D-葡萄糖(Glc)、D-半乳糖(Gal)、N-乙酰葡糖胺(N-acetylglucosamine,GlcNAc)、L-岩藻糖(Fuc)和唾液酸[以N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)作为主要形式][5]。这些单糖以不同的方式结合成结构复杂的200多种低聚糖。从结构上来说,通常在寡糖的还原末端存在乳糖结构(Gal-β-1,4-Glc),乳糖通过α-1,2或α-1,3岩藻糖基化和α-2,3或α-2,6唾液酸化的末端能够产生4种低聚寡糖,分别为:2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL),3-岩藻糖基乳糖(3-fucosyllactose,3-FL),3′-唾液酸乳糖(3′-sialyllactose,3′-SL)和6′-唾液酸乳糖(6′-sialyllactose,6′-SL),见图1。同时,在乳糖结构基础上,以β-1,3或β-1,6键连接半乳糖β-1,3-N-乙酰氨基葡萄糖(Gal-β-1,3-GlcNAc,LNB,I型链结构)或者连接N-乙酰氨基乳糖(Gal-β-1,4-GIcNAc,LacNAc,II型链结构)延伸糖链,可以构建形成HMOs的核心结构,它们被分为四核到十核的核心结构[6]。前面4个核心结构分别是乳酰-N-四糖(lacto-N-tetrose,LNT)、乳酰-N-新四糖(lacto-N-neotetraose,LNnT)、乳酰-N-六糖(lacto-N-hexaose,LNH)和乳酰-N-新六糖(lacto-N-neohexaose,LNnH),见表1。这些主链结构可以被修饰,所以在母乳中HMOs大致可以分为3种类型,岩藻糖基化的HMOs、唾液酸化的HMOs和非岩藻糖基化的中性HMOs,其中岩藻糖基化的HMOs和非岩藻糖基化的中性HMOs同属于中性HMOs,而唾液酸化的HMOs则属于酸性HMOs。在这之中,中性HMOs占HMOs总量的75%以上。在母乳中分泌最丰富的HMOs是2′-FL,约占总HMOs的30%,是目前研究最为广泛的低聚寡糖之一。由于HMOs的浓度和组成变化很大,其种类和含量随着个体和时间的变化都会呈现差异之处,不同的女性分泌的寡糖类型不同,同一人在不同哺乳时期含量也有所不同,如在成熟乳中约为12~14 g/L,而初乳中约为20~24 g/L[7]。此外,与足月分娩的妇女相比,早产妇女含岩藻糖基化或唾液酸化的HMOs百分比差异更大。
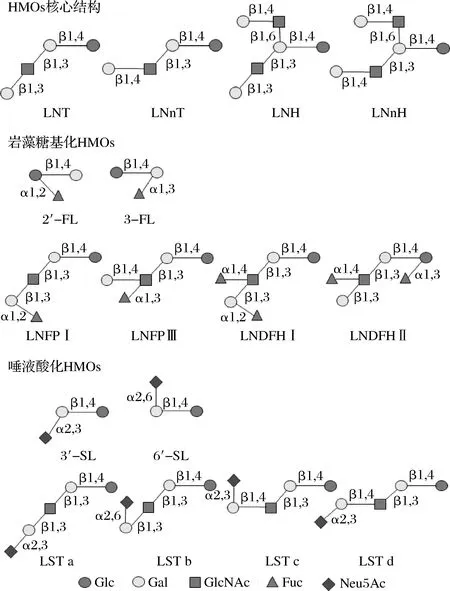
图1 人乳寡糖结构图Fig.1 Structure diagram of human milk oligosaccharides
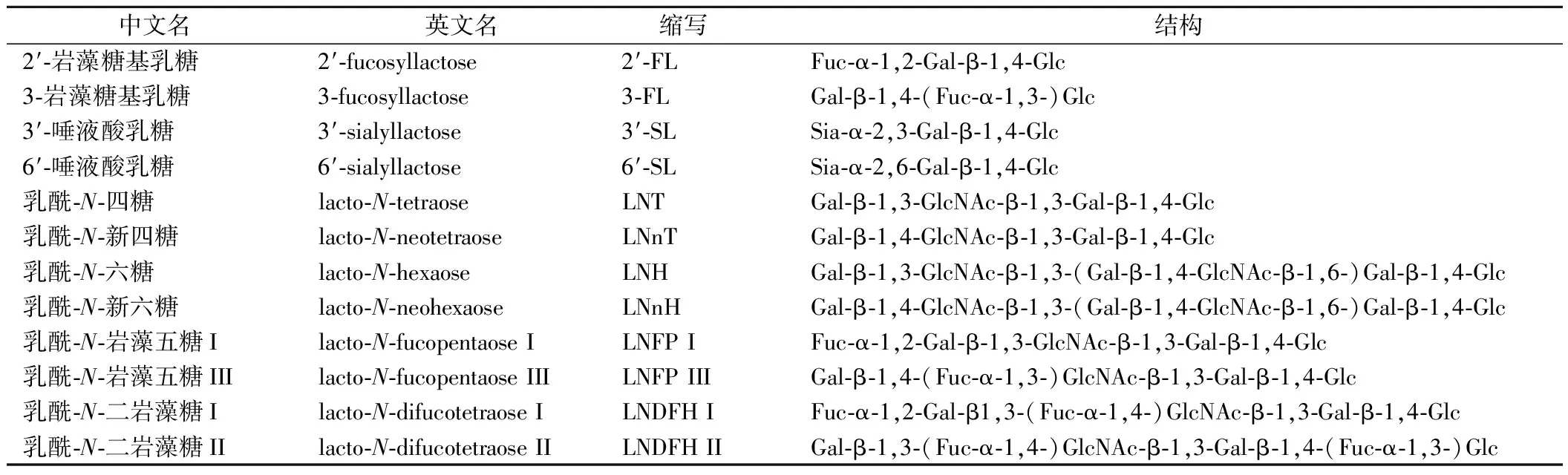
表1 人乳寡糖的核心结构[8-9]Table 1 Core structure of human milk oligosaccharides
1.2 HMOs的功能
HMOs在婴幼儿生长发育的过程中起到不可替代的重要作用,它可以影响肠道微生物群的内在组成,为有益的肠道细菌提供能量来源。研究表明,HMOs进入人体后并不被消化吸收,而是直接到达大肠,通过刺激肠道内的有益菌群(双歧杆菌和乳杆菌)的增殖生长,有效抑制肠道有害菌群的繁衍,改善肠道微环境,维护机体的健康状态[10]。一些体外研究表明,HMOs可促进某些双歧杆菌的生长,婴儿体内的双歧杆菌在添加HMOs的培养基上生长良好,其中2′-FL作为碳水化合物的唯一来源。随着时间的推移,婴儿双歧杆菌消耗所有HMOs,包括其单糖和双糖代谢物[11]。另有研究表明,24个益生菌菌株中,只有来自婴儿的长双歧杆菌亚种ATCC 15697和M-63能够发酵 2′-FL、3-FL、3′-SL 和6′-SL,所以HMOs可作为婴儿双歧杆菌的首选底物[12]。此外,婴儿双歧杆菌能够产生短链脂肪酸,有利于共生的非致病性细菌的生长,由3个月婴儿的细菌多样性报告[13]显示,其体内的有益双歧杆菌数量定殖增加,而病原菌的定殖数量则在减少。
HMOs可以作为黏膜表面病原体的诱饵受体,对宿主的健康状况产生影响,同时也可以通过增强肠道屏障功能改善宿主防御机制。在HMOs中,2′-FL可以抑制空肠弯曲杆菌感染以及与其相关的黏膜炎症的发生。体外研究表明,2′-FL能使空肠弯曲杆菌的侵袭力减弱80%,抑制黏膜促炎信号的释放[14]。对婴儿进行的一项前瞻性研究表明,2′-FL的有益作用包括减少与空肠弯曲杆菌相关腹泻的发作次数,对治疗坏死性小肠结肠炎也有良好的疗效[15]。同时,LNnT可减少动物模型肺中肺炎链球菌的数量,通过调节肠道微生物菌群来预防坏死性小肠结肠炎、念珠菌病和一些免疫相关疾病的发生,从而降低早产儿死亡率和发病率的风险性[16]。
HMOs的一个重要特性是免疫调节,通过直接调节肠细胞的基因表达,使细胞表面聚糖和其他细胞反应的表达发生变化,调节淋巴细胞因子的产生,使TH1/TH2反应更加平衡[17]。对于HMOs来说,它既可以局部作用于黏膜等相关淋巴组织,也可以在全身水平上起作用。尤其是2′-FL,可以通过抑制CD14诱导,直接抑制内毒素介导的肠毒性大肠杆菌侵袭T84和H4肠上皮细胞时的炎症反应,而炎症的抑制作用则激发了HMOs作为天然免疫系统刺激物时所表现出的免疫应答[18]。据报道,通过剖腹产出生且食用添加2′-FL的婴儿配方奶粉的两岁儿童与食用未添加2′-FL的婴儿配方奶粉的儿童相比,发生与免疫球蛋白E相关的过敏反应的风险更低[19]。
HMOs及其代谢产物,如唾液酸,在大脑发育、神经传递和突触形成中起着重要的作用。唾液酸作为大脑最佳发育和认知所必需的营养素,在婴幼儿发育成长过程中的作用不言而喻,HMOs作为唾液酸的来源也显得尤为重要[20]。岩藻糖和2′-FL同时也具有刺激大脑发育的作用,食用2′-FL可以影响啮齿动物的认知领域,改善学习和记忆能力[21]。HMOs中的3′-SL 和6′-SL 也可以通过调节肠—脑轴支持正常的微生物群落和应激期间的行为反应[22]。因此采用母乳喂养的婴儿,其大脑发育更加完善、神经突触更加丰富、神经系统也更加发达。
2 HMOs的分离检测及结构鉴定
2.1 HMOs的分离检测
HMOs的种类繁多,结构复杂,其种类和含量也存在个体差异,不同 Lewis血型乳母体内HMOs 的种类和含量不同,从而增加了HMOs分离的难度。对母乳进行分离,通常需要去除母乳中的脂肪和蛋白质,目前常用的去除脂肪和蛋白质的传统方法[23]有下面几种,一是利用HMOs具有亲水性的特性,通过低温离心去除脂肪,后加入乙醇来沉淀蛋白质;二是可利用分子量大小的不同采用超滤进行分离,HMOs作为小分子亲水性物质可以透过超滤膜,而脂肪和蛋白质是大分子则不能通过;第三种,由于HMOs可溶于乙腈,而脂肪不溶于乙腈,蛋白质则被乙腈沉淀,从而达到分离的目的。经过上述处理后,母乳中的脂肪和蛋白质被去除,剩下的物质主要是乳糖和寡糖,需要把高含量的乳糖去除,达到分离HMOs的目的。尺寸排阻色谱法作为分离HMOs的传统方法,可以根据分离物的分子大小和形状,按照顺序被洗脱出色谱柱而达到分离的目的。但随着分离技术的进步,更高水平的技术层出不穷,固相萃取(solid-phase extraction,SPE)作为样品前处理技术而被广泛应用,具有高通量、易自动化、操作灵活等优点。LEBRILLA 团队针对HMOs设计了一个高通量SPE处理流程[24],该流程同时实现了寡糖还原、脱盐、脱乳糖以及分离中性糖和酸性糖等目标,对样品纯化和粗分离具有良好的效果。
近些年来,HMOs的研究越来越成为热点,其分离检测也吸引了很多科研人员的关注,越来越多的高水平分离技术应运而生。目前常用的分离技术主要有高效阴离子交换色谱(high performance anion exchange chromatography,HPAEC)、亲水作用色谱(hydrophilic inter action chromatography,HILIC)、石墨化碳液相色谱(graphitized carbon liquid chromatography,PGC-LC)、毛细管电泳(capillary electrophoresis,CE)等方法。
HPAEC是根据电荷的不同,在碱性环境下以阴离子形式交换到色谱柱上,与脉冲安培检测器(pulsed ampere detector,PAD)联用,形成HPAEC-PAD,该方法已被广泛应用于HMOs的定性和定量分析,它可以进行寡糖单体的分离分析,尤其是对寡糖异构体有很好的分离效果。THURL等[25]使用 HPAEC方法研究了不同人群和不同哺乳期寡糖含量的变化情况,对中性和酸性HMOs进行了分析。亲水作用色谱作为一种新型的色谱分离技术,克服了正相色谱和反相色谱在极性化合物分离过程中的不足,具有良好的分离选择性和高灵敏度,一般在进行HILIC分析时,首先会对寡糖进行衍生化处理,来改善峰型、分离选择性(尤其是异构体)及检测灵敏度。AUSTIN等[26]利用亲水作用色谱-荧光检测法应用于加标婴儿配方奶粉的检测,效果良好。对于石墨化碳液相色谱,可以对寡糖很好地进行保留以及分离,尤其对寡糖异构体能够很好地区分。而毛细管电泳可与紫外检测器连用于检测衍生化的HMOs,也可与质谱连用,进行唾液酸化HMOs的分离检测。
2.2 HMOs的结构鉴定
糖分子的结构非常复杂,HMOs的结构分析包括单糖组成分析、寡糖序列分析、岩藻糖和唾液酸修饰位点分析。从20世纪80年代开始,有机质谱的发展给糖类化合物的结构分析带来了较大的进展。按分析器种类分,目前常应用于HMOs 结构分析的质谱有飞行时间质谱(time-of-flight mass spectrometry, TOF-MS)和傅里叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance mass spectrometry, FTICR-MS),后者较前者来说,分辨效率相对高但是价格昂贵。基质辅助激光解析(matrix-assisted laser desorption ionization, MALDI)和电喷雾(electrospray ionization, ESI)技术的发明,使HMOs的结构解析取得了突破性的进展。1994年,STAHL等[27]首先采用基质辅助激光解析电离-飞行时间质谱(MALDI-TOF-MS)法检测了中性和酸性HMOs的组成轮廓,此方法快速准确,且灵敏度高、操作方法简便。NINONUEVO[28]和LOCASCIO等[29]采用基质辅助激光解析电离-傅里叶变换离子回旋共振质谱(MALDI-FTICR-MS)快速检测了不同样品中的HMOs的组成数量和响应的相对强度。电喷雾质谱(ESI-MS)的应用扩展了质谱的质量测定范围,其二级碎片结构还可以提供寡糖的连接顺序和连接键构型信息。相对于质谱来说,核磁共振是一种新出现的结构鉴定技术,它的出现给糖类结构解析带来新的发展和进步。在进行鉴定分析时不需要标准品即可进行定性分析,这对于HMOs中未知糖的定性分析具有明显优势,但其对样品的纯度要求相对较高。随着分离解析技术的进步,质谱和核磁共振技术也经常联合用于寡糖的鉴定分析。
3 HMOs的合成
由于自然界天然合成的功能性糖类化合物产量无法满足科学研究和人类生产生活的需求,生产开发功能性糖类化合物已成为科研人员一项挑战性的项目。目前,除了从母乳中直接分离HMOs外,体外合成的方法主要有化学合成法和生物合成法。下面对体外化学合成和生物合成法作进一步介绍。
3.1 化学合成法
1999 年ALY等[30]首次用化学方法,经过34步反应合成了LNT及LNnT,但收率仅为0.6%。随后SHERMAN等[30]以丙烯基乳糖和乳糖作为原料,将硫苷法引入到LNT衍生物的合成中,由于此合成策略反应步骤多,最终收率也不理想,仅为8.6%。固相合成技术把寡糖连接到一个不溶性物质上,如玻璃珠或树脂,实现反应产物和过量反应物快速分离,这一技术被应用于合成已确定结构的寡糖上。近些年来,有人提出利用“一锅酶法”,通过多种酶连续合成寡糖,其基本原理就是通过调控供体和受体的活性,使得两步或者多步糖基化反应连续进行。2012年,HSU等[31]以LNnT为底物,利用此法合成的LNFP III最终得率可达到49.6%。2015年,CHEN等[32]从乳糖苷开始,使用一系列激酶、异构酶、尿苷转移酶和糖基转移酶,通过两步法合成LNnT,得率在81%。2016年,ZHAO等[33]同样利用此法合成LNFP I,得率可达到95%。用“一锅酶法”合成的产物产率较之前虽有所提高,但仍存在反应步数过多的问题,如合成产物LNFP III就需要10步反应才行。而有的产物则无法连续反应,只能分步进行,利用此法产物产率仍然得不到提升。
化学合成法虽然在合成HMOs方面取得了很大的进展,然而大量有机溶剂的使用、严苛的反应条件、冗长的反应级数等因素都使得其生产成本昂贵,有毒试剂的存在也限制了HMOs在食品领域的广泛应用。
3.2 生物合成法
3.2.1 酶法合成
由于化学合成HMOs存在自身局限性,为了克服这些缺点,科研人员的研究热点逐渐转移到生物合成上来,生物合成法具有安全无污染、运用范围广的特点。生物合成HMOs有酶法合成和微生物发酵合成两种途径。酶法合成具有立体和化学选择性,对不同底物具有选择特异性。酶法合成体现在酶的促进催化作用上,通常表现在底物、辅助因子和供体存在下合成的特异性表达。
用于合成HMOs的特定酶是糖苷酶和糖基转移酶。它们可以通过选择性沉淀、反复纯化或重组技术从哺乳动物、昆虫或微生物这些宿主中获得。糖苷酶除了可以定量形成糖苷键外,对糖基供体底物和糖基化寡糖还具有水解作用,它的活性高,且更容易获得。但酶体系的稳定较差,生成的产物和底物由于水解作用而难以分离,阻碍了糖苷酶在工业上的应用。
糖基转移酶具有完全的立体控制和区域控制,底物特异性好,几乎可以定量形成糖苷键,通过将糖基从活化的供体底物转移到受体底物上来催化二糖、寡糖或多糖的合成。来自幽门螺旋杆菌(Helicobacterpylori)的岩藻糖基转移酶使用核苷酸糖鸟嘌呤5′-二磷酸-β-L-岩藻糖(5′-diphospho-β-L-fucose,GDP-L-岩藻糖)作为供体,但是对受体乳糖的亲和力较低,特别是来自H.pylori的α-1,3岩藻糖基转移酶(如FutA),这使得2′-FL或3-FL的生产效率降低。但通过截断FutA的C端部分碱基和优化密码子,产率得到了提升[34]。另外的α-2,3和α-2,6唾液酸转移酶通过将唾液酸从活化的核苷酸糖供体(如CMPNeu5Ac)转移至受体低聚糖来修饰HMO。受体通常以半乳糖苷、N-乙酰半乳糖胺或其他唾液酸为终止信号[35]。
酶法合成虽然有较好的产物收率,但是必需酶的获得并不容易,且糖基转移酶催化需要糖核苷酸作为受体,受体的价格昂贵且不易获得,再加上酶促反应过程中,酶的稳定性、催化效率、底物和受体的耐受程度等固有属性都会对此法造成影响,使其难以大规模生产。
3.2.2 微生物发酵
随着代谢工程和合成生物学的发展,微生物合成途径过程中酶的克隆表达变得越来越广泛,使得全细胞生产的快速发展成为可能。微生物合成发酵就是直接在微生物细胞内利用其自身或基因工程过表达或异源表达不同酶进行寡糖合成的一种方法。由于HMOs种类和结构不同,所以其合成发酵的方式也有不同之处。
3.2.2.1 岩藻糖基化HMOs
岩藻糖基化HMOs是由岩藻糖和乳糖以不同的糖苷键连接而成,以α-1,2糖苷键连接形成2′-FL,以α-1,3糖苷键连接形成3-FL。2′-FL和3-FL作为HMOs中结构相对简单的低聚糖,在母乳中含量丰富,其中2′-FL作为HMOs的主要成分而存在,它是由核苷酸糖GDP-L-岩藻糖作为中间供体,在α-1,2岩藻糖基转移酶的作用下,与乳糖进行基团置换而形成的产物。3-FL与2′-FL形成的原理一致,只是由α-1,3岩藻糖基转移酶连接形成。
关于GDP-L-岩藻糖,它是岩藻糖基化寡糖生物合成途径的关键中间体,主要在岩藻糖基化反应中提供岩藻糖基,其在细菌、哺乳动物和植物中有2种合成途径,即从头合成途径与补救合成途径[36]。其合成图如图2所示。
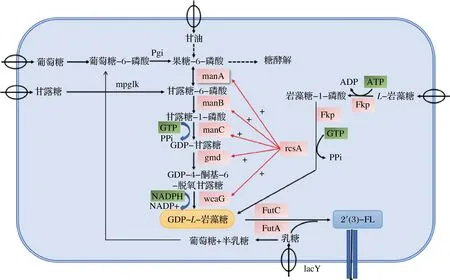
图2 GDP-L-岩藻糖的2种生物合成途径Fig.2 Biosynthetic ways of GDP-L-fucose
目前研究较多的是以大肠杆菌(Escherichiacoli)作为模式微生物,E.coli具有代谢产出GDP-L-岩藻糖的2条完整通路(从头合成途径和补救合成途径),通过构建代谢途径中的酶,以重组质粒转化模式生物进行过量表达,从而代谢产出GDP-L-岩藻糖。魏万涛等[37]通过克隆表达脆弱拟杆菌(Bacteroidesfragilis)来源的L-岩藻糖激酶/GDP-L-岩藻糖焦磷酸化酶(fucose pyrophosphorylase, Fkp)基因,以L-岩藻糖为底物,通过酶法最终产生GDP-L-岩藻糖的浓度为2.1 mmol/L。KOIZUMI等[38]以谷氨酸棒杆菌(Corynebacteriumglutamicum)产鸟嘌呤-5′-三磷酸(guanine-5′-triphosphate,GTP)作为能量,混合E.coli发酵产GDP-L-岩藻糖,其产量达到18.4 g/L。LEE等[39]在重组E.coli中过表达内源性NADPH再生酶,以期提高GDP-L-岩藻糖的产量,研究表明恒pH值的补料分批发酵中,NADPH再生酶葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)的过表达使GDP-L-岩藻糖产量增加了21%。
合成GDP-L-岩藻糖的起始碳源物质有葡萄糖、甘油、L-岩藻糖、甘露糖和乳糖,不同的起始碳源物质对其产量的影响和结果都不同。LEE等[40]通过添加甘露糖与以葡萄糖为唯一碳源的情况相比,在过表达gmd和wcaG基因的重组E.coliBL21 star(DE3)的补料分批发酵中,甘露糖和葡萄糖的供应导致GDP-L-岩藻糖浓度增加了1.3倍,同时,在葡萄糖限制性补料分批发酵中,一株表达manB、manC、gmd和wcaG基因的重组E.coliBL21 star(DE3)菌株中,最大GDP-L-岩藻糖浓度比仅表达gmd和wcaG基因的对照菌株高4.4倍。BAUMGARTNER等[41]以β-半乳糖苷酶缺陷型(lacZ-)的E.coliJM109 为宿主菌,通过构建GDP-L-岩藻糖的从头合成和补救合成通路,以0.2%岩藻糖和甘油为底物,GDP-L-岩藻糖的产量达到0.025 g/L。
乳糖的岩藻糖基化由岩藻糖基转移酶在胞内或胞外催化完成。在E.coliJM109(DE3)中表达来源于H.pylori的α-1,2岩藻糖基转移酶基因FutC,通过全细胞催化,其2′-FL产量只有1.23 g/L[42]。通过在N端增加3个天冬氨酸标签,使其FutC的酶活力增加,2′-FL的产量可达6.3 g/L[43]。在E.coliJM107ΔLacZ中表达H.pylori的α-1,2岩藻糖基转移酶基因FutC和可拉酸操纵子的调控因子rcsA,并敲除可拉酸代谢基因wcaJ,从而构建成产生2′-FL的菌株,以乳糖为底物,其发酵罐产量可达到14 g/L[44]。为了增强2′-FL的产量,通过构建共表达质粒含有2个α-1,2岩藻糖基转移酶基因FutC基因拷贝的菌株以增加酶活,其产量可达20 g/L[45]。李晨晨等[46]以E.coliBL21 star(DE3)为原始菌株,通过敲除β-半乳糖苷酶和UDP-葡萄糖脂质载体转移酶基因lacZ和wcaJ,通过补救途径摇瓶发酵,其2′-FL产量可达1.44 g/L。针对3-FL的文献报道中,HUANG等[47]对比不同来源的α-1,3岩藻糖基转移酶,结果表明来源H.pylori的FutA酶获得3-FL产量最高,为12.43 g/L。TAN等[48]对3-FL合成酶FutA进行了定向进化研究,通过突变使得突变体的3-FL合成能力提升了14倍。
3.2.2.2 唾液酸化HMOs
在唾液酸化的HMOs中,唾液酸乳糖的含量最高,包含3′-SL和6′-SL,其浓度可达980 nmol/mL。唾液酸乳糖主要是以α-2,3或α-2,6糖苷键连接,以唾液酸和乳糖作为前体物质而构成的3′-SL和6′-SL。首先,胞苷单磷酸-Neu5Ac(CMP-Neu5Ac)合成酶将Neu5Ac催化为CMP-Neu5Ac,其次是α-2,3唾液酸转移酶(α-2,3-PST)和α-2,6唾液酸转移酶(α-2,6-PST)分别催化CMP-Neu5Ac和乳糖生成3′-SL和6′-SL。除了体外化学合成外,微生物中也存在CMP-Neu5Ac的从头合成和补救合成途径,其代谢合成途径详见图3。FIERFORT等[49]通过共表达来自空肠弯曲杆菌(Campylobacterjejuni)的N-乙酰葡萄糖胺异构酶基因(neuC)、乙酰神经氨酸合成酶基因(neuB)、CM-乙酰神经氨酸合成酶基因(neuA)和来源于脑膜炎奈瑟氏菌(Neisseriameningitidis)的α-2,3唾液酸转移酶,以E.coli为宿主菌,同时敲除Neu5Ac醛缩酶、ManNAc激酶以及半乳β-糖苷酶的基因,确保代谢通路的通畅,以乳糖为底物生成3′-SL的产量为25 g/L。DROUILLARD等[50]采用与生产3′-SL相似的策略,使6′-SL的质量浓度达到30 g/L。此外,GUO等[51]发现多杀巴斯德杆菌(Pasteurellamultocida)唾液酸转移酶(PmST)具有双重反唾液酸酶活性,以糖巨肽(cGMP)和乳糖为底物,能够同时催化不同比例的3′-SL和6′-SL的形成。目前,已经成功开发了以低成本的底物,如甘油和乳糖,有效地合成3′-SL和6′-SL的方法。但是,YANG等[52]使用低成本的底物葡萄糖进行Neu5Ac的生物合成效率不高,导致最大产量仅为8.31 g/L。因此,必须从头进行Neu5Ac的生物合成。
微生物代谢发酵合成HMOs存在代谢产物种类多、难以分离的困难,也存在基因工程改造方面的缺陷,如构建重组质粒时采用抗生素标记基因,限制了其在食品生产中的应用,但随着科学研究的发展,难点被逐渐克服,其已成为目前最有发展潜力的一种技术。
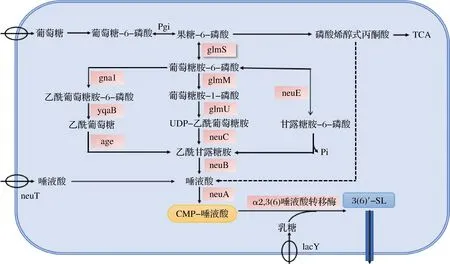
图3 CMP-Neu5Ac的两种生物合成途径Fig.3 Biosynthetic ways of CMP-Neu5Ac
4 展望
随着食品健康问题的频发,人们对婴幼儿配方奶粉的成分越来越关注,HMOs对促进婴幼儿生长发育具有重要的作用,有关HMOs的科学研究也成为热点。目前合成HMOs的方法有化学法,化学-酶法、酶法和微生物发酵法。生物合成相对于化学合成来说,由于其条件温和、生产成本低、环境友好等,越来越受到人们的偏好,但其也存在自身不利的缺陷,目前生物法只能合成结构简单的寡糖,对于复杂的HMOs合成困难,产量极低,同时也存在分离困难的问题。随着科学技术的发展,生物合成的应用前景越来最广泛,越来越多的模式微生物会被发掘利用,从而克服目前技术障碍,用来生产更加安全的产品。HMOs作为益生元对婴幼儿成长可发挥有益的生理作用,结合目前市场上婴幼儿配方奶粉的现状,亟待开发具有不同种类的、对婴幼儿健康状况有参考价值的产品。
