模拟冷链流通中温度波动对腐败希瓦氏菌的生长及其腐败产物的影响
2021-05-21钱韻芳林婷曹维叶晶鑫谢晶杨胜平
钱韻芳,林婷,曹维,叶晶鑫,谢晶*,杨胜平*
1(上海海洋大学 食品学院,上海,201306)2(上海水产品加工及贮藏工程技术研究中心,上海,201306)3(上海冷链装备性能与节能评价专业技术服务平台,上海,201306)
凡纳滨对虾(Litopenaeusvannamei)俗称南美白对虾,是当今世界上养殖产量最高的三大虾类优良品种之一[1]。凡纳滨对虾营养丰富,也极易发生细菌腐败。研究认为水产品的腐败变质主要由一系列化学和物理变化引起,其中微生物活动在该系列变化中起主要作用[2-3]。腐败希瓦氏菌(Shewanellaputrefaciens)是凡纳滨对虾中的优势腐败菌之一,因其较强的致腐败能力而受到国内外学者的关注[4-6]。其具有较强的蛋白质分解和产生胺类化合物的能力,是目前冷链流通中水产品常见的特定腐败菌[7]。为延长水产品在贮运过程中的保鲜期,常采用冷藏链流通方式来抑制腐败菌的生长,但由于现阶段存在冷链运输装备、操作不规范等问题,在运输过程中容易出现“断链”情况,引发温度波动,进而影响水产品保鲜品质[8-10]。目前研究多关注水产品品质变化,未从温度波动对微生物生长以及其代谢产物的影响进行分析。为研究冷链流通过程中温度波动对腐败希瓦氏菌的生长及其致腐败能力的影响,本文使用提取的凡纳滨对虾汁为腐败菌生长代谢提供营养,模拟冷链流通过程中的3种温度状态,分析虾汁中腐败希瓦氏菌的生长情况及总氨基酸含量、生物胺含量等理化指标的变化,分析温度波动引起水产品品质劣变的原因,为建立有效冷链流通体系,发展水产品贮运保鲜技术提供理论依据。
1 材料和方法
1.1 实验原料与菌株
1.1.1 实验原料
凡纳滨对虾购自上海市芦潮港码头,虾质量为13~15 g,长度为14~15 cm,保活运抵实验室后用碎冰猝死,冰水洗净,稍晾干待用。
1.1.2 供试菌株
菌株:腐败希瓦氏菌(S.putrefaciensQY38,NCBI Accession:KX692894)为前期冷藏凡纳滨对虾货架期终点分离纯化并鉴定获得的菌株,并于-80 ℃保藏。
1.2 试剂与仪器
丹磺酰氯(优级纯)、乙酸铵(优级纯)、乙腈(色谱纯),上海安谱科学仪器有限公司;铁琼脂(iron agar,IA)、胰蛋白胨大豆肉汤(trypticase soy broth,TSB),青岛高科园海博生物技术有限公司;盐酸、NaOH、NaCl、轻质氧化镁、NaOCO3、HClO4均为分析纯,国药集团化学试剂有限公司;氨基酸标品、生物胺标品,均为优级纯, Sigma试剂公司。
LC-2010C HT型高效液相色谱仪,日本岛津公司;Kjeltec2300型凯氏定氮仪,丹麦FOSS公司;HVE-50高压灭菌锅,日本Hirayama公司;VS-1300L-U超净工作台,苏净安泰集团;TDL-5-型离心机,上海隆拓仪器设备公司;835氨基酸自动分析仪,日本日立公司;Sarrtorius PB-10酸度计,德国赛多利斯集团。
1.3 样品预处理及无菌虾汁的制备
为尽可能避免全虾或虾仁中存在的原始杂菌对实验结果的干扰,本实验采用经高压蒸汽灭菌后的虾汁作为腐败希瓦氏菌的培养基。参考谢晶等[11]的方法,将凡纳滨对虾运抵实验室后用冰水洗净并去头、去尾、去虾线,搅碎过滤收集滤液,并用高压灭菌锅121 ℃下灭菌30 min备用。
1.4 腐败菌(希瓦氏菌)菌株活化
将该菌株于TSB中在30 ℃下培养24 h,使菌液浓度达1.0×108CFU/mL,再取1 mL接种于TSB中,培养约12 h左右至菌液浓度达到105CFU/mL后待用[12]。
1.5 接种与贮藏
将灭菌的虾汁冷却至室温,随机分为3组,其中A1、B1、C1组分别加入0.01 mL腐败希瓦氏菌菌液,对照组A2、B2、C2分别加入0.01 mL无菌TSB培养液。混匀后将各组置于不同温度贮藏如图1所示(模拟3种不同的冷链流通过程),对于A1、B1、C1组每24 h取1次样,测定相关指标。对A2、B2、C2组各取3次样(96、144和192 h),测定相关指标。

图1 凡纳滨对虾虾汁模拟冷链流通温度波动过程Fig.1 Simulated situations of temperature changes of Pacific white shrimp juice注:(+)为接种菌液实验组;(-)为对照组
1.6 菌落数的测定
参考YE等[12]的方法进行。
1.7 pH值的测定
吸取5 mL虾汁样品于烧杯中,加入无菌水至50 mL,搅拌均匀后静置30 min,用pH计进行测定,每组样品做2个平行[8]。
1.8 挥发性盐基氮(total volatile basic nitrogen,TVB-N)的测定
取5 mL虾汁样品,用凯氏定氮仪测定[12]。
1.9 总氨基酸的测定
参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[13]的方法进行测定。
1.10 凡纳滨对虾虾汁生物胺的测定
吸取4 mL虾汁样品,参考谢晶等[14]的方法进行测定。
1.11 致腐败能力分析
以贮运终点时1 CFU的腐败菌产生的腐败代谢产物TVB-N、腐胺、尸胺为指标[15]。腐败代谢产物产量因子YTVB-N/CFU、Y腐胺/CFU、Y尸胺/CFU分别按公式(1)、(2)、(3)计算:
(1)

(2)
(3)
式中:N0、Ns,初始点、贮运终点时的总菌数,CFU/g;(TVB-N)0、(TVB-N)s,初始点、贮运终点时的TVB-N量,mg N/g;腐胺0、腐胺s,初始点、贮运终点时的腐胺含量,mg/kg;尸胺0、尸胺s,初始点、贮运终点时的腐胺含量,mg/kg。
1.12 数据分析
使用Origin 8.5软件绘图,采用SPSS 19.0进行数据分析。
2 结果与分析
2.1 腐败希瓦氏菌菌落总数变化
腐败希瓦氏菌生长情况如图2所示。接菌的虾汁初始菌落数为5.05 lg CFU/g,与新鲜对虾的菌落数相近[16],对照组虾汁因经过灭菌未检测到初始菌落,且整个流通过程中都没有增加,说明灭菌效果良好,因此未在图中显示。由图2可知,A1组虾汁在10 ℃下贮藏24 h内腐败希瓦氏菌菌落数迅速上升,96 h时达到稳定期,为9.49 lg CFU/g,从168 h开始,A1组的菌落总数开始呈现下降趋势,可能是由于微生物进入衰亡期。B1组由于一直处于4 ℃条件下,其腐败希瓦氏菌生长缓慢,至192 h菌落数为9.08 lg(CFU/g)且其变化仍呈上升趋势。C1组的菌落数在前24 h内的增长情况与B1组相同,之后进入10 ℃的模拟运输过程中,其菌落数快速上升,运输96 h后基本达到稳定期,菌落数为9.10 lg CFU/g,当菌落数达到109CFU/g后温度重新降至4 ℃也不能降低其菌落数。结果表明,低温和温度波动并不影响腐败希瓦氏菌生长的最大菌落数,但会显著影响其增长速率,尤其是微生物快速增长的贮藏初期一旦发生温度波动会显著增大微生物的基数,即使温度重新降低也难以起到良好的抑制效果。张宁等[17]对于三文鱼的类似研究也发现频繁的温度波动可导致菌落总数上升。

图2 不同冷链流通条件下腐败希瓦氏菌在凡纳滨对虾汁中的生长情况Fig.2 Growth of S.putrefaciens inoculated in Pacific white shrimp juice at different cold chain logistics
2.2 pH值变化
在内源酶和微生物的作用下产生一系列化学反应可导致水产品pH值发生变化[18]。3种不同冷链流通条件下凡纳滨对虾虾汁pH值的变化如图3所示,A1、B1、C1实验组的pH值均呈现显著的上升趋势,而A2、B2、C2空白对照组的pH值均维持在6.91~6.97左右。贮藏24 h后3组实验组的pH值开始上升,可能是腐败希瓦氏菌分解虾汁中的蛋白质并积累了碱性含氮物质引起的[19]。实验结果表明,A1在72 h时pH值达到7.03,B1组pH值在168 h时才达到7.02,而C1组的pH值在96 h时就超过7.00。A1、C1组pH值变化与B1组存在较大差异,说明腐败微生物生长导致pH的增加与温度波动存在一定关系。

图3 不同冷链流通过程中凡纳滨对虾汁pH值变化Fig.3 pH value of Pacific white shrimp juice at different cold chain logistics
2.3 TVB-N变化
水产品蛋白质在微生物和内源酶的共同作用下分解为肽和氨基酸等,氨基酸可继续被降解为小分子挥发性的碱性含氮物质,其可用TVB-N表示[14]。本研究虾汁TVB-N值变化如图4所示。不同流通条件下接菌后虾汁的TVB-N值均呈显著上升趋势,空白对照组的TVB-N值在整个过程中基本保持平稳。
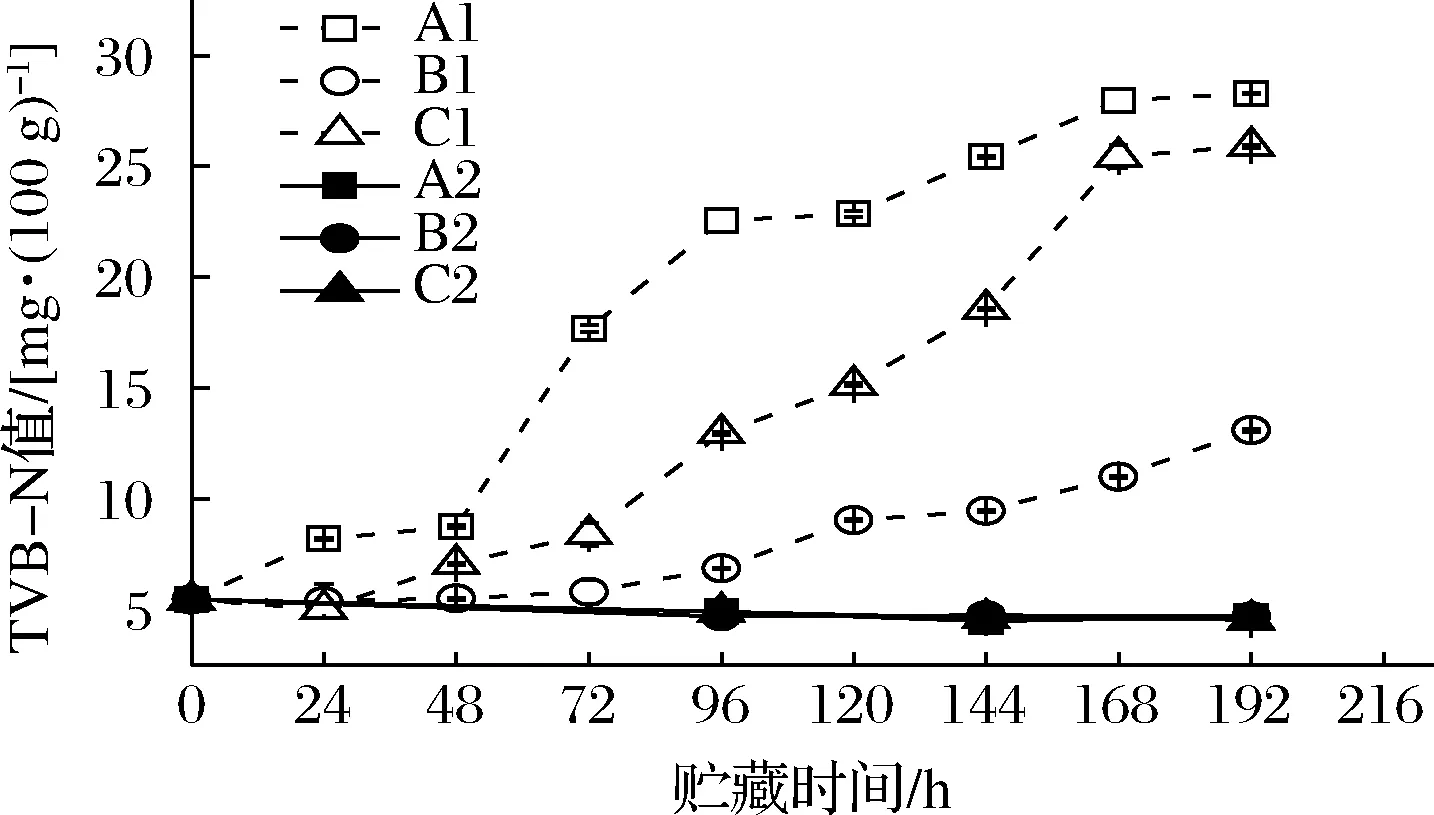
图4 不同冷链流通过程中凡纳滨对虾汁TVB-N值变化Fig.4 TVB-N contents of Pacific white shrimp juice at different cold chain logistics
B1组由于全程处于4 ℃条件下,与其他实验组相比其TVB-N含量水平较低,贮藏192 h时含量为13.11 mg/100 g。A1组在48 h后TVB-N开始快速上升,C1组TVB-N相对A1组变化较缓,但两者在冷链末期TVB-N含量较为接近,分别为28.29和25.91 mg/100 g,明显高于B1组和空白对照组,说明温度波动可导致腐败产物的增加,与杨胜平等[8]研究冰鲜带鱼在冷链流通中随温度波动的品质变化结果相一致。常大伟等[20]研究发现,温度波动会破坏肌纤维结构,增加溶酶体数量,加速鱼肉蛋白质的分解。A1、B1、C1样品的TVB-N上升趋势与细菌菌落数的增长呈一定相关性,说明TVB-N变化与微生物间存在联系。
2.4 总氨基酸含量变化
作为优质蛋白的来源,水产品富含氨基酸,而氨基酸又是大部分腐败产物的前体化合物[21],因此本文测定了虾汁中总氨基酸含量的变化。根据实验组在整个贮藏过程中腐败希瓦氏菌菌落总数和TVB-N含量的变化趋势,分别选取了A1组在第0、24、96和192 h;B1组在第0、96、120和192 h;C1组在第0、48、96和192 h;A2、B2、C2组分别在第0和192 h时进行总氨基酸含量的测定,其含量变化如图5所示。结果显示,虾汁总氨基酸的初始值为276.87 mg/g,在3种不同冷链条件的流通中,总氨基酸的含量均呈下降趋势。在贮运终点(192 h)时,A2、B2和C2对照组总氨基酸含量略有下降,且各组变化幅度相近,这可能是与游离氨基酸氧化分解有关,而A1、B1、C1实验组的总氨基酸含量出现显著下降,分别为170.48、169.51和160.92 mg/g,说明腐败希瓦氏菌的生长繁殖需要消耗虾汁中的氨基酸。C1组中虾汁总氨基酸含量下降幅度最大,其所处的冷链流通中的温度波动频率最高,因此推测温度波动促进了腐败希瓦氏菌的代谢活动,进而加速氨基酸的降解导致水产品品质下降[22]。

图5 不同冷链流通过程中凡纳滨对虾汁总氨基酸含量变化Fig.5 Contents of total amino acids of Pacific white shrimp juice at different cold chain logistics
模拟贮运过程中大多数的氨基酸含量都呈下降趋势,其中酪氨酸、赖氨酸、精氨酸的含量下降最为明显,这3种氨基酸含量的变化趋势如图6、7、8所示。
虾汁中酪氨酸的初始含量为10.01 mg/g,在经过192 h不同冷链条件的贮运后,A1、B1、C1实验组的酪氨酸含量分别下降至2.06、4.45和2.10 mg/g;精氨酸含量由最初的24.19 mg/g分别降低至12.34、17.61 和12.21 mg/g;赖氨酸含量则由19.44 mg/g分别下降至14.05、12.54 和12.69 mg/g。对照组中虾汁的酪氨酸、精氨酸和赖氨酸的含量均无明显变化,且精氨酸、酪氨酸含量的变化与腐败希瓦氏菌菌落数的变化具有一定相关性,因此推断虾汁中氨基酸含量的下降主要由腐败希瓦氏菌生长和代谢活动引起的。C1组氨基酸变化与A1组差异较小,而与B1组差异显著,说明温度波动可导致腐败希瓦氏菌对这3种氨基酸的需求量提高,从而促进相关氨基酸的降解。

图6 不同冷链流通过程中凡纳滨对虾汁酪氨酸含量变化Fig.6 Tyrosine contents of Pacific white shrimp juice at different cold chain logistics process

图7 不同冷链流通过程中凡纳滨对虾汁精氨酸含量变化Fig.7 Arginine contents of Pacific white shrimp juice at different cold chain logistics
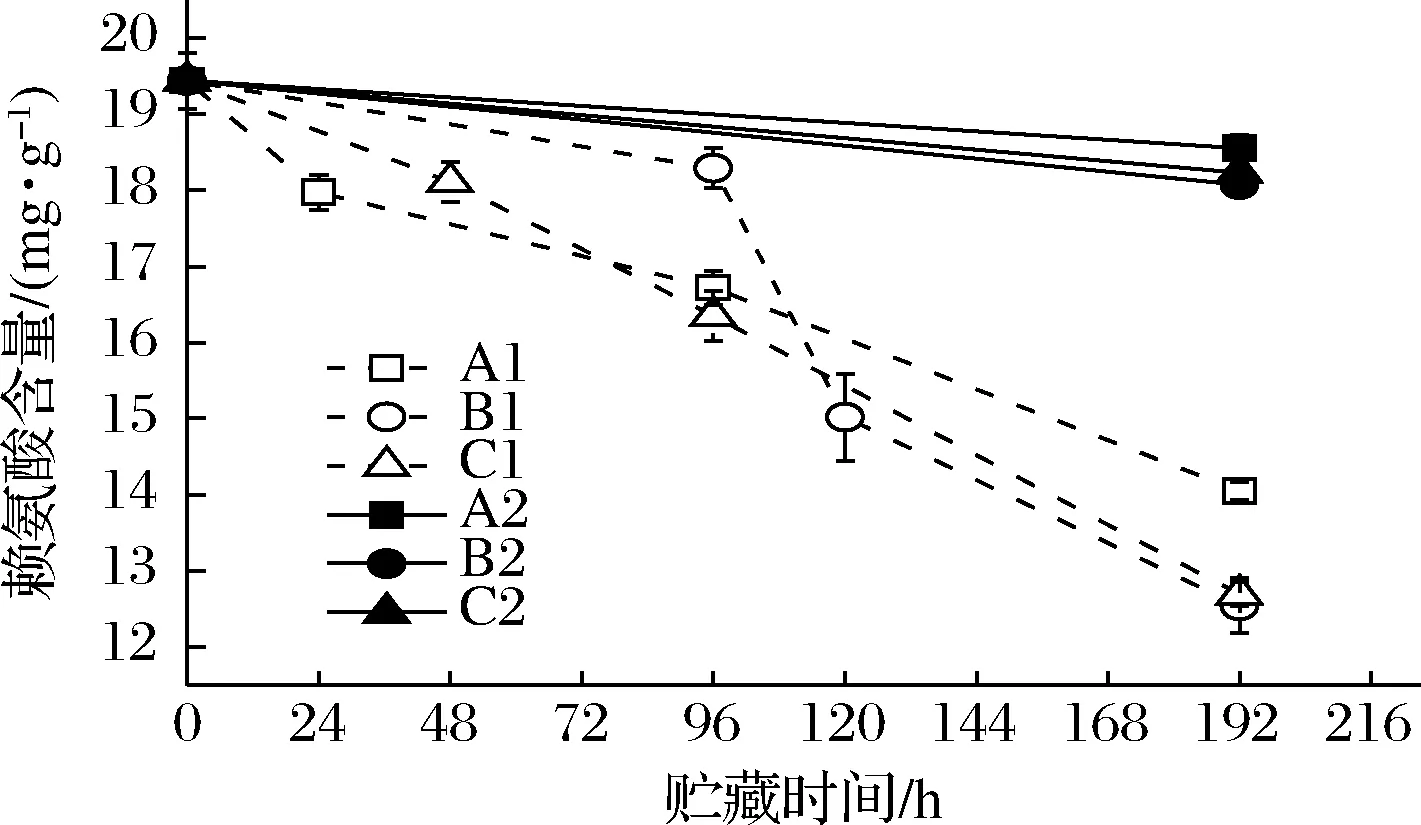
图8 不同冷链流通过程中凡纳滨对虾汁赖氨酸含量变化Fig.8 Lysine contents of Pacific white shrimp juice at different cold chain logistics
2.5 生物胺含量变化
微生物的脱羧酶能够将水产品中的氨基酸脱羧生成生物胺类物质[23-24]。这类反应过程能帮助微生物获得能量或者抵御不良环境[25]。生物胺的累积不仅会导致水产品的品质劣变,过量摄入如组胺、酪胺、五羟色胺等生物胺,还可能导致食物中毒[26]。通过检测发现接种腐败希瓦氏菌的虾汁中生物胺类物质主要为腐胺和尸胺,与本课题组前期研究[17,27]结果相一致,其变化如图9、10所示。凡纳滨对虾汁内最初的腐胺含量为3.48 mg/kg,A1、C1组在24和48 h时腐胺的含量已经分别上升至179.81和150.77 mg/kg,而B1组的虾汁在96 h时腐胺的含量仅为53.26 mg/kg。不同模拟冷链流通条件下的接菌组虾汁中腐胺含量不断上升,A1、B1、C1的腐胺含量在192 h时分别达到310.78、142.56 和327.32 mg/kg,而3个温度波动条件下的对照组A2、B2、C2虾汁中腐胺含量变化不大,说明腐胺的生成主要是由腐败希瓦氏菌代谢产生。贮运初期的温度波动导致腐胺的累积快速增加并在中后期不再受降温的影响。食品中的腐胺可以由精氨酸代谢产生[28],与本研究中腐胺含量的升高和精氨酸含量的下降趋势相一致。
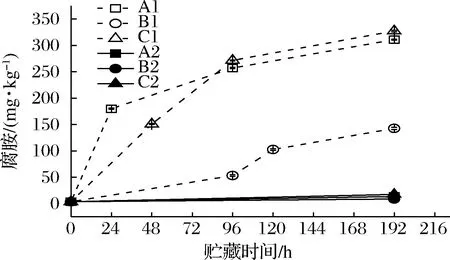
图9 不同冷链流通过程中凡纳滨对虾汁腐胺含量变化Fig.9 Putrescine contents of Pacific white shrimp juice at different cold chain logistics
如图10所示,A1、B1、C1组虾汁中尸胺含量不断上升,且在开始的24 h内A1组的尸胺含量由起始的2.21 mg/kg快速上升至58.07 mg/kg,在48 h内,C1组的尸胺含量上升至40.77 mg/kg,说明相对较高的环境温度以及存在温度波动的环境有利于虾汁中尸胺的产生和累积。同时,在货架期终点即第192 h时,C1组中的尸胺含量已经超过了A1组,为123.17 mg/kg,说明温度波动对尸胺含量的增加有较大影响。而空白对照组的A2、B2、C2中尸胺的含量基本稳定,表明尸胺含量的增加主要由腐败希瓦氏菌代谢产生。与腐胺不同的是,尸胺的前体化合物是赖氨酸[29]。
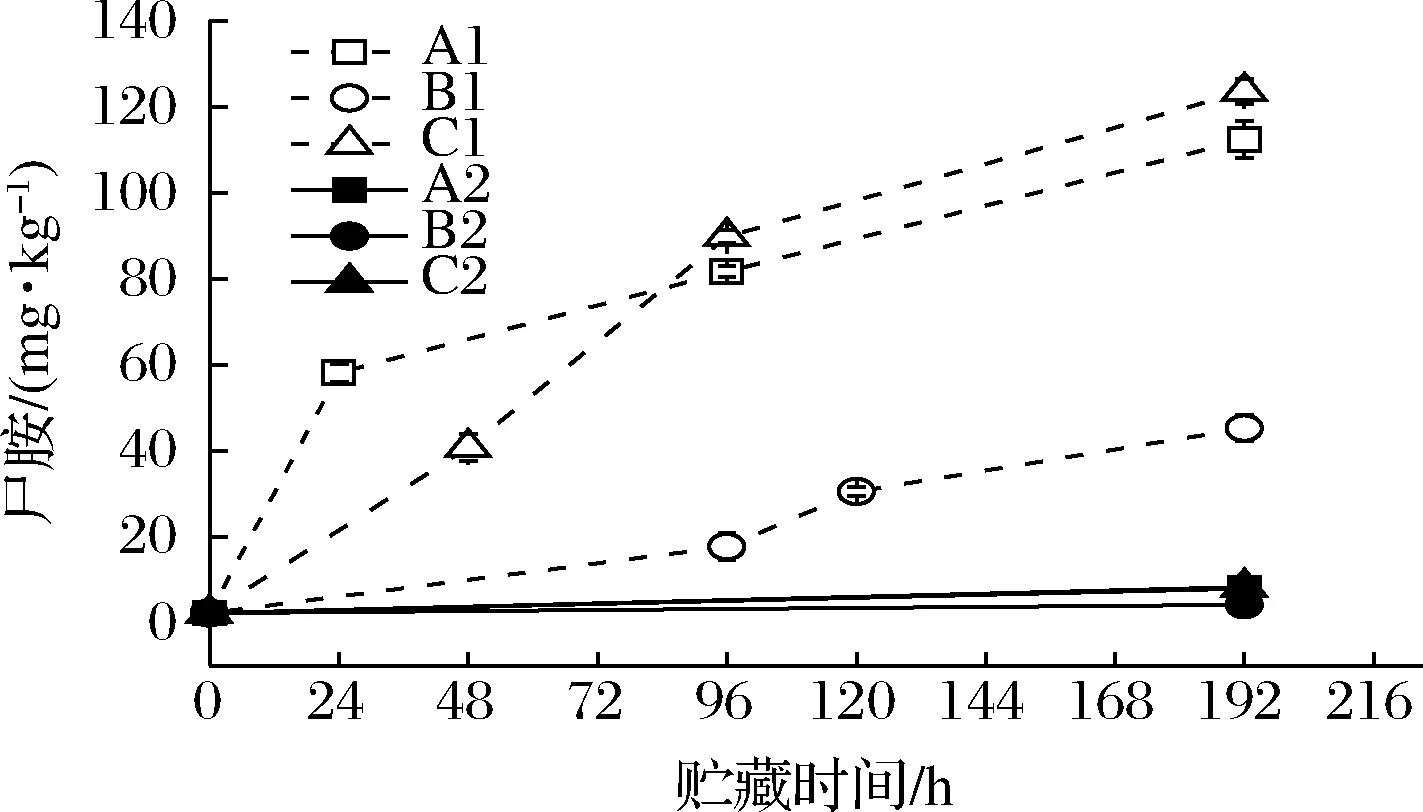
图10 不同冷链流通过程中凡纳滨对虾汁尸胺含量变化Fig.10 Changes in cadaverine contents of Pacific white shrimp juice at different cold chain logistics
2.6 腐败希瓦氏菌致腐败能力分析
腐败代谢产物产量因子在数值上等于单位数量腐败菌产生的腐败代谢产物的量,可作为衡量腐败菌致腐败能力的依据[15,30]。如表1所示,A1和C1组虾汁中贮运末期腐败希瓦氏菌TVB-N产量因子和尸胺产量因子均明显大于B1组,说明在外界较高温度以及温度波动条件下腐败希瓦氏菌的致腐败能力比在4 ℃恒温条件下强。同时,C1组在货架期终点时的菌落总数为1.26×109CFU/g,明显低于A1组,但C1组虾汁中的腐败希瓦氏菌TVB-N产量因子(YTVB-N/CFU)的数值约为A1、B1组的2~3倍,尸胺产量因子(Y尸胺/CFU)约为A1、B1组的3倍。C1组贮藏末期的腐胺产量因子(Y腐胺/CFU)也高于B1和A1组,说明与较高温度条件相比,外界环境的温度波动更能促进腐败希瓦氏菌产生腐败代谢产物。

表1 不同冷链流通过程中接菌凡纳滨对虾汁的致腐因子比较Table 1 Yield factors in TVB-N,putrescine and cadaverine contents of inoculated Pacific white shrimp juice at different cold chain logistics
3 结 论
通过分析腐败希瓦氏菌在3种不同模拟冷链流通条件下的凡纳滨对虾虾汁中微生物生长、腐败产物产量及氨基酸含量变化等,研究了腐败菌的生长和代谢活动,发现温度波动会加速流通初期腐败希瓦氏菌的生长繁殖,加速蛋白质的水解,导致TVB-N、腐胺、尸胺含量不断增加,且后期恢复低温也不能有效抑制微生物生长和腐败产物的累积,这可能是温度波动间接导致水产品品质劣变的原因。因此,水产品在冷链流通过程中尤其是贮运初期应尽可能避免温度波动出现“断链”现象。
