人参皂苷Rg1对大鼠阻塞性睡眠呼吸暂停低通气综合征引起的肺损伤及Nrf2/HO-1信号通路的影响
2021-05-21田婵婵王宏志马欣悦
田婵婵,王宏志,马欣悦
0 引言
阻塞性睡眠呼吸暂停低通气综合征(Obstructive sleep apnea-hypopnea syndrome,OSAHS)是世界上最普遍的慢性呼吸系统疾病[1]。OSAHS会导致短暂的呼吸停止(呼吸暂停)或睡眠期间流量明显减少(呼吸不足)[2],其中男性的发病率为22%(9%~37%),女性的发病率为17%(4%~50%)[3]。慢性间歇性低氧(Chronic intermittent hypoxia,CIH)是OSAHS的主要病理特征,表现为睡眠中反复出现缺氧和复氧情况,是OSAHS导致心脑血管并发症的主要因素[4]。OSAHS引起组织损伤,特别是在肺组织中,CIH可能引起肺部炎症,导致肺纤维化[5]。
研究发现,Nrf-2是人体抵抗氧化应激的重要调节剂,可以预防多种氧化应激疾病,例如癌症、高血压、肺纤维化、肾纤维化、阿尔茨海默病[6-7]。作为血红素加氧酶家族的成员,HO-1在抗炎、抗氧化和凋亡抑制中起着至关重要的作用[8]。因此,Nrf2/HO-1信号通路已成为氧化应激反应的重要信号途径[9]。
人参皂苷Rg1(GRg1)是一种四环三萜类化合物,是从人参提取的生物活性成分之一。多项研究表明,GRg1具有抗氧化活性[10],可有效减轻心脏、肝脏等的纤维化[11-12],还可抑制IL-6和TNF-α的表达,减轻内质网应激和炎症反应[13-14]。
本实验通过建立CIH大鼠模型,研究人参皂苷Rg1对大鼠OSAHS引起的肺损伤及Nrf2/HO-1信号通路的影响,进一步探讨其作用机制,为临床治疗OSAHS提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 60只SD大鼠(雄性,SPF级,6周,体重180~220 g)购自三峡大学实验动物中心。实验大鼠饲养于标准动物房中,正常饮食饮水,实验动物设计经过我院伦理委员会审查。大鼠适应环境2周后进行实验。
1.1.2 试剂 人参皂苷Rg1(HPLC≥98%)购自上海源叶生物科技有限公司。大鼠MDA试剂盒、大鼠SOD试剂盒、大鼠GSH试剂盒购自南京凯基生物科技有限公司。大鼠TNF-α试剂盒、大鼠IL-1β试剂盒、大鼠IL-6试剂盒购自北京索莱宝生物科技有限公司。HE试剂盒购自北京开瑞基生物科技有限公司。TRIzol试剂、PrimeScriptTM1st Strand cDNA Synthesis Kit试剂盒和SYBR®Premix EX TaqTMII试剂盒购自日本TaKaRa公司。RIPA裂解液、BCA试剂盒购自美国Abcam公司。兔抗COX-2抗体,兔抗iNOS抗体,兔抗HO-1抗体、兔抗Nrf2抗体、兔抗GAPDH抗体和山羊抗兔IgG抗体购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 大鼠CIH模型制备 造模:建立与OSAHS的病理生理特征相似的CIH动物模型。低氧舱内先输入压缩空气30 s,后输入氮气30 s,进行循环。实验过程中注意检测低氧舱内的氧浓度,使舱内氧浓度控制在8%~21%。实验过程中舱内产生的二氧化碳和水蒸气被生石灰和硅胶吸取[15]。大鼠每天定时在低氧舱内8 h,共4周。实验结束后进行CIH模型鉴定。
1.2.2 分组及给药 ①分组:60只SD大鼠分为4组:对照组(control组)、慢性间歇性缺氧组(CIH组)、人参皂苷Rg1低剂量组(CIH+GRg1-L组)和人参皂苷Rg1高剂量组(CIH+GRg1-H组),每组15只,control组大鼠不予任何处理,CIH组、CIH+GRg1-L组和CIH+GRg1-H组按“1.2.1”进行模型制备。②给药:给药方式为灌胃,control组:无菌生理盐水,4 ml/kg;CIH组:无菌生理盐水,4 ml/kg;CIH+GRg1-L组:18 mg/kg的GRg1,给药体积为4 ml/kg;CIH+GRg1-H组:36 mg/kg的GRg1,给药体积为4 ml/kg[16]。于造模前经灌胃相应剂量的生理盐水或GRg1。每天给药1次,连续7 d。
1.2.3 肺功能测定 在末次给药2 h后,采用动物肺功能分析系统测定各组大鼠的肺功能,计算IC、PEF、FEV0.3和VE。
1.2.4 MDA、SOD、GSH、TNF-α、IL-1β和IL-6的含量或活性测定 将各组大鼠肺组织放入到9倍体积的PBS中,用匀浆器分散到匀浆中,冻融3次,并在4 ℃以3 000 r/min 离心15 min,收集上清液。使用试剂盒分别检测MDA、GSH、TNF-α、IL-1β、IL-6、TNF-α的含量及IL-1β、SOD的活性。
1.2.5 HE染色 各组大鼠的肺组织在室温下用4%多聚甲醛固定过夜,用水洗涤6 h,然后在梯度浓度的乙醇中脱水(70%,2 h;80%,过夜;90%,2 h;100%,1 h)。将组织浸入二甲苯中直至透明,然后在60 ℃的石蜡中包埋2 h。将组织块切成5 μm薄片,在水中摊开并转移到载玻片上,于60 ℃干燥24 h。将切片在二甲苯中脱蜡,以梯度浓度的乙醇(100%,5 min;95%,2 min;85%,2 min;75%,2 min)中脱水。然后将切片用苏木精染色5 min,冲洗后再用伊红染色3 min,在梯度浓度的乙醇中脱水(每次2 min,分别以75%、85%、95%的比例脱水;每次5 min,以100%的比例脱水),在二甲苯中透明2次,每次10 min。之后使用中性树胶封片,使用光学显微镜观察切片并拍照。
1.2.6 qRT-PCR检测 TRIzol试剂提取肺组织中的总RNA。使用紫外分光光度计检测总RNA的含量,并将每个配对的样品调节至相同浓度。使用PrimeScriptTM 1st Strand cDNA Synthesis Kit试剂盒将提取的RNA逆转录成cDNA。按照SYBR Premix EX TaqTMII试剂盒进行qRT-PCR。qRT-PCR反应条件:95 ℃ 30 s(1循环)95 ℃ 5 s、60 ℃ 30 s(40循环)。
使用StepOnePlus仪器完成实验后,采用2-△△Ct法分析数据。引物见表1。
1.2.7 Western blot检测 使用全细胞裂解分析试剂盒从组织中提取总蛋白,并使用Nucleus Protein Extraction Kit从细胞核中提取蛋白。使用BCA蛋白质定量试剂盒测定蛋白质浓度后,通过SDS-PAGE分离总蛋白质和细胞核蛋白质;用SDS-聚丙烯酰胺凝胶电泳分离,并转移到PVDF膜上。在室温下用5%脱脂奶封闭1 h后,将PVDF膜与以下抗体在4 ℃孵育过夜:兔抗COX-2(1∶400)、兔抗iNOS(1∶400)、兔抗Nrf2(1∶400)、兔抗HO-1(1∶400)和兔抗GAPDH(1∶1 000)。随后,将PVDF膜用TBST洗涤3次,持续5 min,并与山羊抗兔IgG-HRP(1∶5 000)孵育1 h,用TBST洗涤3次,持续5 min。最后显影曝光,用Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。

表1 引物序列
2 结果
2.1 CIH模型的鉴定 大鼠在低氧舱内的最后1 d,分别在低氧舱内氧最低浓度和低氧舱内氧最高浓度时,随机对大鼠进行血氧饱和度和动脉血气分析检测,其血氧饱和度为70%~92%,动脉氧分压为60.7~80.1 mmHg,接近OSAHS病理生理特点,因此CIH动物模型建立成功。
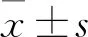
2.2 各组大鼠肺功能的比较 与control组比较,CIH组大鼠IC、PEF、FEV0.3及VE均明显降低(P<0.01);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠IC、PEF、FEV0.3及VE均升高(P<0.01)。结果见表2。
2.3 各组大鼠肺组织中MDA、SOD和GSH的表达变化 与control组比较,CIH组大鼠肺组织中MDA的含量明显增加(P<0.01),SOD的活性和GSH的含量均明显降低(P<0.001,P<0.01);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织中MDA的含量均降低(P<0.05),SOD的活性和GSH的含量均升高(P<0.05)。结果见表3。

表2 各组大鼠的IC、PEF、FEV0.3、VE比较

表3 各组大鼠肺组织中MDA、GSH含量以及SOD活性比较
2.4 各组大鼠肺组织中TNF-α、IL-1β和IL-6的表达变化 与control组比较,CIH组大鼠肺组织中TNF-α、IL-1β和IL-6的含量均显著增加(P<0.01);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织中TNF-α、IL-1β和IL-6的含量均降低(P<0.05)。结果见表4。
2.5 各组大鼠肺组织的病理变化 control组大鼠肺组织肺泡结构正常,没有炎性细胞浸润;CIH组大鼠肺组织严重受损,肺泡结构变形,上皮细胞变性,坏死脱落,并出现间质水肿,肺泡中可见炎性细胞浸润,大量液体渗出;CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织受损减轻,炎性细胞浸润减少,肺部水肿也减轻。结果见图1。

表4 各组大鼠肺组织中TNF-α、IL-1β和IL-6表达比较
2.6 各组大鼠肺组织中COX-2和iNOS的表达变化 与control组比较,CIH组大鼠肺组织中COX-2 mRNA和iNOS mRNA表达水平均显著上调(P<0.001);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织中COX-2 mRNA和iNOS mRNA表达水平均下调(P<0.05);由图2B可知,与control组比较,CIH组大鼠肺组织中COX-2 蛋白和iNOS 蛋白表达水平均显著上调(P<0.001);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织中COX-2蛋白和iNOS蛋白表达水平均下调(P<0.05)。见图2。

图1 各组大鼠肺组织的病理变化

图2 各组大鼠肺组织中COX-2和iNOS的表达变化
2.7 各组大鼠肺组织中Nrf2和HO-1的表达变化 与control组比较,CIH组大鼠肺组织中Nrf2 mRNA和HO-1 mRNA表达水平均显著上调(P<0.001);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织中Nrf2 mRNA和HO-1 mRNA表达水平均下调(P<0.05);由图3B可知,与control组比较,CIH组大鼠肺组织中Nrf2蛋白和HO-1蛋白表达水平均显著上调(P<0.001);与CIH组比较,CIH+GRg1-L组和CIH+GRg1-H组大鼠肺组织中Nrf2蛋白和HO-1蛋白表达水平均下调,差异有统计学意义(P<0.05)。结果见图3。

图3 各组大鼠肺组织中Nrf2和HO-1的表达变化
3 讨论
OSAHS是睡眠呼吸障碍的一种常见情况,其患病率在中老年人中为5%~14%[17]。OSAHS的病理生理学包括睡眠期间反复出现的部分或完全的上呼吸道阻塞,导致通气不足、呼吸暂停、间歇性缺氧和高碳酸血症[18]。OSAHS导致呼吸作用增加,交感兴奋性增加,睡眠结构改变和缺氧,这可能导致肺、心血管和脑血管事件,并引起代谢紊乱、神经认知功能障碍和其他疾病[19-20]。本研究采用低氧舱建立CIH模型大鼠,结果发现,大鼠的肺功能明显下降。
研究发现,ROS可以损伤细胞膜,被认为是氧化应激的标志[21]。MDA是由ROS催化的脂质氧化的最终产物,可攻击细胞膜和电子传输链[22]。因此,本研究将MDA的水平作为氧化应激反应的生物标志物进行了检测。SOD是一种重要的抗氧化酶,与催化酶和过氧化物酶一起可消除ROS[23]。GSH是一种三肽,在由谷胱甘肽过氧化物酶催化的反应中,被ROS氧化为谷胱甘肽二硫化物。然后,谷胱甘肽还原酶将谷胱甘肽二硫化物还原为GSH,以消除ROS[24]。本研究证明,CIH能引起氧化应激反应,使MDA含量升高,SOD活性和GSH含量降低。在本研究中,肺组织中的TNF-α、IL-1β和IL-6表达增加。TNF-α、IL-1β和IL-6均由白细胞产生,并在炎症反应中起重要作用[25-26]。这些结果的增加表明肺组织中存在炎症。
此外,CIH激活了缺氧诱导因子α,该因子刺激各种基因的转录,包括COX-2和iNOS[27]。在氧化应激过程中,iNOS的表达迅速增加。iNOS表达受多种细胞因子诱导,包括干扰素γ、IL-1、IL-6和TNF-α[28]。COX是前列腺素合成中的关键酶,而COX-2是可诱导的异构体,具有抗炎和抗氧化的特性[29]。本研究发现,CIH组大鼠肺组织中COX-2和iNOS蛋白明显增加,与上述文献报道一致。
Nrf2是抗氧化的最重要调节剂。在常氧条件下,Nrf2通常在细胞质中,但在氧化应激的条件下,Nrf2转移到细胞核中,激活抗氧化反应元件,并促进下游基因的转录,包括GPx、SOD和HO-1[9]。HO-1是一种可诱导的酶,可被多种压力诱导。Nfr 2/HO-1信号通路是氧化应激反应的重要信号途径,参与抗炎、抗氧化等[30]。本研究发现,CIH组大鼠肺组织中Nrf2和HO-1蛋白表达上调。
人参是一种传统中药,可能会影响许多生物过程,包括炎症反应,细胞增殖和凋亡。GRg1是人参中含量最丰富的成分,是人参药理作用的关键成分。有报道,GRg1对活性氧应激、衰老、血管生成和神经元分化具有调节作用[31]。本研究中,GRg1提高了大鼠的肺功能,大鼠肺组织中MDA的含量降低,SOD的活性和GSH的含量升高,TNF-α、IL-1β和IL-6的含量也降低;同时,大鼠肺组织受损减轻,炎性细胞浸润减少,大鼠肺组织中COX-2、iNOS、Nrf2和HO-1蛋白表达水平下调。因此,GRg1对OSAHS有一定的治疗作用。
综上所述,GRg1减弱了COX-2和iNOS的表达并抑制Nrf2的核易位,从而抑制了下游HO-1基因的转录并减弱了氧化应激反应,为临床治疗OSAHS提供了新的理论依据。
