黄芪甲苷IV对TGF-β1/Smad2介导的癫痫合并抑郁小鼠的保护作用
2021-05-21罗湘蓝苏雯靓王苏亚阎乃宽陈建国苏华龙
罗湘蓝,刘 平,张 望,苏雯靓,王苏亚,阎乃宽,陈建国,苏华龙
0 引言
癫痫与抑郁是神经精神科学领域的常见疾病,两者关系密切。癫痫作为最常见的精神系统疾病,是诱发抑郁症的危险因素之一,癫痫患者并发抑郁症的发病率是健康人群的2~3倍[1]。近期一项基于3 227例癫痫患者的Meta分析研究显示,癫痫患者伴有抑郁的发病率高达22.9%[2]。另一项通过回顾性分析12 720例14岁以上癫痫患者的研究显示,癫痫患者并发抑郁症的发病率约为16.3%[3]。由于抑郁症状不典型,癫痫伴发抑郁容易被临床忽视,严重影响了患者及其家庭的生活质量。柴胡疏肝汤、补中益气汤等是治疗癫痫发作或者情志低落的有效方剂[4-5],其中黄芪则作为这些方剂中的主要组成部分,发挥着重要作用。Song等[6]的研究显示,黄芪甲苷IV(Astragaloside Ⅳ,ASG IV)介导PPARγ/NF-κB/NLRP3炎性反应通路,改善长束缚造成的小鼠抑郁样行为。而Sun等[7]的研究发现,PPARγ在匹罗卡品点燃的癫痫症状小鼠脑中激活,并造成脑中产生氧化应激反应与认知功能损伤。因此,癫痫与抑郁是共生关系,在生理病理方面共享某些相同机制,如神经炎症、氧化应激等,而这些机制的最终导向都是神经元死亡。Zhu等[8]发现,黄芪甲苷IV通过抑制MAPK信号通路的激活改善神经元凋亡以缓解青霉素诱导的癫痫症状。因此,黄芪甲苷IV能够通过改善神经元凋亡有效改善癫痫合并抑郁样症状,但其机制尚待进一步探索。因此,本研究拟采用匹罗卡品点燃小鼠癫痫反应,探究其造成抑郁样行为的机制,讨论黄芪甲苷IV对癫痫合并抑郁的治疗机制,为临床使用提供理论支持。
1 方法
1.1 实验动物和分组 60只7周龄C57/BL6小鼠(第三军医大学实验动物中心),体重(20±2)g。小鼠在饲养室适应性喂养7 d后,随机分为对照组(Control group)、癫痫组(Epilesy group)、ASG IV低剂量组(ASG IV-L group,20 mg/kg)、ASG IV高剂量组(ASG IV-H group,40 mg/kg)、ASG IV(40 mg/kg)+ LY2109761(1 μg/只)组(ASG IV+ LY2109761 group)。小鼠饲养条件:室温(22±2)℃,正常日夜节律,自由饮水与摄食。
1.2 实验材料 匹罗卡品,氯化锂(武汉博士德公司);辣根过氧化物酶偶联山羊抗兔和山羊抗鼠二抗、RIPA蛋白裂解液、BCA试剂盒,Nissl染色试剂盒(上海碧云天公司);LY2109761试剂(美国西格玛公司);TGF-β1、p-Smad2、Smad2、β-actin蛋白抗体(美国CST公司);Cleaved-caspase-3、Caspase-3、Bcl-2、Bax蛋白抗体(武汉三鹰生物公司)。
1.3 动物给药与造模 造模前7 d,对照组与癫痫组连续灌胃10 ml/kg生理盐水,ASG IV-L组小鼠连续灌胃20 mg/kg ASG IV,ASG IV-H组与ASG IV+LY2109761组小鼠连续给药ASG 40 mg/kg;造模前3 d,ASG IV+ LY2109761组连续鼻滴TGF-β1抑制剂LY2109761,1 μg/只。造模时,参考文献癫痫造模方法[9],除对照组外,其余各组首先腹腔注射180 mg/kg新鲜配置的氯化锂溶液,12 h后先行阿托品皮下注射,30 min后腹腔注射50 mg/kg匹罗卡品溶液。对照组于相应时间点给予等量生理盐水。
1.4 动物行为学观察
1.4.1 癫痫发作次数和等级 腹腔注射氯化锂和匹罗卡品结束后30~90 min内,观察小鼠癫痫发作次数,对癫痫的发作级别进行评价。根据Racine标准[10]判定癫痫发作级别。0级:正常行动,无抽搐发作;1级:面部肌肉痉挛,表现为咀嚼运动、眨眼、动须等,湿狗样颤动;2级:颈部肌肉阵挛表现为点头运动,但无直立位,湿狗样颤动不停止;3级:一侧前肢阵挛,伴直立位;4级:双前肢阵挛,伴直立位;5级:在IV级基础上身体向后倒下失去平衡,四肢抽动。癫痫发作III级以上,连续癫痫性发作超过30 min以上者为癫痫持续状态。
1.4.2 糖水偏好实验 氯化锂合并匹罗卡品腹腔注射造模结束后24 h,所有小鼠禁食禁水12 h,各给予1 ml 1%蔗糖水和普通凉开水适应12 h。随后所有小鼠单笼饲养,每笼小鼠各给予1 ml 1%蔗糖水和普通凉开水。记录小鼠摄水12 h后糖水和白开水摄取量。糖水偏好率(%)=蔗糖水消耗量/(蔗糖水消耗量+纯水消耗量)×100%
1.4.3 强迫游泳实验 糖水偏好测试结束后6 h,将小鼠置于直径30 cm、高50 cm的不透明圆形强迫游泳容器中,适应2 min,小鼠之间用隔板隔开。摄像记录分析随后4 min内小鼠静止不动时间。
1.4.4 悬尾实验 强迫游泳测试结束后6 h,将小鼠尾尖悬挂于悬尾装置上,适应2 min,各小鼠之间用隔板隔开。摄像记录分析随后4 min内小鼠静止不动时间。
1.5 动物取材 行为学测试结束后,取3只小鼠,10%水合氯醛腹腔注射麻醉后,迅速打开胸腔暴露心脏,剪开左心室和右心耳。使用灌注针,自心脏左心室注入PBS溶液,从右心耳流出。待右心耳流出澄清液体时,再使用100 ml 4%多聚甲醛磷酸缓冲液缓慢灌注。断头取脑组织固定于4%多聚甲醛中,用于Nissl染色检测。剩余小鼠测完行为学后,迅速断头处死,取脑组织中海马组织与皮层组织,用于Western blot实验。
1.6 Nissl染色 取出多聚甲醛中大脑组织,流水冲洗标本后使用乙醇进行梯度脱水,再透明、浸蜡、包埋,切片机上切成4 μm厚石蜡切片。石蜡切片常规脱蜡脱水,采用SP法,高压修复抗原,依次加入3%过氧化氢、10%山羊封闭血清,之后按说明书使用尼氏染色试剂盒进行染色,烘干后使用中性树胶封片,置生物显微镜拍片。本研究统计方法是对图片中海马区神经元进行计数,取平均值后以对照组为标准进行归一化分析处理。
1.7 Western blot实验 按蛋白提取试剂盒说明书提取小鼠海马组织总蛋白,以BCA试剂盒测定总蛋白浓度,以蛋白量10 μg进行上样,采用SDS-PAGE凝胶电泳,经转膜、封闭、一抗孵育、二抗孵育、显影后使用Image J软件进行灰度值分析。

2 结果
2.1 黄芪甲苷IV对小鼠癫痫样行为的影响 研究结果如表1所示,与对照组相比,癫痫组造模成功后表现出不同等级的痉挛、癫痫发作,1 h内达到6.91次,平均等级达到4.16级。提示氯化锂合并匹罗卡品成功造成小鼠出现癫痫症状。与癫痫组相比,黄芪甲苷IV高剂量组发作频率与发作等级显著降低(P<0.05),而黄芪甲苷IV低剂量组与癫痫组相比并没有显著性改变,提示黄芪甲苷IV改善小鼠癫痫行为具有剂量依赖性。此外,TGF-β1受体抑制剂LY2109761的预给药阻断了黄芪甲苷IV改善小鼠癫痫发作的作用,提示黄芪甲苷IV改善小鼠癫痫发作可能与TGF-β1相关。
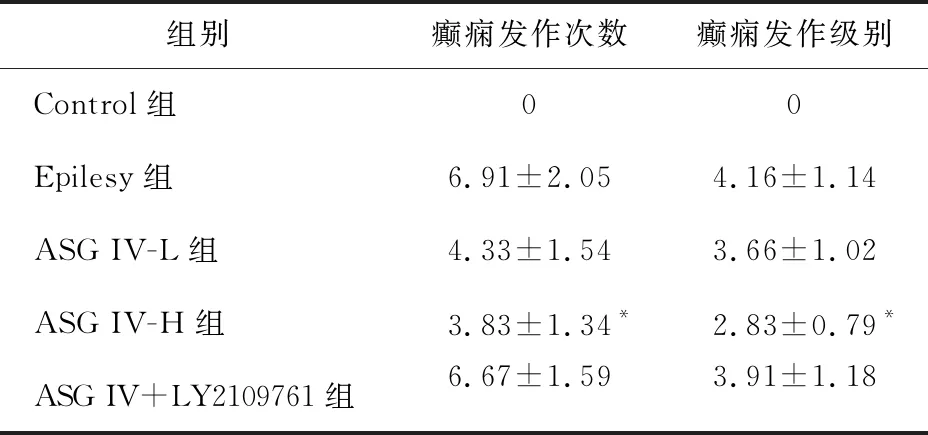
表1 氯化锂合并匹罗卡品诱导小鼠癫痫自发性再发作的频率与程度
2.2 黄芪甲苷IV对小鼠抑郁样行为的影响 实验结果如图1所示,与对照组相比,癫痫组小鼠糖水摄取率降低(P<0.05),且强迫游泳与悬尾不动时间延长(P<0.05)。提示癫痫造成这些小鼠出现一定程度的抑郁样症状。此外,与模型组相比,黄芪甲苷IV预给药能够改善小鼠抑郁样行为,其中,黄芪甲苷高剂量组小鼠糖水摄取率升高(P<0.05),而强迫游泳和悬尾不动时间缩短(P<0.05)。此外,TGF-β1抑制剂显著逆转了黄芪甲苷IV改善小鼠抑郁样行为的效果(P<0.05)。提示黄芪甲苷IV通过TGF-β1信号通路途径,改善小鼠抑郁样行为。
2.3 黄芪甲苷IV对小鼠海马组织中TGF-β1/Smad2路蛋白的影响 与对照组相比,癫痫组小鼠海马中TGF-β1蛋白表达水平、Smad2磷酸化水平显著降低(P<0.05)。黄芪甲苷IV预给药能够升高TGF-β1蛋白、p-Smad2蛋白水平,且高剂量黄芪甲苷IV预给药能够显著升高上述蛋白表达(P<0.05)。此外,TGF-β1干预降低了黄芪甲苷IV的疗效。见图2。
2.4 黄芪甲苷IV对小鼠海马组织中凋亡相关蛋白的影响 与对照组相比,癫痫组小鼠大脑中Caspase-3剪切升高(P<0.05),且Bcl-2表达降低,Bax表达升高,Bcl-2/Bax表达比例降低(P<0.05);与癫痫组相比,高剂量黄芪甲苷显著抑制了小鼠海马中Caspase-3蛋白剪切,升高Bcl-2与Bax表达比例。此外,与对照组相比,ASG IV+LY2109761组海马中Caspase-3表达比例升高(P<0.05),Bcl-2/Bax表达比例降低(P<0.05),提示黄芪甲苷IV能够改善小鼠海马中凋亡相关蛋白表达,其机制与TGF-β1受体激活有关。见图3。
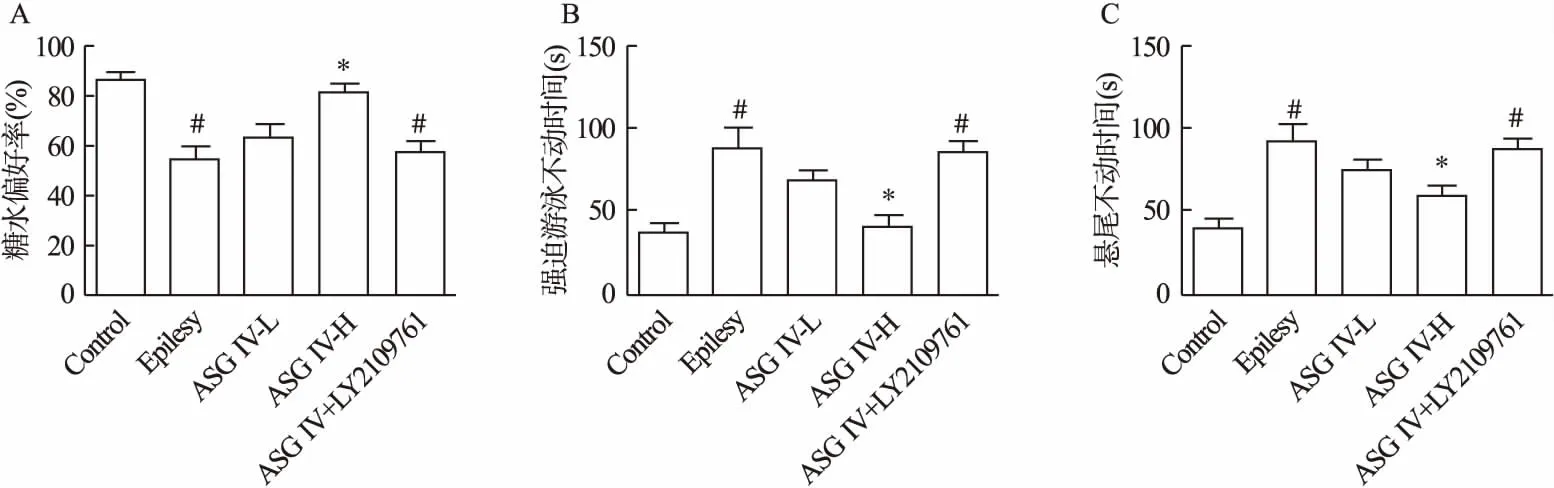
图1 氯化锂合并匹罗卡品诱导小鼠抑郁样行为学检测
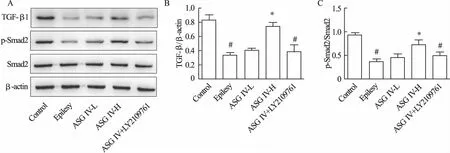
图2 Western blot检测各组大鼠海马组织中TGF-β1、p-Smad2 蛋白的表达
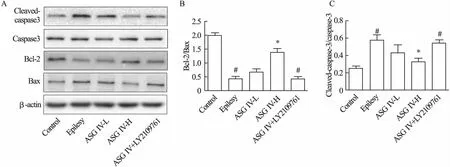
图3 Western blot检测各组大鼠海马组织中Cleaved-caspase-3、Bcl-2、Bax蛋白的表达
2.5 黄芪甲苷IV对小鼠海马神经元的影响 如图4所示,Nissl染色结果显示对照组小鼠海马CA1区神经元形态正常,细胞核呈蓝色分布,Nissl体阳性细胞数表达丰富,各层细胞结构整齐,无神经元细胞损伤;与对照组相比,癫痫组小鼠海马区域CA1区神经元呈层状排列,结构紊乱,大量细胞形态出现改变,细胞核固缩,细胞膜破裂,Nissl体表达显著降低(P<0.05),造成小鼠脑部异常放电并表现出癫痫行为。与癫痫组类似,与对照组相比,ASG IV+TGF-β1组Nissl体表达显著降低(P<0.05)。然而,与癫痫组相比,高剂量ASG IV预给药能够显著改善小鼠海马中神经元损伤(P<0.05),提高Nissl体阳性细胞数,提示黄芪甲苷能够改善小鼠海马神经元损伤。

图4 Nissl染色检测黄芪甲苷IV对氯化锂合并匹罗卡品诱导小鼠海马神经元的影响及量化统计图
3 讨论
癫痫是一种由多原因引起的局部脑区神经元异常放电,大脑功能短暂障碍的一种慢性疾病。表现出运动、感觉、意识、精神等方面异常,伴有全身抽搐痉挛的现象[11]。本次点燃小鼠癫痫化学药物为氯化锂合并乙酰胆碱受体激动剂匹罗卡品,其所致的癫痫模型属于比较典型的颞叶癫痫模型,临床上颞叶癫痫最常见,而抑郁也与颞叶或额叶癫痫发作有关[12]。研究显示,氯化锂合并匹罗卡品可引起小鼠出现与临床类似的不同程度的全身痉挛,伴有湿狗样颤动的现象。本次实验中氯化锂合并匹罗卡品成功点燃小鼠癫痫模型。黄芪甲苷IV提前干预能够在一定程度上缓解小鼠癫痫发作的频率与等级。此外,抑郁与癫痫一样,属于神经退行性疾病,两者在病理生理上共享某些机制。癫痫伴发抑郁的致残率、致死率高于非抑郁组,并且伴发抑郁对于癫痫个体而言,治疗预后较差[13-14]。本次实验中,癫痫造模成功的同时造成小鼠出现抑郁样症状,表现出糖水偏好摄取率降低的无喜感偏好行为,强迫游泳及悬尾不动时间增加的求生欲降低现象。而黄芪甲苷IV显著改善了小鼠抑郁样行为,TGF-β1抑制剂则逆转了黄芪甲苷IV的抗抑郁效果,提示本次实验成功造成了小鼠出现癫痫合并抑郁样症状。黄芪甲苷IV能够显著改善小鼠癫痫合并抑郁的症状,且存在剂量依赖性,其机制可能与提高TGF-β1蛋白表达相关。
TGF-β1是一种多功能的细胞因子,能够调节多种生理和病理过程。TGF-β1可由中枢神经系统中神经元、星型胶质细胞和小胶质细胞产生,从而参与调节神经细胞的生长、分化和凋亡,在多种生理病理发展过程中起重要作用。外源性TGF-β1能够显著改善小鼠癫痫发病,减少小鼠海马中神经细胞凋亡[15-16]。TGFβ1作用于下游受体型的Smad2,使Smad2蛋白C端丝氨酸参加磷酸化,Smad2转位到核内,启动转录因子聚合物LEF/TCF,调控相应基因表达,以此产生广泛的生物学效应[17]。有报道,中药能够改善慢性病变的临床症状和防治靶器官受损[18]。黄芪甲苷IV是黄芪的主要有效成分,在神经退行性疾病中表现出显著的抗凋亡作用。在本研究中,癫痫组小鼠海马中TGF-β1蛋白表达显著降低,且其下游Smad2磷酸化水平显著降低。黄芪甲苷IV有效增加TGF-β1蛋白表达,增加Smad2磷酸化水平。然而,TGF-β1抑制剂显著逆转了黄芪甲苷的促进表达作用,提示黄芪甲苷可调控TGF-β1蛋白的表达。
神经元凋亡是癫痫与抑郁在病理生理方面共同的病理机制之一[19]。动物实验证实,神经细胞癫痫样放电可促进海马神经元凋亡,这与癫痫发作导致多种凋亡分子表达,进一步诱导多种信号通路传导紊乱有关[20]。Caspase-3是细胞凋亡过程中最重要的终末剪切酶,是细胞杀伤机制的主要组成部分。在局灶性缺血大鼠中,脂质体介导的TGF-β1可以通过激活丝裂原活化蛋白激酶/细胞外信号调节激酶(MARK/Erk)通路减少脑组织中凋亡的神经细胞数目及Caspase-3 mRNA的表达,并可以改善缺血大鼠的神经功能障碍[21]。此外,Smad2磷酸化抑制剂SIS3干预能够显著减少其下游Cleaved-Caspase-3表达[22]。在Bcl-2家族中,bcl-2具有抗凋亡作用,而Bax则是重要的凋亡执行分子,具有促凋亡作用,与癫痫小鼠脑中海马神经凋亡密切相关。本研究中,癫痫组小鼠海马中Caspase-3剪切显著升高,而Bcl-2/Bax表达比例显著降低,造成小鼠海马中Nissl体表达显著降低。黄芪甲苷IV预给药显著降低了海马中Caspase-3剪切,Bcl-2/Bax表达比例显著升高,而TGF-β1抑制剂有效逆转了黄芪甲苷IV预给药对Cleaved-Caspase-3表达及Bcl-2/Bax表达比例的影响,造成神经元凋亡增加,提示黄芪甲苷通过调节TGF-β1蛋白改善小鼠海马中Caspase-3的剪切,而TGF-β1的抑制最终造成了小鼠Caspase-3剪切增加,导致小鼠海马神经元凋亡。
癫痫相关性抑郁的病因复杂,目前其发病机制尚未明确。癫痫相关性抑郁动物模型能够部分反映其发病机制,神经凋亡则是两种疾病已确认的共同通路[23]。本研究显示,氯化锂合并匹罗卡品成功造成小鼠出现癫痫样行为,并且造成小鼠海马神经元凋亡,其可能机制是抑制TGF-β1蛋白表达,降低其下游蛋白Smad2磷酸化水平,使Caspase-3蛋白剪切增加,最终导致小鼠海马神经元凋亡,大脑中出现异常放电,造成小鼠出现癫痫合并抑郁样症状。而黄芪甲苷IV能够有效地增加TGF-β1蛋白表达,减少Caspase-3蛋白剪切,减少海马神经元凋亡,进而减少海马中异常放电现象,缓解小鼠癫痫合并抑郁样症状。
