PEDV编码蛋白拮抗宿主天然免疫的研究进展
2021-05-20宋海鑫丁芳艺苗晋锋刘永杰张金秋
宋海鑫,丁芳艺,梁 荣,苗晋锋,卢 宇,刘永杰,张金秋
(1.江苏省农业科学院动物免疫工程研究所,南京210014;2.南京农业大学动物医学院,南京210095;3.省部共建国家重点实验室培育基地—江苏省食品质量安全重点实验室,南京210014;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州225009;5.江苏大学药学院,镇江212013)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于尼多病毒目冠状病毒科α冠状病毒属,是一种具有囊膜的单股正链RNA病毒[1]。PEDV感染可引起新生仔猪严重呕吐、腹泻和脱水,死亡率高达80%~100%。我国自上世纪80年代初首次分离到PEDV后,该病毒就在猪群中持续存在,并逐渐成为引起仔猪腹泻的主要病原之一。虽然市售的灭活疫苗及弱毒疫苗具有一定的防控效果,但近年来,猪流行性腹泻的发病率仍呈逐年上升趋势。尤其是2010年以来,随着PEDV新的变异株的出现,猪流行性腹泻再次在美洲、欧洲及亚洲的多个国家暴发,给养猪业造成了严重的经济损失[2]。目前,猪流行性腹泻已成为对我国猪群危害最严重的疾病之一。
天然免疫是宿主防御病原微生物感染的第一道防线。病毒入侵后,宿主细胞通过模式识别受体(pattern recognition receptor,PRR)识别病原相关分子模式(pathogen-associated molecular patterns,PAMP),进而促进干扰素及其他促炎细胞因子的产生,使细胞进入抗病毒状态;另一方面,病毒在进化过程中会形成多种“精明”的机制,通过编码相关蛋白拮抗宿主的防御反应,实现快速增殖,最终导致疾病的发生。本综述结合目前关于PEDV与宿主细胞相互作用的研究进展,分析了PEDV编码的各种蛋白在感染过程中对抗宿主天然免疫系统的分子机制,旨在为后续研究提供思路。
1 PEDV基因结构概述简介
PEDV基因组全长约为28 kb,含5'端帽子结构和3'端Poly(A)尾巴。从5'端开始,依次为5'非翻译区(untranslated region,UTR)、七个开放阅读框(open reading frame,ORF)ORF1a、ORF1b和ORF2-6)及3'端UTR。PEDV的两个主要的开放阅读框ORF1a、ORF1b编码病毒的非结构蛋白,且二者之间有46 nt的重叠区,该重叠区可发生核糖体移码,能够产生一个ORF1a和ORF1b共同编码的多聚蛋白1ab(pp1ab)[1,3]。PP1ab是一个多功能蛋白,在内部两个蛋白酶的自切割作用下,可进一步裂解为16个非结构蛋白(nonstructural protein 1~16,nsp1~16),参与病毒的复制及转录过程。近3'端的ORF编码4种结构蛋白:纤突蛋白(spike protein,S)、膜蛋白(membrane,M)、小膜蛋白(envelope,E)、核衣壳蛋白(nucleocapsid protein,N)和辅助蛋白ORF3。PEDV通过S蛋白与宿主细胞膜上的受体结合,然后通过膜融合以内吞方式进入靶细胞,经过脱衣壳作用将病毒的基因组释放到细胞质中,开始病毒复制。
2 冠状病毒感染激活宿主的天然免疫信号通路
天然免疫信号通路的活化是机体感知病原入侵的重要表现形式,在限制病毒的感染和早期扩散方面发挥着重要作用。宿主细胞可通过不同的模式识别受体(PRRs)感知病毒的入侵,主要包括Toll样受体家族(toll-like receptors,TLRs)、视黄醇诱导基因I(human retinoic acid inducible gene I,RIG-I)样受体家族(RIG-I-like receptors,RLRs)、C型凝集素家族及核苷酸寡聚化结构域样受体家族(NOD-like receptors, NLRs)等[4]。其中与冠状病毒感染密切相关的是RLRs和TLRs介导的信号转导途径。
冠状病毒感染细胞后,病毒基因组RNA及复制过程中产生的单、双链RNA被胞质中的RIG-I/MDA5受体识别,随后通过线粒体抗病毒信号蛋白(MAVS/IPS-1/VISA/CARDIF)传递信号,招募TRAF3/6,进一步激活TBK1/IKK激酶复合体并使其发生磷酸化,最终激活NF-κ B和IRFs等核转录因子,进而诱导干扰素(Interferon,IFN)的大量产生。进入内体中的病毒RNA还能够被胞内受体TLR3、TLR7或TLR8识别,其中TLR3主要识别双链RNA,TLR7、TLR8主要识别富含G/U的单链RNA。TLRs活化后,可招募其下游的接头蛋白,如MyD88、TRAF3/6等,通过MyD88依赖性或非依赖性通路将信号传递给NF-κB和IRFs等核转录因子,进而诱导促炎症细胞因子及Ⅰ型干扰素的产生。RLRs及TLRs介导的Ⅰ型IFN产生通路存在共同的信号分子级联活化途径TRAF3-TBK1-IRF3,二者相互联系,相互影响。产生的干扰素又可通过自分泌或旁分泌的方式作用于胞外受体IFNAR,激活JAK-STAT通路,诱导大量抗病毒蛋白的产生,如干扰素刺激基因15(interferon-stimulated gene 15,ISG15)、ISG56、核糖核酸酶L(ribonuclease L,RNaseL)、2'-5'寡聚腺苷酸合成酶(2'-5'-OAS)[5]等,可直接降解病毒RNA,干扰病毒RNA的编译,使细胞进入抗病毒状态,如图1所示。Li等[6]研究表明,小鼠肝炎病毒(Mouse hepatitis virus,MHV)感染少突胶质细胞后,RIG-I的表达上调,且RIG-I和MDA5在该病毒诱导IFN-I产生的过程中是必不可少的。Wang等[7]研究表明,在PEDV感染后12~24 h,抗病毒基因(RIG-I、PKR、OAS1、Mx1和Mx2)和炎性细胞因子(IFN-α、IFN-β、TNF-α、IL-6、IL-8和IL-12)的表达均显著上调,提示这些基因可能在PEDV感染后宿主细胞的天然免疫应答中起重要作用。在本实验室的前期研究中,我们对不同细胞感染PEDV后天然免疫信号通路的变化进行了分析,发现TLR3、RIG-1、MDA5、TRIF、TRAF3等的mRNA水平在8~24 h内均出现显著升高,表明RLRs及TLRs介导的两条信号通路中,与RNA病毒识别的相关受体基因均受到快速激活,进而激活下游的信号传递。
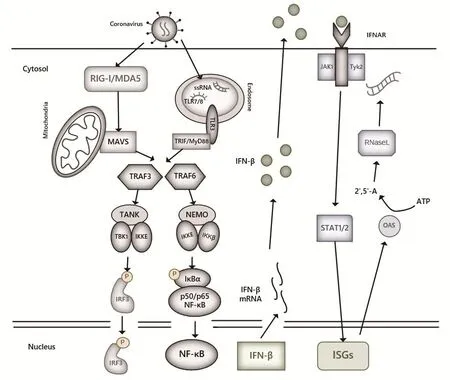
图1 冠状病毒感染细胞激活RLRs和TLRs信号通路Fig.1 Activation of RLRs and TLRs signaling pathways in coronavirus-infected cells
3 PEDV编码蛋白在逃避宿主天然免疫中的作用机制
病毒的生长和复制必须在宿主细胞内进行,因此病毒入侵细胞后需要创造有利于自身复制和增殖的胞内环境,如调整细胞因子的活性、调节细胞内的信号通路等。目前,PEDV逃避宿主天然免疫的研究已经取得实质性的进展,病毒或通过隐藏其双链RNA来阻断RIG-I信号通路的识别,或阻断抗病毒信号通路中分子信号的传递,而病毒复制过程中产生的结构蛋白及非结构蛋白等与病毒的逃逸机制密切相关,本文对PEDV编码的一些重要蛋白在免疫逃避中的作用加以综述。
3.1 非结构蛋白 PEDV编码的非结构蛋白主要参与病毒复制酶复合体的编译和病毒RNA的合成,其在病毒复制过程中表达,但并不出现在成熟的病毒粒子中。近年来的研究表明,PEDV的多个非结构蛋白能够抑制宿主天然免疫反应,为入侵的病毒提供了快速复制和扩散的机会。
PEDV编码的nsp1长度为110个氨基酸,与β冠状病毒的nsp1同源性较高,且用于维持蛋白结构的重要疏水氨基酸序列具有高度保守性,因此推测其结构和功能上可能具有相似性。研究表明,严重急性呼吸综合征冠状病毒(Severe acute respiratory syndromes coronavirus,SARS-CoV)和中东呼吸综合征冠状病毒(Middle east respiratory syndrome coronavirus,MERS-CoV)的nsp1蛋白能够通过诱导内切核酸酶选择性地剪切宿主mRNA,并能通过结合核糖体40S亚基阻止宿主mRNA的翻译。另外,SARS-CoV的nsp1蛋白能够抑制IFN mRNA的翻译,进而改变IFN的产生及下游的信号传递。与SARSCoV nsp1相似,Zhang等[8]研究证明,PEDV nsp1也是一种有效的IFN拮抗剂,并且在已知的PEDV编码的多种IFN拮抗蛋白中,nsp1的拮抗活性最显著。PEDV nsp1能促进蛋白酶体介导的核转录因子结合蛋白(cAMP response element binding protein,CBP)降解,使得IRF3磷酸化入核之后无法和CBP结合,阻碍增强子复合体的形成,进而抑制Ⅰ型IFN产生。在PEDV感染的IPEC-DQ、LLC-PK1和MARC-145细胞中,nsp1可以通过阻断IRF1的核移位抑制过氧化物酶体MAVS介导的Ⅲ型IFN的产生[9]。另外,nsp1还可以通过抑制IκBα磷酸化及其随后的泛素化降解,阻断p65亚基的核移位,进而抑制NF-κB的核转运及信号传导,不仅影响干扰素产生,还影响TNF-α、IL-1β、IL-6等细胞因子的产生[9]。
Nsp3是PEDV编码的最大的跨膜蛋白,包含两个木瓜样蛋白酶结构域(PLP1和PLP2),其中PLP2具有去泛素化酶(deubiquitinating enzymes,DUB)活性,不仅可以识别和处理与K48、K63连接的多泛素链,而且还可以去除RIG-I和STING中的泛素结合物,拮抗IFN-β产生,从而逃避宿主天然免疫[10]。在人类冠状病毒中也有相似的发现。SARS-CoV和MERS-CoV编码的nsp3蛋白对TBK1、IRF3去泛素化,同时与TRAF3、TBK1、IKKε、STING和IRF3互作,抑制IRF3磷酸化以及入核,从而抑制干扰素产生[11-13]。此外,人冠状病毒NL63的PLP2蛋白可以通过去泛素化并稳定MDM2(一种E3泛素连接酶)来增加p53降解,进而抑制p53-IRF7-IFN-β信号通路[14]。
冠状病毒nsp5是一种具有蛋白水解功能的3C样蛋白酶(3CLpro),是病毒多聚蛋白加工过程中所必须的,也称为主蛋白酶。Wang等[15]发现PEDV的nsp5蛋白能通过靶向切割NEMO(NF-κB essential modulator),阻断干扰素产生通路。有趣的是,δ冠状病毒的PDCoV编码的nsp5蛋白也存在相似功能[16],另外,属于冠状病毒科动脉炎病毒属的猪繁殖与呼吸综合征病毒编码的nsp4蛋白也具有类似的蛋白酶切割活性,推测nsp5的蛋白酶活性及对NEMO的切割现象可能在冠状病毒科不同病毒间具有高度的保守性和特异性,这为设计针对不同冠状病毒的广谱性药物或抗病毒抑制剂提供了理论依据[17]。另外,PDCoV的nsp5还可靶向JAK-STAT途径,通过裂解STAT2拮抗IFN受体下游的信号传导[18]。但在PEDV感染的细胞中nsp5是否存在类似的作用机制,仍需要进一步深入研究。
另外,冠状病毒编码的其他非结构蛋白,如nsp14、nsp15和nsp16等也被证实具有拮抗宿主天然免疫的功能。在对SARS-CoV或MHV开展的研究中发现,这些非结构蛋白能够对病毒RNA进行修饰或加工,使病毒mRNA带有和宿主细胞mRNA相似的甲基化帽结构,从而避免被RLRs受体识别而激活天然免疫信号通路[19-23]。PEDV编码的上述非结构蛋白与其他冠状病毒的相关蛋白同源性较高,因此推测其具有相似的结构和功能,但具体的作用机制尚需进一步的试验验证。
3.2 结构蛋白 PEDV S蛋白主要负责病毒吸附和入侵靶细胞,具有良好的免疫原性,对疫苗研究及抗病毒药物开发具有重要意义。Yang等[24]最近的研究表明,S蛋白还可与表皮生长因子受体(epithelial growth factor receptor,EGFR)直接相互作用,诱导EGFR活化,并通过JAK2-STAT3负调控Ⅰ型干扰素的产生,有助于增强和促进PEDV的复制。这与先前在其他病毒研究[25-26]中描述的结果一致。尽管PEDV S蛋白与EGFR的直接结合足以触发EGFR的激活和Ⅰ型IFN活性的减弱,但仍需要进一步的研究来确定导致EGFR和Ⅰ型IFN信号间干扰的潜在机制。
N蛋白是病毒感染细胞中含量最丰富的一个蛋白,在病毒组装、细胞周期调控、细胞凋亡诱导、宿主应激反应等方面发挥着多功能蛋白的作用[27-28]。N蛋白定位在细胞质和细胞核并发挥作用[29]。Cao等[30]阐明了N蛋白介导NF-κB活化的可能机制,发现N蛋白通过TLR2、TLR3、TLR9激活NF-κB,这些TLR的siRNA沉默显著阻断了PEDV诱导的NF-κB活化。Ding等[31]鉴定出了PEDV N蛋白可以抑制仙台病毒诱导的IFN-β产生、ISGs表达,以及IRF3和NF-κB的激活,显著阻碍TBK1或其上游分子RIG-I、MDA5、MAVS和TRAF3刺激的IFN-β启动子的激活。进一步分析发现,PEDV N蛋白通过直接阻断IRF3与TBK1的相互作用拮抗IFN-β的产生。PEDV N蛋白对IFN-β和NF-κB诱导作用的差异,以及其调节天然免疫应答的不同分子机制,表明N蛋白可能与多种宿主信号分子相互作用,参与多种宿主信号通路。
3.3 辅助蛋白 ORF3是PEDV中唯一的辅助蛋白。在PEDV感染的细胞中,ORF3主要分布在细胞质中,少量分布在高尔基体和内质网中。用非洲爪蟾卵母细胞作模型,证实ORF3作为离子通道蛋白发挥作用。通过siRNA使PEDV经典毒株CV777 ORF3基因沉默后,Vero细胞培养病毒滴度显著降低,证明ORF3可以调控病毒复制,与病毒的感染性和致病性有关[32],这与SARS-CoV的ORF3a研究结果一致[33]。尽管其他冠状病毒编码的辅助蛋白,如MERS-CoV的ORF4/5、猫传染性腹膜炎病毒(Feline infections peritonitis virus,FIPV)的ORF7a等被证明具有调节干扰素信号的作用[34-36],但目前只有一项研究表明PEDV 编码的ORF3蛋白在体外能抑制Ⅰ型干扰素的产生,因此,PEDV的ORF3蛋白是否具有潜在的干扰素拮抗作用,有待于进一步验证[8]。另外,在一些适应Vero细胞的毒株中发现,ORF3基因内部截断或氨基酸序列突变[37-38],因此,推测ORF3可能与PEDV的细胞适应性及天然免疫的调节有紧密联系。但由于Vero细胞是干扰素缺陷型细胞,ORF3是否针对宿主天然免疫信号的不同途径或与其他蛋白协同作用以阻断宿主天然免疫应答仍有待验证。
4 总结与展望
冠状病毒是威胁公共卫生安全及养殖业健康发展的重要病原之一。关于冠状病毒逃避宿主天然免疫的分子机制已有诸多报道,但主要集中于对SARS-CoV等人冠状病毒的研究,相比之下,PEDV感染后病毒与宿主的相互作用及病毒逃避免疫监视的分子机制仍有待深入研究。近期也有研究表明,PEDV感染的靶细胞—肠绒毛上皮细胞,在病毒感染后能够选择性地表达Ⅲ型干扰素,因此其在宿主抗PEDV感染中的作用可能更值得进一步深入研究。
PEDV临床分离毒株难以在体外进行培养,目前常用的体外培养细胞,如Vero细胞,与PEDV感染的靶细胞—肠绒毛上皮细胞差异较大,因此,如何建立更适宜的体外评价模型,对于深入探究PEDV的复制机制及逃逸机制、寻找新的药物靶标、开发新型抗病毒药物具有重要的理论及现实意义。
