猪德尔塔冠状病毒SYBR Green Ⅰ实时荧光定量PCR方法的建立及应用
2021-05-20韩知晓孔子荣辛佳亮闭璟珊孙文超胡传活
杜 倩,汪 伟,,韩知晓,孔子荣,辛佳亮,闭璟珊,曹 亮,孙文超,4,胡传活,郑 敏
(1.广西大学动物科学技术学院,南宁530004;2. 广西壮族自治区动物疫病控制中心,南宁530000;3.军事科学院军事兽医研究所,长春130122;4.温州大学病毒学研究所,温州325035)
猪德尔塔冠状病毒(Porcine deltacoronavirus,PDCoV)是冠状病毒科(Coronaviridae)德尔塔冠状病毒属(Deltacoronavirus)成员[1-3],其病毒粒子呈球形或多形性,基因组大小为25.4~ 26.6 kb,包含至少7个开放阅读框[4]。
2012年,Woo等[5]首次从香港地区猪腹泻样品中检测到PDCoV,随后美国、加拿大、泰国和韩国等国家也相继从临床样本中检测到PDCoV[4,6-9]。方谱县等[10]对多个国家和地区的PDCoV基因组序列进行了比对分析,发现不同地区的PDCoV毒株之间核酸同源性较高,表明PDCoV可能具有相同的起源。资料显示,PDCoV对不同日龄、性别和品种的猪均有致病性,对哺乳仔猪的致病性最强,病死率高达30%[11]。此外,PDCoV常与猪流行性腹泻病毒(Porcine epiddmic diarrhea virus,PEDV)和传染性胃肠炎病毒(Porcine transmissible gastrpenteritis virus,TGEV)混合感染,临床上表现为腹泻、呕吐、脱水以及食欲衰退等症状[1,12-14]。临床剖检可见病猪多脏器出现实质性病变,尤其是小肠部位病变最为严重,肠绒毛皱缩、肠壁变薄以及肠腔内存在大量黄色液体[4,10,15]。
为了能更好的了解广西地区PDCoV流行情况和分子遗传变异情况,本研究初步建立了针对PDCoV S基因的SYBR Green Ⅰ实时荧光定量PCR检测方法,并对该方法进行验证和初步应用,结果证明该方法操作简单、灵敏度高、特异性强和重复性好。
1 材料与方法
1.1 病毒和试剂 猪流行性腹泻病毒、传染性胃肠炎病毒的阳性样品由广西壮族自治区动物疫病预防控制中心采集并保存;RNA提取试剂盒购于生工生物工程(上海)股份有限公司;TIANprep Mini Plasmid Kit质粒小提试剂盒、胶回收DNA纯化试剂盒、2×Taq PCR Master Mix购于天根生化科技(北京)有限公司;pMD19-T载体、AMV逆转录试剂盒购于宝生物工程(大连)有限公司;Trans1-T1感受态细胞购自北京全式金生物有限公司。
1.2 引物设计 根据PDCoVS基因序列(GenBank登录号:KY363867.1),利用Primer Premier 5.0软件设计引物,PDS-F:5'-CAATTTTAGCAGCATA CTAACCACCA-3',PDS-R:5'-CATTTTCTCAG CATCAACAACACCAG-3'。扩增目的片段大小为208 bp,引物由吉林库美生物科技有限公司合成。
1.3 病毒RNA提取 按照试剂盒说明从临床样本中提取RNA,并置于-80℃保存备用。
1.4 阳性标准质粒的制备 将所提取的RNA按照AMV反转录试剂盒说明进行cDNA的合成。PCR反应体系(50 μL):2×Taq PCR Master Mix聚合酶25.0 μL,PDS-F/R(10 pmol/μL)各1.0 μL,cDNA 2.0 μL,ddH2O 21 μL。PCR扩增程序:95℃预变性3 min;95℃变性30 s;57℃退火30 s;72℃延伸1 min,共35个循环,72℃延伸5 min,12℃保存。目的片段经胶回收后与pMD19-T载体连接,转入Trans1-T1感受态细胞中,扩大培养后提取质粒,将PCR鉴定为阳性的质粒送吉林库美省库科技公司测序。
1.5 实时荧光定量PCR方法的建立及条件优化
1.5.1 反应体系及条件 选取测序正确的重组质粒,使用紫外分光光度计测定并计算OD260/OD280比值,计算重组质粒的浓度和纯度。取OD260/OD280比值范围在1.8~2.0的重组质粒作为标准质粒,拷贝数浓度为6.26×1010copies/μL,对其进行10倍梯度稀释。取6.26×101~6.26×108copies/μL稀释度的重组质粒作为标准品,通过多次梯度试验,对引物工作浓度、聚合酶工作浓度和延伸温度等条件进行筛选,最终确定反应体系如下:PDS-F/R(10 pmol/mL)各0.5 μL,模板1.0 μL,2×SYBR Green real-time PCR Master Mix 10 μL,ddH2O补足至20 μL。最佳反应条件为:95℃预变性10 min;95℃变性15 s,60℃退火 1 min,40个循环。
1.5.2 荧光定量标准曲线的建立 选取6.26×108、6.26×107、6.26×106、6.26×105、6.26×104、6.26×103、6.26×102、6.26×101copies/μL的重组质粒为模板,利用上述优化的反应体系及条件进行扩增,绘制标准曲线和溶解曲线。
1.6 敏感性试验 将标准质粒10倍倍比稀释作为模板,并设空白对照组,进行SYBR Green Ⅰ实时荧光定量PCR反应,以检测标准质粒的最小拷贝数。
1.7 特异性试验 提取PDCoV、PEDV和TGEV阳性样本的RNA,并反转录成cDNA,以cDNA为模板进行SYBR Green Ⅰ实时荧光定量PCR反应。
1.8 重复性试验 以1 0倍倍比稀释3个梯度(6.26×106~6.26×104copies/μL)的标准质粒为模板,分别进行组间和组内平行试验,重复3次,分析试验的重复性,计算组间和组内的Ct值。
1.9 临床样品的检测 根据试剂盒说明书提取病毒RNA,反转录成cDNA后作为检测模板使用,利用本研究建立的SYBR Green Ⅰ实时荧光定量PCR方法对采集并保存的临床样品进行检测。
2 结果
2.1 重组质粒鉴定 利用设计好的PDCoV特异性引物扩增出目的片段,大小为208 bp,与预期结果相符(图1)。将目的片段克隆到pMD19-T载体构建模板质粒pMD19T-PDCoV,经PCR鉴定正确后进行测序。将测序结果与NCBI公布的PDCoV序列进行比对,同源性为100%。

图1 PDCoV S基因的PCR鉴定结果Fig.1 PCR amplification of PDCoV S gene
2.2 实时荧光定量PCR标准曲线的建立 选取6.26×101~6.26×108copies/μL浓度的重组质粒作为模板进行SYBR Green Ⅰ real-time PCR扩增。结果显示,标准曲线Ct值和重组质粒的拷贝数浓度呈现良好的线性关系,线性函数为y=-4.312x+45.401,R2为0.999(图2)。
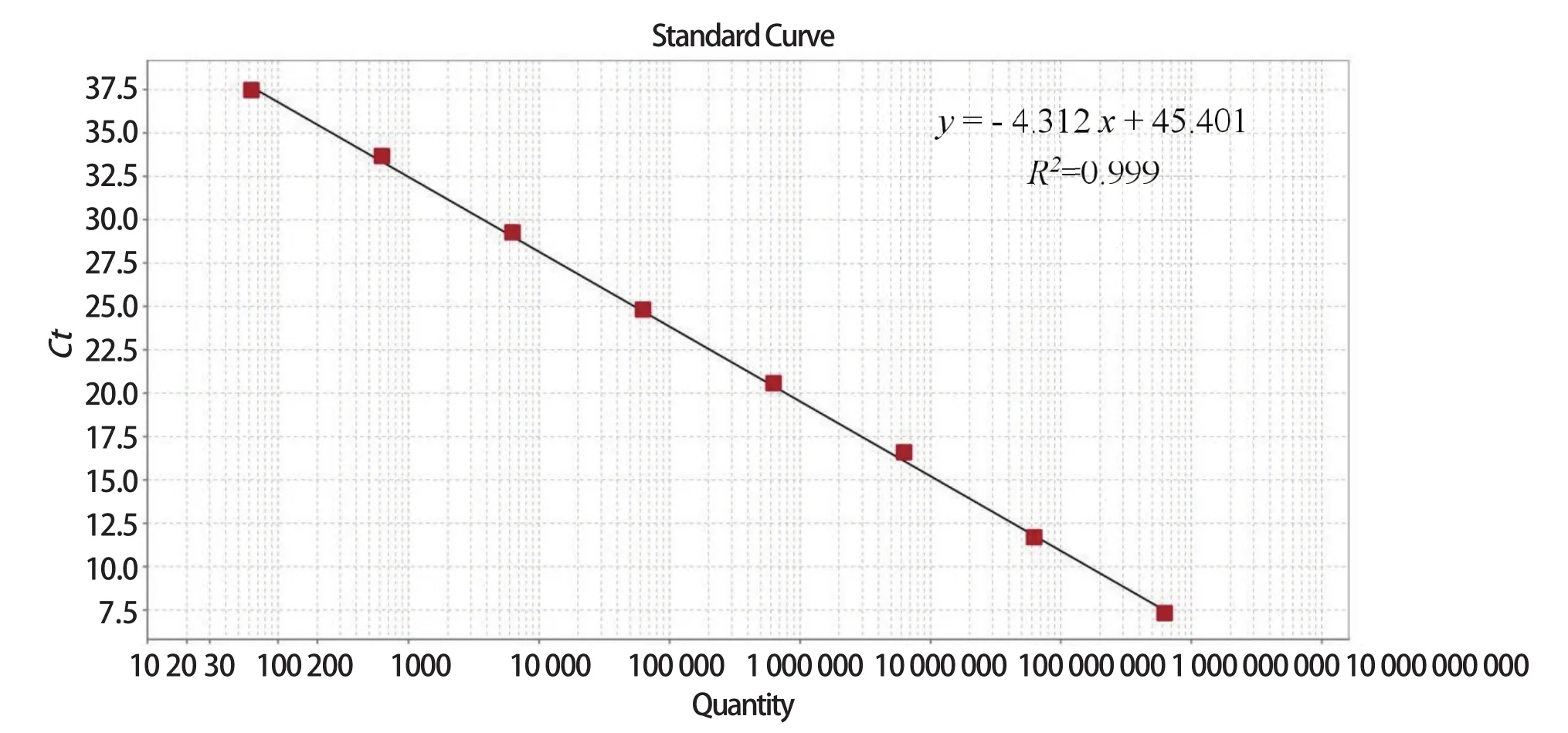
图2 PDCoV S基因SYBR GreenⅠ实时荧光PCR标准曲线Fig.2 Standard curves of PDCoV S genes by SYBR GreenⅠreal- time PCR
2.3 敏感性检测 取6.26×101~6.26×108copies/μL范围内的重组质粒作为模板进行SYBR GreenⅠ实时荧光定量PCR扩增。结果显示,当体系中含有6.26×101copies/μL标准质粒时仍能产生特异性扩增(图3),而阴性对照无特异性扩增。

图3 SYBR GreenⅠ实时荧光定量PCR敏感性分析Fig.3 Sensitivity analysis of the SYBR GreenⅠreal-time PCR
2.4 特异性检测 以PDCoV、PEDV和TGEV的cDNA为模板进行扩增反应,验证方法的特异性。结果显示,PDCoV组出现特异性扩增,而PEDV组和TGEV组未出现特异性扩增(图4)。
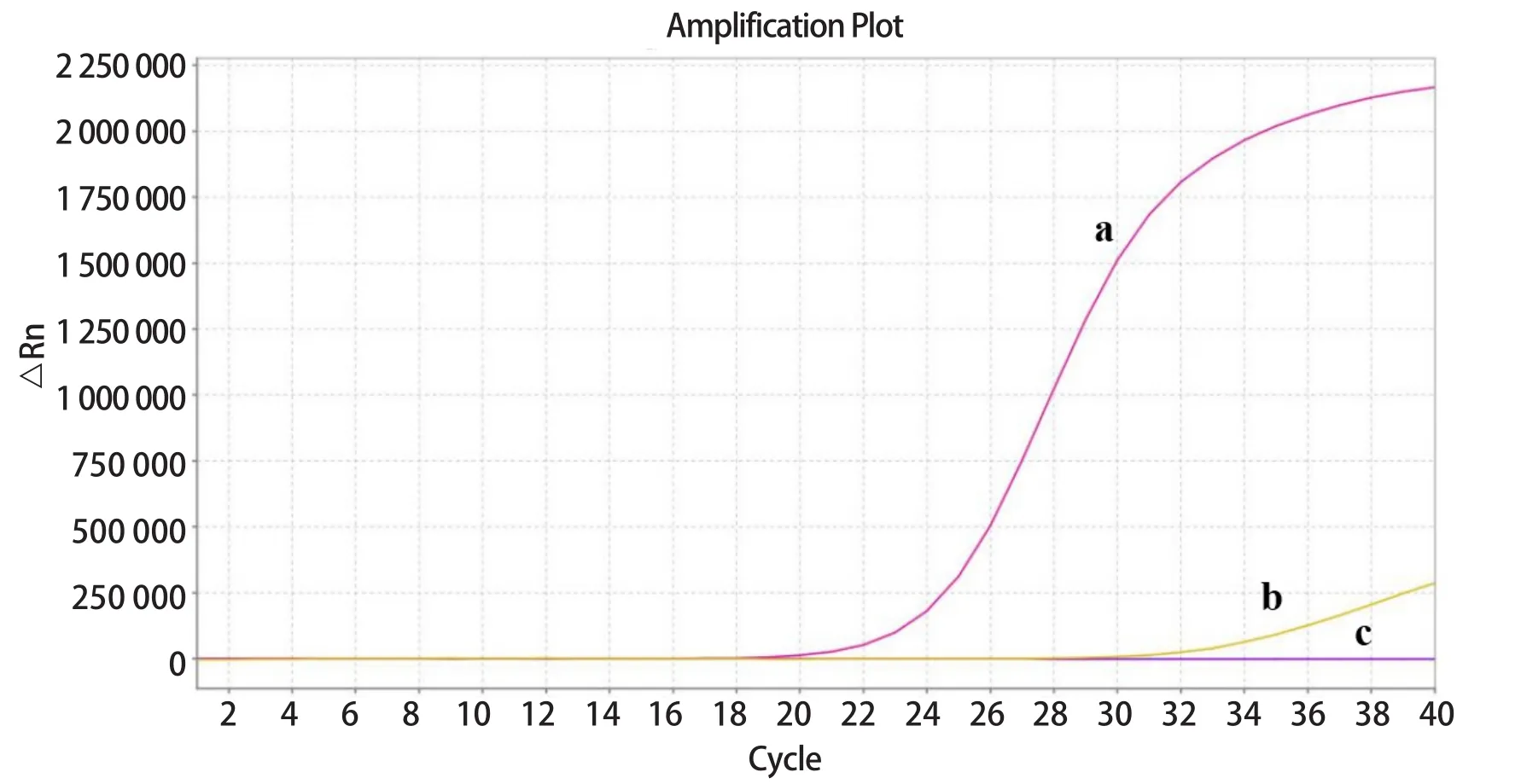
图4 SYBR GreenⅠ荧光定量PCR特异性分析Fig.4 Specific analysis of the SYBR GreenⅠreal-time PCR
2.5 重复性检测 将不同稀释度的标准品进行SYBR GreenⅠ实时荧光定量PCR扩增,对结果进行统计学分析。组间变异系数为0.61%~0.75%,组内变异系数为1.14%~1.23%,表明建立的SYBR GreenⅠ实时荧光定量PCR方法组间和组内都具有良好的重复性(表1)。

表1 PDCoV荧光定量PCR检测重复性试验Table 1 Repeatability assay of PDCoV florescence quantitative real-time PCR
2.6 熔解曲线分析 本试验利用优化的条件进行SYBR GreenⅠ实时荧光定量PCR,在熔解温度为82.6℃处出现单一的溶解峰(图5)。
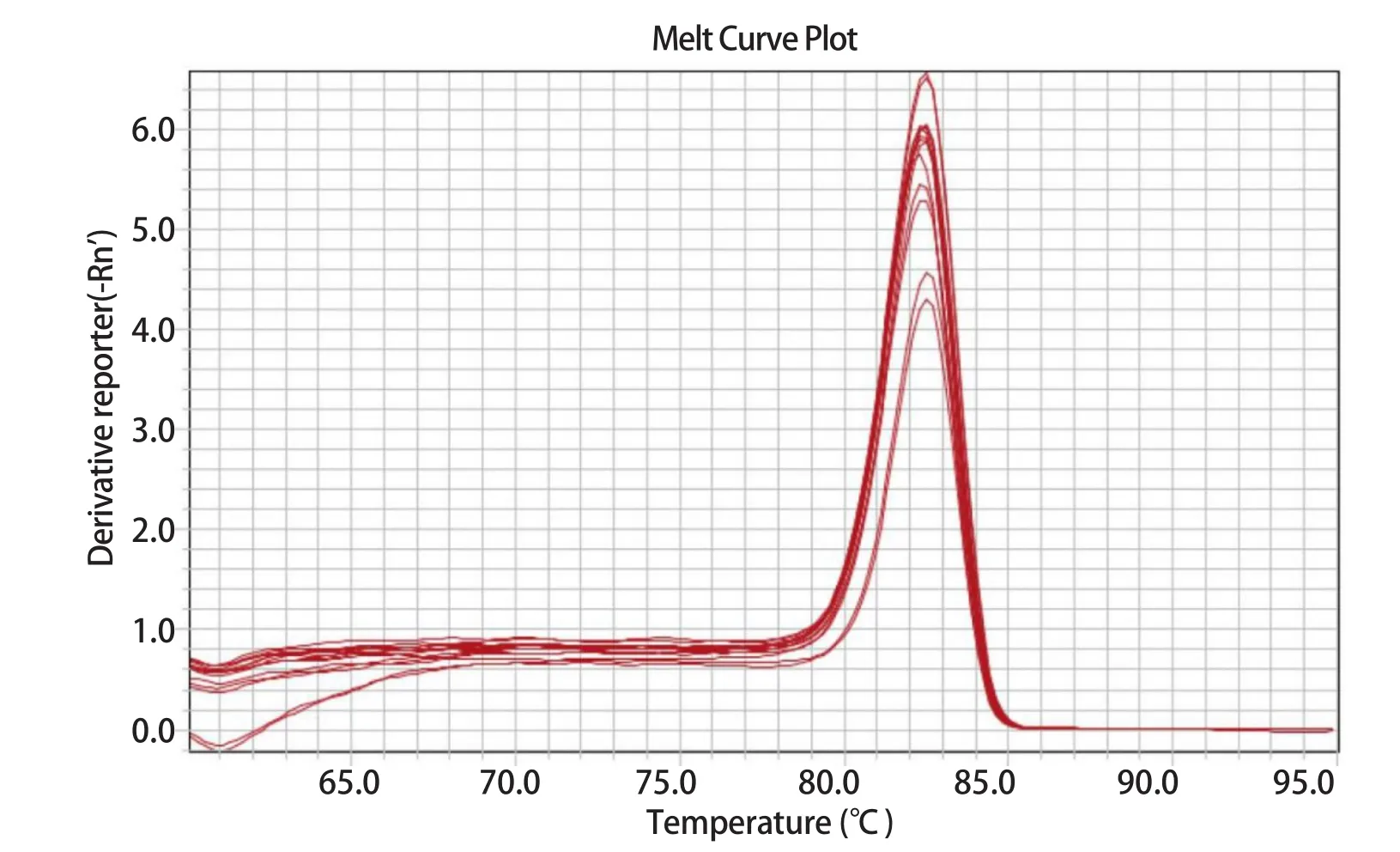
图5 PDCoV S基因 SYBR GreenⅠ实时荧光定量PCR的熔解曲线Fig.5 Melting curve of PDCoV S genes by SYBR Green I real-time PCR
2.7 临床样品检测结果 利用本试验建立的方法,对2017-2018年从广西多个地区采集的43份猪腹泻粪便样品进行检测,2份样品为阳性,阳性率为4.6%(图6)。
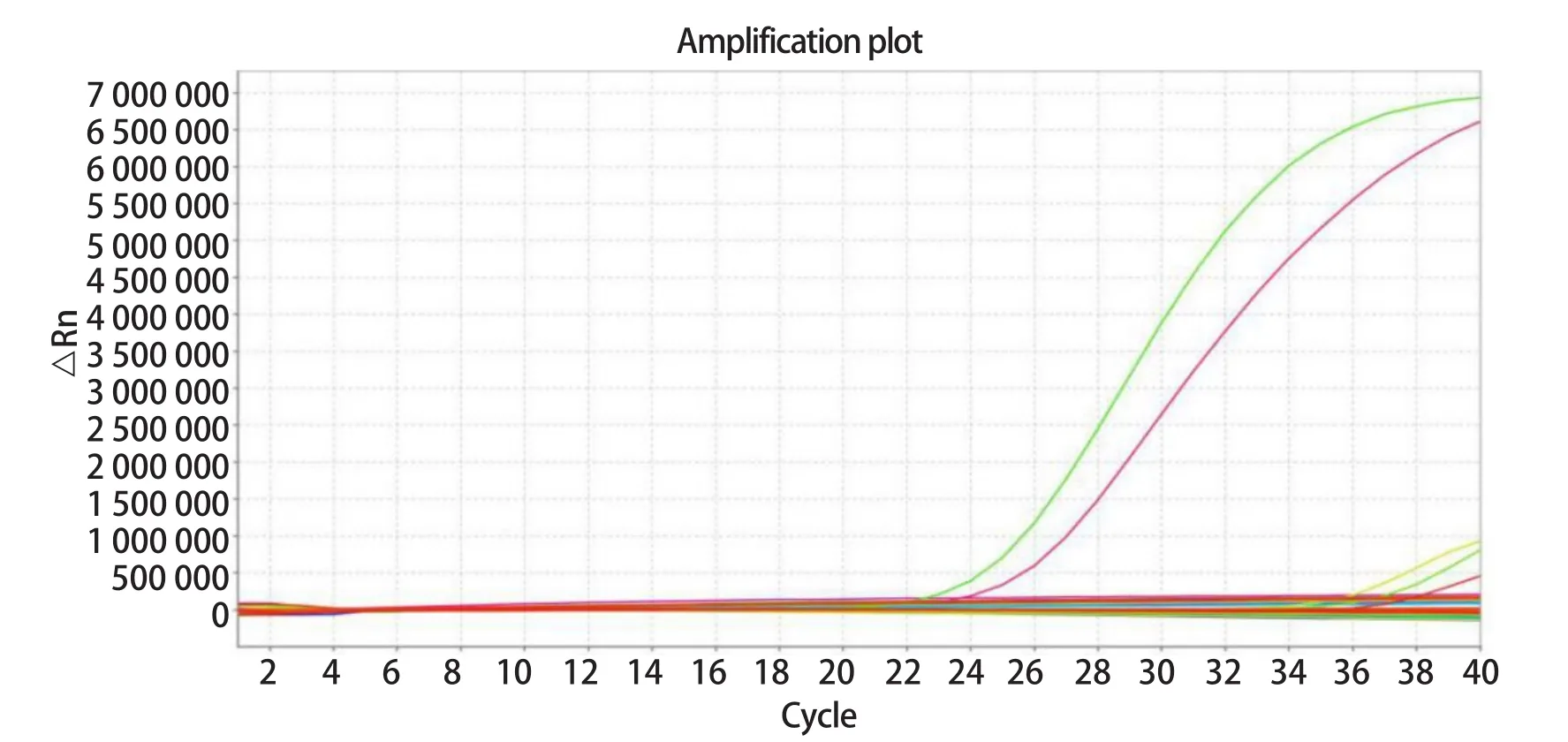
图6 SYBR GreenⅠ实时荧光定量PCR临床样品检测Fig.6 SYBR GreenⅠreal-time PCR clinical sample testing
3 讨论
冠状病毒为单股正链RNA病毒,是目前已知RNA病毒中基因组最大的一类病毒[15]。自2012年,PDCoV首次在香港被发现,至今已在世界范围内广泛传播,严重影响各国养猪行业的发展。美国猪腹泻样品的PDCoV感染率为30%[7],PDCoV在我国江苏省、安徽省、广东省、河南省、广西壮族自治区等地区的猪场中同样存广泛在。对腹泻猪的粪便和肠道样本的检查结果显示,PDCoV感染率高达31.33%[16-17]。由于PDCoV在病理变化、流行病学和临床症状上与PEDV和TGEV都极其相似[18],所以需要借助核酸或血清学检测手段方能对其进行准确的鉴别诊断。目前针对PDCoV病原的检测包括常规RT-PCR、巢式PCR、免疫组织化学分析以及ELISA等[19-21],这些方法存在灵敏度和特异性差,且无法准确分辨病毒种类的缺点。同时,上述诊断方法还存在实际操作费时、工作量大以及样品容易污染等问题。和上述检测方法相比,SYBR GreenⅠ荧光定量PCR方法不仅具有操作简便、成本低、可避免污染及进行定量分析等优点,该方法还可对试验过程进行实时动态连续检测,快速完成诊断任务。虽然目前针对PDCoV已存在相应的SYBR GreenⅠ荧光定量PCR方法,但大多是针对PDCoV M和N基因的保守序列所设计的,这些检测方法的普遍性和适用性还有待考证。因此针对检测PDCoV不同保守基因来建立相应的检测方法,对于补充PDCoV检测技术的普遍性和适用性是十分必要的。
本研究针对PDCoV的S基因,建立了一种简单、方便、准确的SYBR GreenⅠreal-time PCR检测方法。此方法的敏感度可达到6.26×101copies/μL;重复性良好,组内变异系数为0.61%~0.75 %,组间变异系数为1.14 %~1.23%。对PEDV和TGEV均无特异性扩增,证明该方法特异性良好。运用本研究建立的方法对43份临床样品进行检测,阳性率为4.6%。结果表明,本研究成功建立了对PDCoV S基因的SYBR GreenⅠreal-time PCR检测方法,为今后了解国内猪群中PDCoV流行情况及猪冠状病毒相关疫苗研究提供了科学依据。
