沙门菌中GcvB sRNA可调控aphA mRNA
2021-05-20段世宇
杨 阳 ,曹 伟 ,潘 永 ,段世宇 ,杨 琦 ,4
(1.贵州大学动物科学学院,贵阳550025;2.贵州大学动物疫病研究所,贵阳550025;3.巴彦淖尔市兽医事业管理局,巴彦淖尔015000;4.贵州省动物疫病研究室,贵阳550025)
沙门菌(Salmonella)是一种严重危害人类与动物健康的革兰氏阴性菌,能够导致人与动物发生肠炎、食物中毒、败血症等一系列粘膜免疫反应疾病,还可造成母畜流产、死亡,在中国所发生的食物中毒原因中有70%~80%由沙门菌引起。沙门菌对我国动物福利和公共卫生问题有着巨大的影响[1-4]。在沙门菌中,aphA基因可编码蛋白B类酸性磷酸酶(class B acid phosphatase/phosphotransferase),这类酶的主要生理功能包括:催化和水解多种磷酸底物,催化低能量的磷酸集团从磷酸单酯向羟基集团的转移[5]。在细菌中,磷酸集团的转移是细菌能量代谢的主要途径之一,若破坏磷酸集团的催化,细菌的生理活动将受到重要影响,细菌的生存和定植能力均会降低。
非编码的小RNA(noncoding small RNA,sRNA)是细菌中基因表达的主要转录后调节因子,大小为30~500 nt,是一类可进行转录而不翻译为蛋白质的RNA分子,sRNA可通过与特定的mRNA靶标结合而对细菌功能作出调节。沙门菌中所存在的sRNA是革兰氏阴性细菌中与伴侣蛋白Hfq(保守的RNA分子伴侣蛋白RNA-binding protein Hfq)相关性最高的小RNA之一,能与伴侣蛋白Hfq共同作用于细菌各种细胞功能如:生长增殖、糖转运、压力应答、营养物质吸收、毒性毒力和环境应激等生命活动并产生一定的影响[6-9]。GcvB sRNA是沙门菌中1个极保守、长度为200个核苷酸的小RNA,具有广泛且重要的调节能力,可调控沙门菌中约1%~2%的mRNA,多为氨基酸与短多肽的转移蛋白,包括了ABC转移蛋白家族中的Dpp蛋白和Opp蛋白[10]。目前研究可知,GcvB有3个调控区域,分别为:位于茎环SL1和SL2之间一个29 nt长的G/U丰富的单链序列的R1区域、位于茎环SL3和SL4之间序列为ACUUCCUGUA的R2区域及位于茎环SL4上的R3区域[11-12]。
lacZ能够通过aphA的起始密码子ATG进行翻译,表达β-半乳糖苷酶[13],本研究通过构建aphA与lacZ的融合基因ΔaphA::lacZ,并以其为对照检测缺失GcvB后,aphA相对转录量与β-半乳糖苷酶活性差异变化,研究GcvB对aphAmRNA水平与蛋白水平的调控作用,以期为sRNA的后续研究与沙门菌防治提供一定的理论基础。
1 材料与方法
1.1 试验菌株及试剂 鼠伤寒沙门菌标准株LT2(wild type,wt)和鼠伤寒沙门菌gcvB基因缺失株(基因型ΔgcvB::cat)(人为构建所得[14])均由法国国家科学研究中心(Centre national de la recherche scientique,CNRS)分子遗传学Bossi实验室馈赠;鼠伤寒沙门菌GcvB R1基因缺失株(基因型ΔgcvBR1::cat)、鼠伤寒沙门菌GcvB R2基因缺失株(基因型ΔgcvBR2::cat)和鼠伤寒沙门菌GcvB R3基因缺失株(基因型ΔgcvBR3::cat)均由本实验室构建所得。
质粒pKD46(λ red同源重组质粒,携带氨苄抗性基因)、质粒pCP21(flp重组酶,可识别frt位点)、质粒pCE40(携带frt位点与lacZ基因,但lacZ无启动子)、质粒pKD13(携带frt位点,携带有卡那霉素抗性基因)和P22噬菌体均由CNRS分子遗传学Bossi实验室馈赠。
细菌DNA提取试剂盒购自天根生化科技有限公司;PrimeScript RT reagent Kit with gDNA Eraser、SYBR Premix ExTaqⅡ购自TaKaRa公司;pfu和TaqDNA聚合酶、ONPG购自北京索莱宝科技有限公司;QIAquick PCR Purification Kit(50)购自生工生物工程(上海)有限公司;其他试剂均为分析纯。抗生素浓度:氨苄西林100 mg/mL、氯霉素 20 mg/mL、卡那霉素 50 mg/mL。
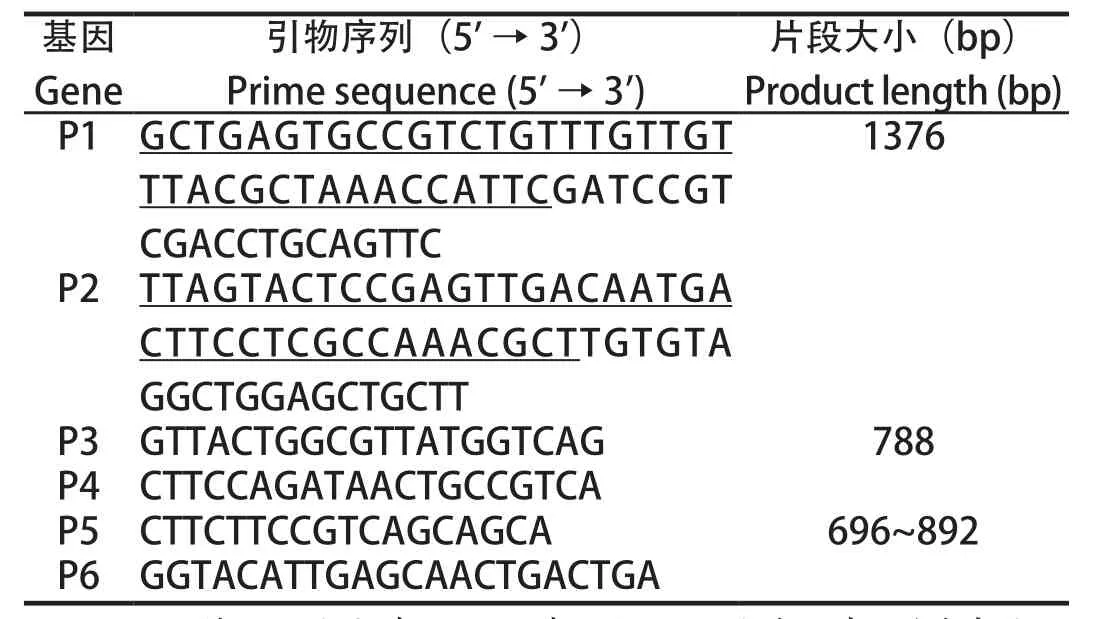
表1 本研究所用引物Table 1 Primers used in this study
1.2 电转化 以质粒pKD13作为模板,使用引物P1/P2进行PCR,扩增体系为:pKD13(1∶20)10 μL,缓冲液8 μL、ddH2O 57 μL,上、下游引物各1 μL,dNTPS Mix(2.5 mmol/L each)2 μL,Taq酶和pfu酶混合物(3∶1)1 μL;反应程序为:95℃变性10 s,53~60℃退火30 s,72℃延伸90 s,共30个循环。反应结束后,进行琼脂糖凝胶电泳检测,胶回收并纯化扩增产物。
感受态细菌的构建:将700 μL过夜菌株置于70 mL LBA中,加入L-阿拉伯糖培养菌株7455 OD600值为0.4~0.6。取菌液35 mL置于离心管中,离心后弃上清液。沉淀中加入35 mL的10%甘油,混匀后离心并弃上清液,沉淀中加入17.5 mL的10%甘油进行悬浮,再次离心后弃上清液。沉淀中加入9 mL的10%甘油,混匀后离心并弃上清液,沉淀中加入200 μL的10%甘油进行悬浮。
电转化:取50 μL感受态细菌与5 μL纯胶回收产物(或质粒)在冰上混匀后转入电转杯中,以时间常数T为6.0、电压为2.5进行电击后,迅速在电转杯中加入1 mL SOC,摇晃孵育1 h后,取100 μL电转产物涂至LB卡那抗性平板,37℃培养过夜。次日挑取单克隆菌落进行纯化培养,获得转化后的菌株。
通过以上方法,先将使用P1/P2引物扩增所得的目的片段转入7455菌株中,通过卡那抗性平板筛选获得菌株7455-aphA。再将pCP21质粒转到7455-aphA菌株中,通过LBA培养基培养获得菌株aphA-pCP21。将质粒pCE40转入菌株aphA-pCP21,通过抗性平板筛选既具有卡那抗性,同时又在麦康凯平板上呈红色的鼠伤寒沙门菌株LT2ΔaphA::lacZ,通过PCR与测序验证正确后,将其命名为ΔaphA::lacZ。
1.3 转导 抽取0.3 mL过夜培养的供体菌菌液加入到2.3 mL P22噬菌体broth中培养8 h后,离心取上清液,加入少量CHCl3灭菌,获得裂解液。
吸取100 μL过夜培养的受体菌菌液与50 μL供体菌裂解液(1∶50)混匀,在相应温度的环境中孵育后,涂布于相应的选择培养基上进行纯化培养,通过PCR进行验证。
将LT2ΔaphA::lacZ作为供体菌,通过以上方式将ΔaphA::lacZ区域分别转入鼠伤寒沙门菌GcvB基因缺失株(基因型ΔgcvB::cat)、鼠伤寒沙门菌GcvB R1基因缺失株(基因型ΔgcvB R1::cat)、鼠伤寒沙门菌GcvB R2基因缺失株(基因型ΔgcvB R2::cat)、鼠伤寒沙门菌GcvB R3基因缺失株(基因型ΔgcvB R3::cat)中,通过抗性平板(cat)进行筛选,分别获得LT2ΔaphAΔgcvB::cat、LT2ΔaphA△R1::cat、LT2ΔaphA△R2::cat、LT2ΔaphA△R3::cat菌株。
1.4 β-半乳糖核苷酸实验 对构建的菌株进行β-半乳糖核苷酸实验:将待测菌株置于相应的环境中过夜培养,次日取100 μL过夜菌液培养至OD600值为0.3~0.5,取0.1 mL菌液置于试管中,以Z buffer定容至1 mL,使用巴斯德吸管加入1滴甲苯,立即旋转振荡30 s,置于42℃摇床中振荡培养2 h,再置于28℃水浴锅中孵育5 min。在试管中加入0.2 mL ONPG(4 mg/mL)反应,记录加入时间(start time,t0)。当试管中出现黄色,加入0.1 mL 1 mol/L Na2CO3终止反应,记录终止时间(finish time,tf)。将试管中液体离心后取上清液1 mL置于比色皿中,以Z buffer作为空白对照,测OD420,记录数值。
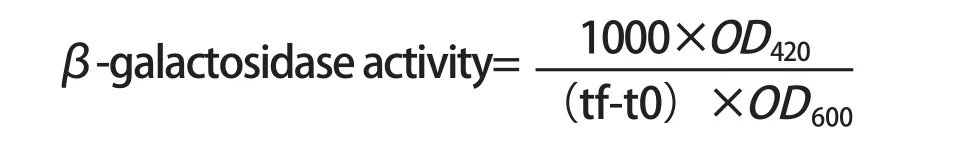
1.5 qPCR试验 根据DNA提取试剂盒说明书提取DNA,并以此为模板进行PCR扩增,扩增体系为:上、下游引物各1 μL,2×Taq DNA Master Mix 12.5 μL,ddH2O 6.5 μL,DNA模板4 μL。扩增条件为:95℃预变性30 min;95℃变性5 s,60℃退火30 s,共35个循环。
将提取的相应菌株的总RNA样本反转录为cDNA后作为模板,参考SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒说明进行两步法反应。扩增条件为:95℃预变性30s;95℃变性5s,60℃退火30s,共39个循环,每个样本3个重复。对样本数据采用2-ΔΔCt法计算相关基因mRNA的转录水平,即Fold change。
2 结果
2.1 转化构建菌株结果 以拟LT2ΔaphA::lacZ作为模板,采用特异性引物P3/P4对aphA基因进行扩增,将胶回收产物送测序。通过测序结果的峰图与序列,确定成功构建了沙门菌菌株LT2ΔaphA::lacZ(图1),lacZ的序列从aphA的ATG开始39个碱基后进行替换,采用aphA ATP进行β-半乳糖甘酶蛋白的翻译表达。

图1 LacZ替换aphA部分Fig.1 LacZ replaces the aphA section
2.2 转导构建结果 以LT2ΔaphAΔgcvB::cat、LT2ΔaphA△R1::cat、LT2ΔaphA△R2::cat、LT2ΔaphA△R3::cat为模版,使用特异性引物P3/P4进行lacZ片段的扩增,使用特异性引物P5/P6对GcvB片段进行扩增。由琼脂糖凝胶电泳结果可知,PCR扩增出了相应目的片段,确认成功构建出相应的沙门菌缺失菌株。
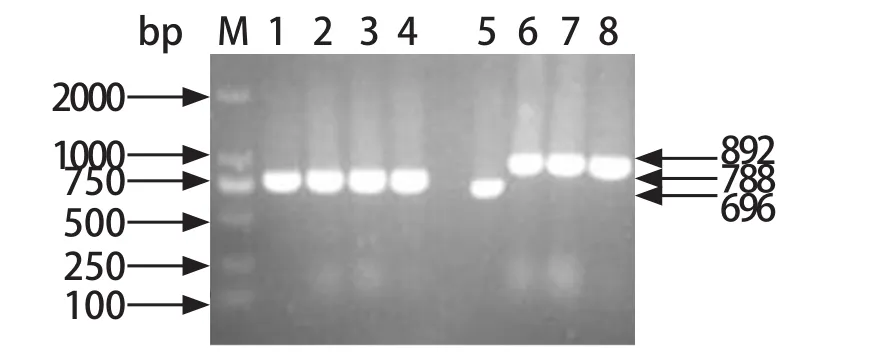
图2 PCR扩增电泳图Fig.2 PCR results
2.3 β-半乳糖苷酶(lacZ)酶活性测定 将菌株LT2ΔaphA::lacZ、LT2ΔaphAΔgcvB::cat、LT2ΔaphAΔR1::cat、LT2ΔaphAΔR2::cat、LT2ΔaphAΔR3::cat进行β-半乳糖苷酶(lacZ)酶活性测定试验,结果见图3。以ΔaphA::lacZ作为对照组(100%),试验菌株β-半乳糖苷酶酶活均有所增加,分别为:LT2ΔaphAΔgcvB::cat(145.53%),LT2ΔaphAΔR1::cat(244.47%)、L T 2 Δa p h AΔ R 2::c a t(2 3 0.6 7%)、L T 2 Δa p h AΔ R 3::c a t(3 0 5.0 6%),除LT2ΔaphAΔgcvB::cat(145.53%)外,其余菌株变化均显著。而相对于GcvB全缺失菌株LT2ΔaphAΔgcvB::cat,GcvB单一区域缺失的菌株LT2ΔaphAΔR1::cat、LT2ΔaphAΔR2::cat、LT2ΔaphAΔR3::cat变化均显著。
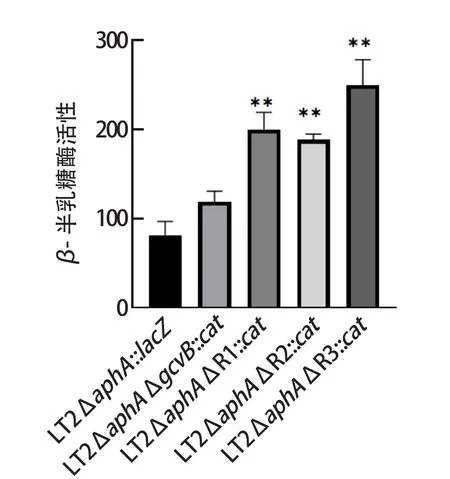
图3 β-半乳糖苷酶酶活测定结果Fig.3 Determination of β-galactosidase enzyme activity
2.4 缺失部分对aphA转录水平的影响 以菌株wt、LT2ΔgcvB::cat、LT2△R1::cat、LT2△R2::cat、LT2△R3::cat作为模版,提取相应菌株的RNA,以特异性引物进行qPCR,结果见图4。将wt(即沙门菌标准株LT2)作为对照组(100%),试验菌株中的a p h A均有所下调,分别为:LT2ΔgcvB::cat(48.17%)、LT2ΔgcvB R1::cat(22.93%)、LT2ΔgcvB R2::cat(22.94%)、LT2ΔgcvB R3::cat(22.17%)。相对于全缺失GcvB菌株LT2ΔgcvB::cat,GcvB单一区域缺失的菌株LT2ΔaphAΔR1::cat、LT2ΔaphAΔR2::cat、LT2ΔaphAΔR3::cat变化极显著。
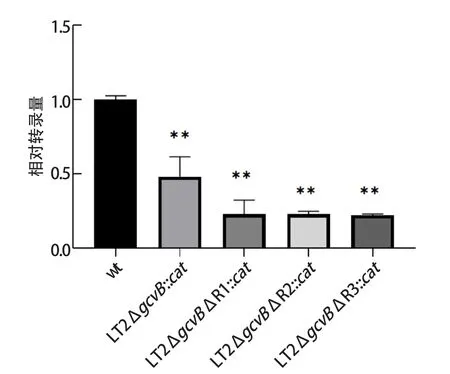
图4 不同缺失后的STM4351相对转录量Fig.4 The relative transcription of STM4351 after di ff erent deleted
3 讨论
在当前,关于sRNA调控的研究大多为大通量的分析或调控因子的研究,而根据sRNA调控的方式,以单个基因作为目标进行分子水平研究,能使调控机理的研究更为深入具体。在革兰氏阴性菌中,sRNA能与伴侣蛋白Hfq协同作用,将通过与靶mRNA的5'非翻译区(5' UTR)进行不完全互补序列的碱基配对而发挥作用[15]。而sRNA对靶mRNA的调控机制主要为偶联降解、催化降解、闭塞、激活[16]。在偶联降解中sRNA与mRNA进行碱基配对后,sRNA与靶mRNA都被降解,mRNA的水平就出现下降的情况;而催化降解中,sRNA只是起催化作用,靶mRNA会被降解而sRNA则不被降解;激活则如哈维弧菌和霍乱弧菌显示aphA mRNA受到了群体调控小RNA(Qrr sRNA)的调控,aphA mRNA约200 nt长的5' UTR会自发形成掩盖其核糖体结合位点的抑制性结构,不能进行B类酸性磷酸酶翻译,而Qrr sRNAs可以通过伴侣蛋白Hfq辅助碱基配对与aphA mRNA的5' UTR直接进行碱基配对,打开抑制性结构,暴露核糖体结合位点,与核糖体进行结合,从而激活aphA的产生[17-18]。在沙门菌中,翻译会从形成由30S核糖体亚基组成的起始复合物开始,该复合物与mRNA的核糖体结合位点起始因子结合起来,随后结合50S核糖体,形成具有翻译活性的70S核糖体复合物。GcvB sRNA在大多数情况下,与靶基因的5' UTR进行不完全的互补序列,碱基配对干扰了30S核糖体亚基的结合,从而阻断翻译起始,达成对目的基因调控[19]。
如果sRNA缺失后,靶基因所翻译的蛋白,即β-半乳糖苷酶活性出现显著性变化时,会认为sRNA能对靶基因产生调控作用。本研究以沙门菌标准株LT2作为对照组,当GcvB sRNA缺失后,aphA ATG起始的β-半乳糖苷酶活性却没有出现显著性变化,在mRNA水平上,aphA的转录量却出现一定的下降。那么GcvB似乎并不能够对aphA进行调控,但有与aphA mRNA进行结合的可能。将目前GcvB进行调控的R1、R2、R3单区分别缺失后,aphA转录水平出现了降低,β-半乳糖苷酶活性上升了230%~305%。GcvB R1、R2、R3缺失显示出了对aphA的调控作用。针对这种现象,推测GcvB中可能存在调控aphA的区域,在通常情况下R1、R2、R3会联合抑制其对aphA的调控,而缺失某一片段后,抑制作用消失,呈现了对aphA的调控作用;也可能是因为aphA参与了沙门菌的群体感应,GcvB能抑制或激活细菌相关基因的表达,维持细菌的稳定,当其缺失导致细菌生长环境发生变化,aphA转录量也出现了变化,而R1、R2、R3缺失能使反馈到GcvB的信号不发生作用,导致aphA表达量发生变化。本研究确定了GcvB与aphA的表达有一定的联系,为进一步阐述GcvB在STM LT2中的调控机制奠定了基础,但其具体的机制还需进一步研究。
在鼠伤寒沙门菌野生型菌株LT2中,完整的GcvB能影响aphA的mRNA转录量,而当GcvB sRNA中R1、R2、R3缺失后能够对aphA有抑制作用。本研究为沙门菌中的sRNA后续研究及沙门菌的防治奠定了一定基础。
