杀鲑气单胞菌对鲟的杂交致病性及病理变化分析
2021-05-20胡安东潘吉脉刘妍罕曾茂芹程振涛姜海波
张 飘,杨 霞,胡安东,潘吉脉,刘妍罕,曾茂芹,程振涛,3,姜海波,3,文 明,3
(1.贵州大学动物科学学院,贵阳 550025;2.贵州大学动物疫病研究所,贵阳 550025;3.贵州省动物疫病与兽医公共卫生重点实验室,贵阳 550025)
鲟鱼起源于2亿年前的古老硬骨鱼类,属于硬骨鱼纲(Osteicthyes)、辐鳍亚纲(Actinopterygii)、硬鳞总目(Chondrostei)、鲟形目(Acipenseriormes)全世界共有2科6属27种,我国分布有8种[1-2]。鲟鱼是世界上现存起源最早的脊椎动物之一,是体型最大的软骨硬鳞类淡水鱼[3]。鲟鱼肉中的含水量与脂肪含量高于大部分淡水鱼,因其做成的鱼子酱非常美味,目前鲟鱼产业以鱼子酱加工为主,具有重要的经济价值[4]。杂交鲟在鲟鱼产业中占有极其重要的比例[5],又表现出优良的生长和抗病性能[6],因此近几年杂交鲟在冷水养殖中占据的比例越来越高,极具研究价值。病理变化分析可以客观反应机体生理过程,为鱼类疾病发生过程及引起的主要损伤提供依据,但目前关于杂交鲟鱼病理变化的分析报道却相对较少。
杀鲑气单胞菌是一种嗜冷无动力的气单胞菌,广泛分布于淡水与海水环境中,杀鲑气单胞菌(Aeromonas salmonicida)属气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas),是一种不能运动、兼性厌氧的革兰氏阴性菌, 其最适生长温度为22℃~25℃,35℃以上不生长,为一种条件致病菌,是主要引起疖疮病的病原菌,曾经给全球水产养殖业造成了巨大的困扰[7]。本实验室曾经接收到疑似感染杀鲑气单胞菌而发病的杂交鲟,但均未分离到可以引起该症状的相关细菌,也未分离到杀鲑气单胞菌。目前国内外并没有关于杀鲑气单胞菌感染鲟鱼的相关报道,基于这种情况,本研究采用同为冷水鱼的虹鳟鱼体内分离得到的杀鲑气单胞菌对杂交鲟进行人工感染,感染后观察杀鲑气单胞菌对杂交鲟是否有感染性并对其临床症状、解剖学变化、病理变化情况进行初步探究,旨在为鲟鱼疖疮病诊断提供一些有效的数据支持。
1 材料与方法
1.1 实验材料 人工感染使用的杀鲑气单胞菌于2019年7月分离于贵州省某养殖场发病虹鳟鱼体内,由贵州大学动物科学疫病研究所保存;杂交鲟【史士鲟(Acipenser schrenckii)♀×西伯利亚鲟(Acipenser baeri)♂】共60尾,购自贵州大学动物科学学院水产研究所,体长55±5cm,体重0.8±0.1 kg;脑兴浸出液(brain heart infusion broth,BHI)肉汤培养基、病理切片材料均购自赛维尔生物科技有限公司。
1.2 实验菌种 将菌种从-80℃中取出,待其中冰块融化后,于操净工作台中加入已经配制好并灭菌的BHI液体培养基中,放置于28℃恒温摇床中培养过夜。采用麦氏比浊法,将杀鲑气单胞菌的菌悬液浓度调整到约1×109CFU/mL,并将其浓度依次倍比稀释为1×108、1×107、1×106、1×105CFU/mL备用。
1.3 半数致死量(median lethal dose,LD50)的测定 实验所用杂交鲟均为同一体系,大小与健康情况基本相同。实验前鱼缸中驯养7 d,让其适应环境,减小由于应激带来的影响,实验前停食1 d,每天更换1/3水量,实验过程中不喂食。50尾杂交鲟随机分成5组,每组10尾。分别臀鳍注射0.1 mL不同浓度杀鲑气单胞菌,间隔12 h观察1次杂交鲟活动状态及死亡情况,直到不再出现杂交鲟死亡,对死亡杂交鲟无菌采取肝脏组织后进行杀鲑气单胞菌的16S rDNA 和毒力基因的PCR扩增检测。其中,气溶素(aerolysin,Aer)、丝氨酸蛋白酶(serine protease,Ser)、热不稳定性肠毒素(heat-labile enterotoxins,Alt)、酯酶(lipase,Lip)、细胞毒性肠毒素(cytotoxic enterotoxin,Act)、溶血素(haemolysin A,hly A)PCR引物信息与退火温度参照文献[8]进行,16S rDNA PCR鉴定后送往生工生物工程(上海)有限公司进行测序,测序结果上传NCBI进行比对,确定其死亡原因。根据改良寇氏法(LD50(lg(LD50)= Xm-d(∑Pi-0.5));其中:Xm为最大剂量对数;d为相邻两组剂量对数之差数;Pi为死亡率,i为组号)计算臀鳍注射半数致死量。
1.4 样品的采集 与半数致死量测定分组相同条件,选取10尾杂交鲟分为2组,正常对照组5尾,人工感染组5尾,人工感染组均注射相同浓度半数致死量以下的菌液0.2 mL,对照组均注射同等体积的灭菌生理盐水,在96 h宰杀实验组5尾作为生物学重复。观察杂交鲟体表及体内各组织器官病理变化后,取肠、肝脏、肌肉、心脏、鳃和脾脏放置于组织固定液中,24 h后用70%酒精冲洗并保存备用。
1.5 人工感染前后的组织变化 将70%酒精中保存的病理组织和健康组织,经酒精梯度脱水,二甲苯透明,石蜡包埋,组织切片,苏木精和伊红(hematoxylin-eosin staining,HE)染色,中性树胶封片后,送赛维尔生物科技有限公司做全景扫描。
2 结果
2.1 半数致死量及PCR结果 将不同浓度的杀鲑气单胞菌菌液臀鳍注射到健康杂交鲟体内,在感染24 h 后,注射菌液浓度为1.0×109CFU/mL和1.0×108CFU/mL两组鱼开始出死亡,感染168 h后菌液浓度为1.0×109CFU/mL组死亡率达100%(表1)。经改良寇氏法计算臀鳍注射半数致死量为7.9×106CFU/mL,这表明杀鲑气单胞菌对杂交鲟有致病及致死性,会引起杂交鲟发病及死亡。从感染发病死亡杂交鲟体内无菌采集肝脏组织进行16S rDNA与毒力基因检测PCR(图1),并进行测序分析,测序结果上传NCBI比对显示为杀鲑气单胞菌,因此认定杀鲑气单胞菌可以引起杂交鲟的死亡,毒力基因检测发现杀鲑气单胞菌存在Aer、Ser、Alt、Act、HlyA等毒力基因。
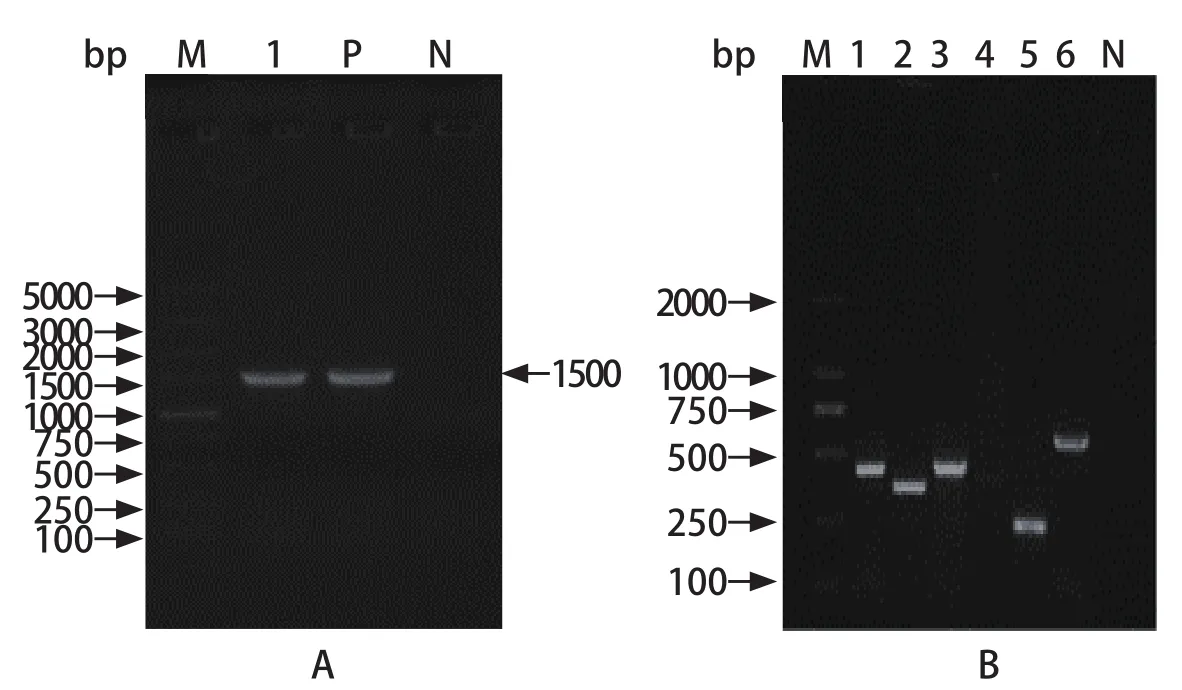
图1 杀鲑气单胞菌 16S rDNA (A)、毒力基因序列(B)的PCR扩增Fig.1 PCR amplification of 16S rDNA (A) and virulence gene sequences (B) of Aeromonas salmonicida
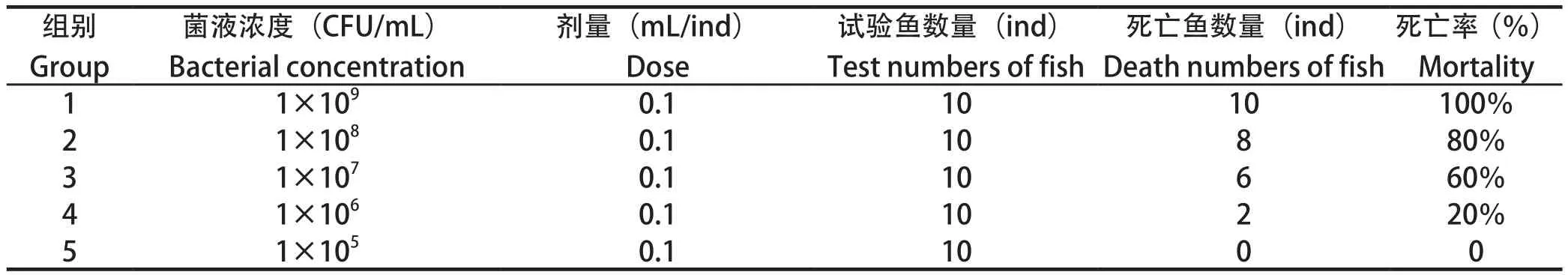
表1 人工感染感染杂交鲟LD50Table 1 Artificial infection of hybrid sturgeon LD50
2.2 人工感染后临床症状 对杂交鲟腹腔注射0.1 mL杀鲑气单胞菌,浓度为1.0×109CFU/mL和1.0×108CFU/mL。两组在12 h前,鱼沉于鱼缸底部或吸附缸壁,无其他症状,12 h后部分鱼表现出发狂,撞击缸壁,24 h后出现死亡,而低浓度组未出现发狂症状,主要表现为反应迟钝,用手触摸不反应。对发病杂交鲟饲养水体进行观察,主要表现:体表黏液分泌量增多,表现为水体比正常对照组粘稠浑浊,且注射菌液组浓度越高变化越明显。
对发病杂交鲟体表进行观察,主要表现:腹壁出现大量出血点,腹壁两侧或尾部形成脓肿,严重的出现溃疡灶,发生坏死(图2A、2B),其他部位未见有明显病变,出血点主要集中在背鳍、胸鳍与腹鳍基部,肛门处有出血与红肿,少数带有血便(图2C);溃疡灶主要集中在腹鳍周围(图2D),鳃丝出现大量出血点,鳃盖未见异常(图2E)。对发病杂交鲟刨解观察,腹腔未见积液,但两侧腹壁与脂肪组织有出血点,脂肪组织严重的出现溃疡坏死(图2F);肝脏组织颜色发白,而且伴有大量出血点(图2G);脾脏肿大变脆并伴有出血点(图2H);肠壁有出血点,肠道未见内容物及胀气现象(图2I)。
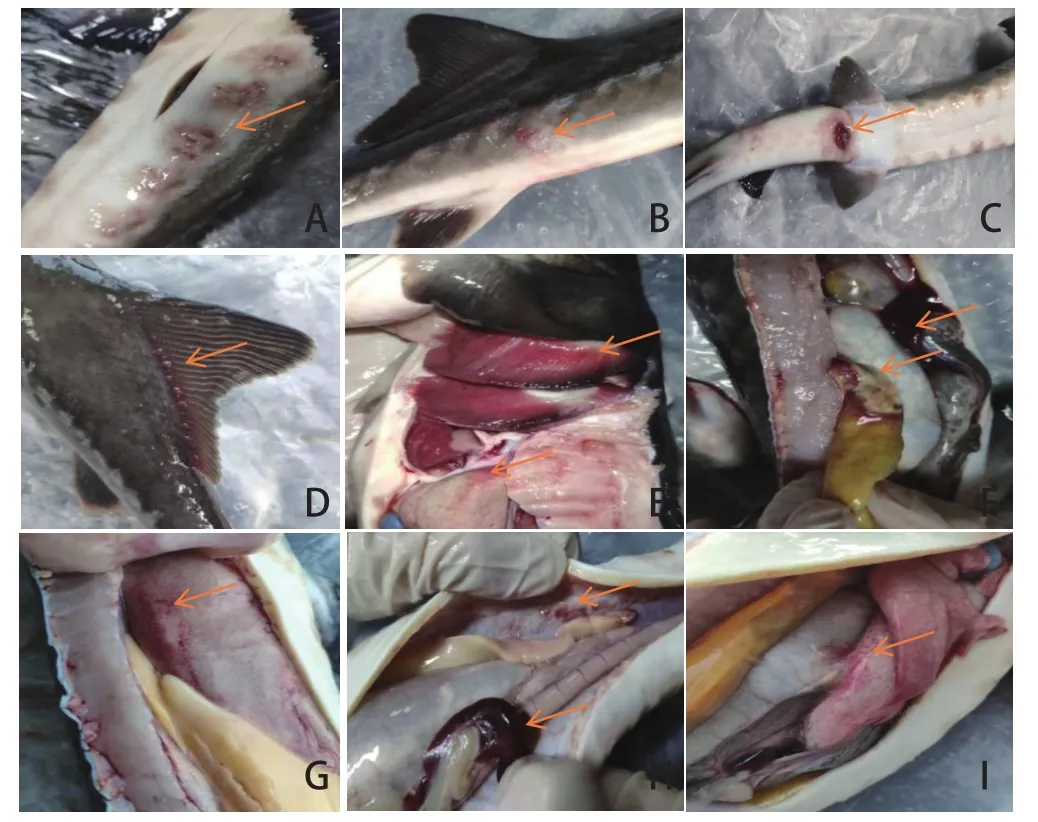
图2 杂交鲟人工感染后的主要临床症状Fig.2 Main clinical symptoms of artificial infection of hybrid sturgeon
2.3 病理组织学分析 比较正常对照组和人工感染组杂交鲟各器官切片变化发现,感染后杂交鲟鳃、肌肉、脂肪、肠道和心脏等组织均有明显的病理变化。与正常对照杂交鲟鳃(图3A)相比,人工感染杀鲑气单胞菌后杂交鲟鳃的主要病理变化为鳃丝短小扭曲,鳃丝软骨排列凌乱,鳃小片排列不齐、弯曲或皱缩,严重者出现坏死断裂脱落,鳃丝和部分鳃小片充血,甚至在鳃小片末端形成血肿(图3B);与正常对照组(图3C、3E)比较可以看出,人工感染杀鲑气单胞菌后杂交鲟病理组的肌纤维间隙较大,肌纤维密度明显减少(图3D),肌纤维扭曲、排列紊乱, 纤维断裂崩解, 横纹由不清晰到完全消失(图3F);与正常对照组(图3G)比较,人工感染杀鲑气单胞菌后杂交鲟脂肪组织有大量的血细胞浸润,形成大面积血细胞斑块(图3H);与正常对照组(图3I)比较,人工感染杀鲑气单胞菌后杂交鲟肠腔中充满变性、脱落、坏死的上皮细胞,肠道绒毛发生崩解脱落,并有血细胞和少量炎性细胞浸润(图3J);正常情况鲟鱼心外膜具一个个卵圆形的“结节”,这些“结节”外层由致密结缔组织形成,每个结节间由疏松结缔组织或脂肪组织连接,“结节”的内部是腔室(图3K),人工感染杂交鲟心脏的病理变化主要发生在心肌细胞,可见心肌纤维扭曲、排列紊乱,纤维断裂崩解,横纹由不清晰(图3L);与正常对照组比较(图3M),人工感染杀鲑气单胞菌后杂交鲟肝组织中央静脉扩张并有少量血细胞,中央静脉周围有炎性细胞浸润,肝细胞排列紊乱,肿胀,并发生明显的空泡化脂肪变性或水样变性,细胞界限模糊不清,均有不同程度的脂肪肝(图3N);与正常对照组(图3O)比较,人工感染杀鲑气单胞菌后杂交鲟脾组织毛细血管扩张、充血,严重区域破裂出血及溶血,形成血斑(图3P)。
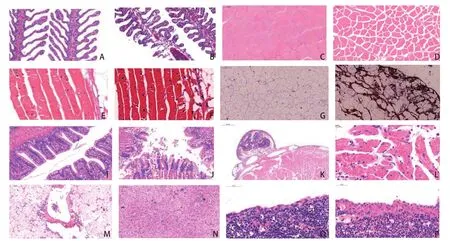
图3 杂交鲟人工感染杀鲑气单胞菌正常对照与病理组织切片Fig.3 Normal control and pathological section of artificial infection of hybrid sturgeon by Aeromonas salmonicida
3 讨论
疖疮病是一种普遍存在的疾病,它影响着世界范围内的水产养殖,其特点是发病率高,死亡率高[9],杀鲑气单胞菌为该病主要病原体。自从Emmerich[10]于1984年首次从患病溪鳟(Salvelinus fontinalis)中分离到该病原菌以来,其宿主范围逐年扩大到除鲑科鱼类外的鲤科(Cyprinidae)、鳍科(Serranidae)、鳗鲡科(Anguillidae)、鲆科(Bothidae)等鱼类,在猪[11]、羊[12]中也有分离到该菌,而且其宿主范围还在不断扩大,有引起金鱼、鲤鱼等鲤科鱼类的溃疡病和红皮炎的报道[13-15],目前尚未有在鲟鱼中分离到该菌的相关报道。贵州省地处中国西南内陆腹地,因其得天独厚的水资源,近年来大力发展虹鳟、鲟等冷水鱼的养殖,但随着养殖密度的不断加大及养殖技术的不成熟,各种细菌及病毒病相继暴发。自2019年来,有多个养殖场鲟鱼暴发类似疖疮病症状的疾病,但送来本实验室后,病毒检测及细菌的分离培养均未取得较好的效果,这其中可能是因为没有对发病杂交鲟进行16S rDNA检测,外加上在进行细菌分离的时候没有选择合适的培养基,仅仅只是使用了普通培养基。基于此情况本研究对杂交鲟进行杂交鲟杀鲑气单胞菌人工感染,感染后观察杀鲑气单胞菌对杂交鲟是否有感染性,并对其临床症状、解剖学变化、病理变化情况进行初步探究。
人工感染试验表明,从患疖疮病的虹鳟鱼中分离到的杀鲑气单胞菌菌株可感染健康杂交鲟,造成杂交鲟发病死亡,经计算臀鳍注射半数致死量为7.9×106CFU/mL,表明杀鲑鱼气单胞菌对杂交鲟具有较强的致病性和致死性。在杂交鲟感染后,与Scott等[16]报道鲑鱼感染杀鲑气单胞菌后,脾脏肿大,肝脏被膜下出血,肠道无食出血等症状相似;与李绍戊等[17]报道在大西洋鲑感染杀鲑气单胞菌后,尾侧或者在体侧形成特征性脓肿,严重时形成溃疡结果相似,而这些溃疡最后主要形成烂皮;与Wiklund等[18]研究结果相似,但刁菁等[19]结果中会引起虹鳟鱼体色发黑有差异,剖检可见肝脏、脂肪组织出现点状出血等典型症状相同;与杨移斌等[15]报道在斑点叉尾鲙感染杀鲑气单胞菌后,眼球呈凸起状,有大量腹水积存等症状不同,而导致这种现象的原因可能为毒力因子的不相同,毒力因子的不同导致不同菌株间致病力和致病后症状的不同[20],也有相关报道称该病的发生与温度密切相关[21],温度的不同也许会导致疾病的发展不同。
对杂交鲟人工感染杀鲑气单胞菌后,其主要的病理变化为出现充血、出血、溶血的病理过程,进而引起实质细胞颗粒变性和空泡变性,病情严重时发展到坏死,形成弥散性坏死灶,肝脏空泡化,中央静脉扩张少量出血,心脏出现心肌纤维扭曲、排列紊乱,纤维断裂崩解的病理现象,与嗜水气单胞菌感染杂交鲟[22]后的病理现象相似。但其在临床上有较大差别的是,临床上肝脏中空泡化可能是由于饲养过程中能量过高引起的脂肪蓄积呈现的现象。值的注意的是,这些变化均为毒力因子引起的[23],引起这些病理变化的毒力因子是否相同,尚需要进一步的研究,但可以肯定的是杀鲑气单胞菌与嗜水气单胞菌感染杂交鲟后的病理变化存在相同之处。本实验使用虹鳟鱼源杀鲑气单胞菌对杂交鲟进行人工感染,发现杀鲑气单胞菌可以引起杂交鲟发病,主要症状与疖疮病相似,可以引起杂交鲟死亡,臀鳍注射半数致死量为7.9×106CFU/mL。病理切片观察可见多组织器官发生充血、出血、溶血等病理现象。本实验为杂交鲟相关细菌疾病的诊断提供了新的理论依据。
