营养盐比例对硅藻水华优势种小环藻生长和生理的影响
2021-05-20王沛芳马晶洁
刘 鑫, 王 超, 王沛芳*, 王 洵, 马晶洁, 胡 斌
1.河海大学环境学院, 江苏 南京 210098
2.河海大学, 浅水湖泊综合治理与资源开发教育部重点实验室, 江苏 南京 210098
硅藻是一类细胞壁高度硅质化的单细胞藻类,种类繁多、数量庞大,是水生态系统中重要的初级生产者[1]. 硅藻对水环境变化非常敏感[2],其许多种类能很好地反映水体的营养状态[3]. 硅藻水华的暴发与温度、光照、营养盐及缓慢的流速等密切相关[4]. 不同的生境中,硅藻水华的优势种也有很大差异[5]. 已有研究发现,小环藻是河流、湖库等生态系统中最为常见的硅藻水华优势种.
近年来,随着长江流域经济的快速发展和周边人口数量的增加,长江水系富营养化趋势日益明显,在河流、湖库中多次暴发硅藻水华. 从1992年至今,汉江中下游及其支流已陆续报道了11次较为严重的早春硅藻水华[6];三峡水库的支流香溪河[7]、神农溪和大宁河[8]以及太湖流域的天目湖沙河水库、宜兴的横山水库[9]等也出现了不同程度的硅藻水华,对水生态系统和人类的健康造成了不利影响.
水体中过量的氮(N)、磷(P)是硅藻异常繁殖的物质基础. 除氮、磷元素外,硅(Si)元素对硅藻生长亦具有关键性作用[10],其不仅是硅藻细胞壁的重要组成成分,还参与硅藻细胞中光合色素、蛋白质和DNA的合成[11],其浓度大小可直接影响硅藻的生物量[12]. 自然水体中硅主要源于陆地上硅质岩的风化作用,随地表径流汇入河口及沿海水域,人为活动供给较少[13];而氮、磷浓度受人为活动影响较大,与生活污水排放、化肥农药等不合理使用及人口密度等紧密相关[14]. 受人为因素影响,水体营养盐浓度变化必然导致营养盐结构发生改变. 现有研究多集中于N/P对水华蓝藻优势形成的影响,而对与硅藻生长相关的Si/P、Si/N等研究较少.
自三峡水库蓄水后,长江口水域硅浓度显著降低,氮、磷浓度不断升高,致使水体营养盐结构发生显著变化(N/P上升,Si/P、Si/N下降),最终导致硅藻生物量减少、浮游植物优势种组成发生改变[15-16],另在一定程度上还增强了非硅藻的竞争优势[17]. 此外,汉江流域历年发生硅藻水华致使水体硅酸盐截留沉积,以及外源营养物质氮、磷等不断输入,促使一些河段Si/N较大,现有学者认为较高的Si/N是汉江流域硅藻水华暴发的主要原因之一[18]. 由此可见,研究Si/P和Si/N对硅藻生长的影响具有重要意义. 然而,现有研究多集中在野外采样试验的相关性分析方面,针对营养盐结构变化下硅藻的生长及生理响应,以及营养盐浓度变化改变营养盐结构对硅藻的生长有何影响效果等方面的研究仍存在不足,且有关水体中何种营养盐比例变化对硅藻生长影响最为显著也暂无明确的定论. 为此,该文以长江流域水体中最为常见的硅藻水华优势种——小环藻为研究对象,通过室内模拟试验,探究不同氮、磷、硅营养盐比例及其浓度对小环藻生长和生理的影响,分析营养盐浓度变化下,小环藻生长所需的最适营养盐比例及浓度,并定量分析得出对硅藻生长影响最为显著的营养盐比例,以期为揭示硅藻水华发生的营养盐调控机制提供理论基础,并为硅藻水华的防治提供参考.
1 材料与方法
1.1 试验藻种
所用藻种为小环藻(Cyclotellasp. FACHB 1654),购自中国科学院水生生物研究所淡水藻种库,采用D1[4]培养基保存培养,培养条件为温度25 ℃,光照强度 2 500 lx,光暗比14 h∶10 h.
1.2 试验方法
进行不同营养水平下N/P、Si/P、Si/N对小环藻生长和生理的影响试验研究. 初始氮、磷、硅浓度的设定,参照长江流域水体中其相应浓度[19-21],如表1所示,培养基中营养盐初始浓度与设定值的偏差不超过10-3.
试验所用培养基以HGZ[22]培养基为基础,通过改变HGZ基础培养基中硝酸钠、磷酸氢二钾、硅酸钠的添加量来控制各试验组的初始氮、磷、硅的质量浓度. 培养液配制完成后,均于高压蒸汽灭菌锅中121 ℃下灭菌30 min,冷却后待接种.
将D1培养基中处于对数生长期的小环藻藻种在 4 500 r/min下离心15 min,收集藻细胞,接种至灭菌过的未添加氮、磷、硅的HGZ培养基中,饥饿处理48 h. 随后在250 mL锥形瓶中添加100 mL含不同浓度氮、磷、硅的培养基(见表1),接种经饥饿处理的藻种. 初始接种浓度5×104cells/mL,每组设置3个重复. 接种后放置于温度(25±1)℃、光照强度 3 000 lx、光暗比14 h∶10 h的光照培养箱中进行一次性培养,培养周期为14 d. 将接种日记为第0天,接种次日记为第1天,分别在第1、3、5、7、9、11、13天的同一时间测定藻细胞密度和叶绿素荧光参数. 培养期间,每天定时摇匀3次,防止藻细胞贴壁生长而影响试验结果.
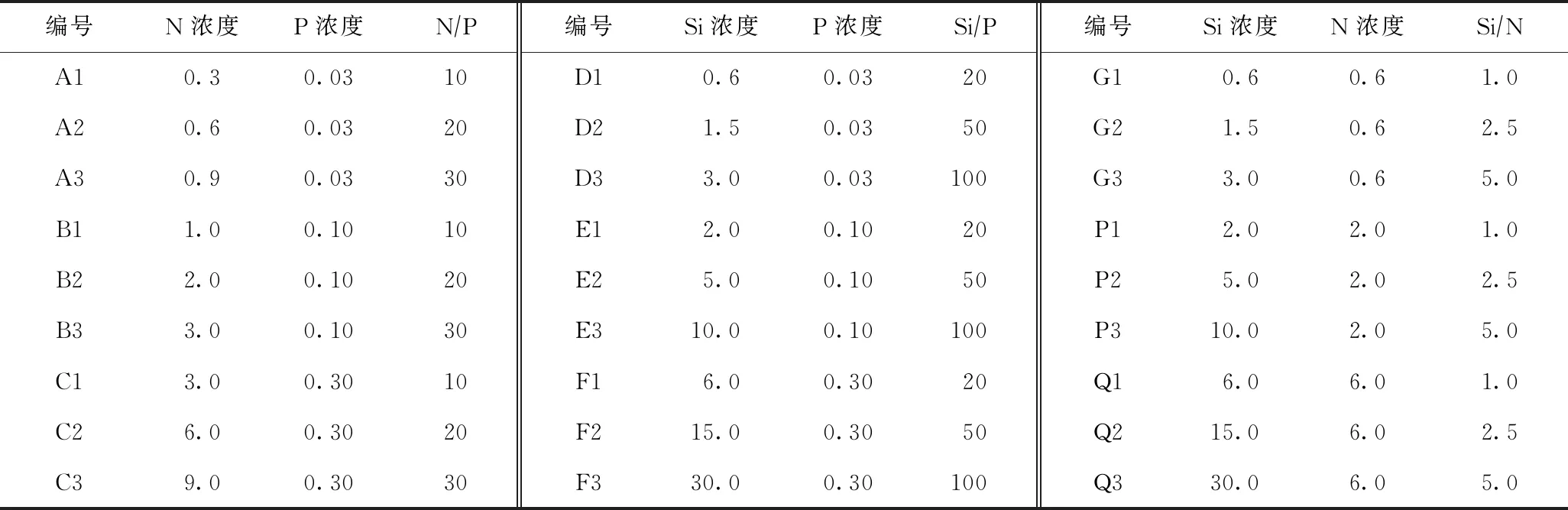
表1 试验组N、P、Si浓度及N/P、Si/P、Si/N设定
1.3 测定指标和方法
藻细胞密度:取3 mL样品,利用分光光度计测定小环藻悬液在680 nm处的吸光值,根据提前绘制好的小环藻藻细胞数与吸光值之间的标准曲线(Y=2.157 4X+0.006 8,R2=0.998 1),计算藻细胞数.
叶绿素a浓度和叶绿素荧光参数:取1 mL藻液于测量杯中,暗适应5 min,在2 μmol/(m2·s)光强下测定最大光量子产量(Fv/Fm);再于32 μmol/(m2s)光强下用浮游植物荧光仪(Phyto-PAM-Ⅱ, Hein Walz, Germany)测定叶绿素a浓度[23]. 随后选择Light Curve界面,测定藻液在不同光强下的相对电子传递效率,并对测量结果进行Eilers-Peeters模型[24]拟合,计算公式:
P=PAR/(a×PAR2+b×PAR+c)
(1)
α=1/c
(2)
(3)
(4)
式中:P为光合速率,μmol/(m2·s)(以光子数计,下同);PAR为光强,μmol/(m2·s);a、b、c为计算参数,根据拟合结果求得光能利用效率(α),μmol/(m2·s),反映生物体的光能利用效率;Ik为半饱和光强,μmol/(m2·s),反映生物体对强光的耐受能力;ETRmax为最大相对电子传递速率,μmol/(m2·s),反映生物体的光合活性高低.
比生长速率(μ)是指在某一时间间隔内藻类的生长速率,其计算公式:
μ=(lnN2-lnN1)/(T2-T1)
(5)
式中:N1为某一时间间隔开始时的藻细胞密度,cells/mL;N2为某一时间间隔终结时的藻细胞密度,cells/mL;T2-T1为时间间隔,d.
1.4 数据处理
采用Origin 9.0软件进行图形绘制;利用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)和Tukey多重比较,取P<0.05为显著差异.
2 结果与分析
2.1 小环藻在不同N/P下的生长和叶绿素荧光参数变化
由图1可见,随着N/P的升高,小环藻的最大藻细胞密度呈上升趋势,在N/P为30时,其生长情况最好;其中,N/P为20和30的高磷浓度组,小环藻生长差异不明显,比生长速率分别为0.177 7、0.174 6 d-1(见表2). 整个试验过程中,在同一N/P下增加氮、磷浓度,对小环藻的生长具有明显的促进作用.
不同试验组中叶绿素a浓度在培养期间均表现出先增加后减少的趋势,最大值出现在第11天. 对于磷浓度相同的试验组,提高N/P对叶绿素a的积累有促进作用. 各N/P下的低磷浓度组,叶绿素a浓度均处于较低水平. 整个试验过程中,N/P为20和30的高磷浓度组的叶绿素a浓度较高且相近,分别为1 130.4 和 1 135.3 μg/L.
不同N/P下小环藻叶绿素荧光参数的变化情况如图2所示. 由图2可见,A1~C1七组,随着培养时间的增加,Fv/Fm出现了不同程度的降低,下降范围为0.26~0.32;而C2、C3处理组,Fv/Fm在前7 d内都维持在较高水平,7 d后才呈下降趋势,且仅下降了0.13,低于前7组的下降程度. 这说明在N/P为20和30的高磷浓度下,小环藻光合效率也较高.
各N/P的低磷浓度组,小环藻α、Ik和ETRmax值均呈下降趋势,试验7 d后均处于较低水平. 中磷浓度组,α值在试验前5 d能稳定在较高水平,之后呈大幅下降趋势;其中,α、Ik和ETRmax值在N/P为30下最高. 而N/P为20、30的高磷浓度组,在整个培养过程中,α值一直稳定在较高水平,Ik和ETRmax值仅在试验前7 d维持在较高水平.
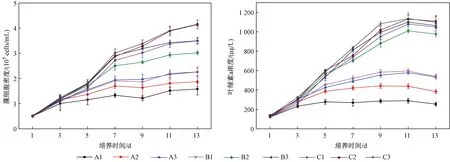
图1 不同N/P下各试验组小环藻的藻细胞密度及叶绿素a浓度的变化
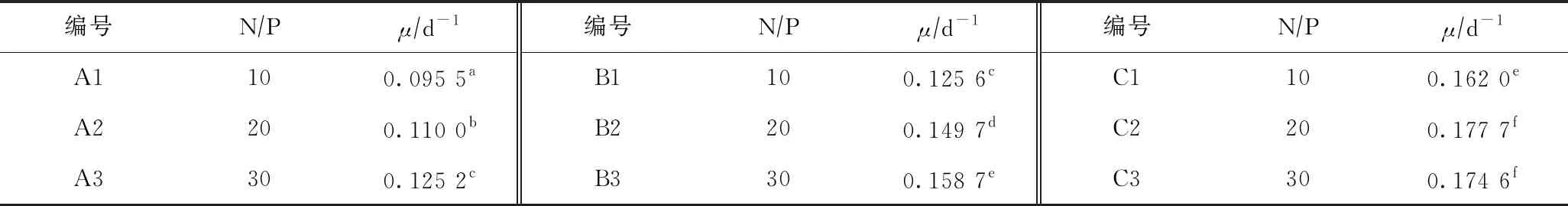
表2 不同N/P对各试验组小环藻比生长速率(μ)的影响

图2 不同N/P下各试验组小环藻叶绿素荧光参数Fv/Fm、α、Ik、ETRmax的变化
2.2 小环藻在不同Si/P下的生长和叶绿素荧光参数变化
由图3可见,提高Si/P对低、中磷浓度组中小环藻的生长及叶绿素a的积累具有明显的促进作用. Si/P为20、50的低磷浓度组,小环藻生长最为缓慢,比生长速率仅为 0.086 3、0.107 0 d-1(见表3),藻细胞密度、叶绿素a浓度均显著低于其余7组,此时提高Si/P至100,藻细胞增殖速率明显加快,叶绿素a浓度显著增加,最大藻细胞密度值可达2.86×105cells/mL,是Si/P为20时的1.9倍. 整个试验过程中,Si/P为50的高磷浓度组小环藻生长情况最好,最大藻细胞密度为7.29×105cells/mL,叶绿素a浓度为 1 444.4 μg/L;而Si/P为100的高磷浓度组,小环藻生长相对迟缓,生长情况次于Si/P为50的高磷试验组.
不同Si/P下小环藻的叶绿素荧光参数的变化情况如图4所示. 各试验组Fv/Fm、α、Ik及ETRmax的变化规律相同,总体上呈先上升后下降的趋势. 各试验组Fv/Fm在前5 d呈上升趋势,增加范围为0.03~0.07,培养5 d后出现轻微减小,下降范围仅为0.06~0.09. Si/P为20、50的低磷浓度组,α、Ik、ETRmax值均显著低于其他7组(P<0.05). Si/P为50、100的中磷浓度组,Ik在3 d后略有下降,总体上稳定于较高水平,ETRmax变化差异不明显,Ik、ETRmax值在Si/P为100时最高. 整个试验过程中,Si/P为50的高磷浓度组,α、Ik、ETRmax值均显著高于其余8组(P<0.05),光合活性高.
图3 不同Si/P下各试验组小环藻的藻细胞密度及叶绿素a浓度的变化

表3 不同Si/P对各试验组小环藻比生长速率(μ)的影响
2.3 小环藻在不同Si/N下的生长和叶绿素荧光参数变化
由图5可见,Si/N的提高对小环藻的生长具有明显的促进作用,在Si/N为5.0时,最有利于小环藻生长. 其中,Si/N为1.0、2.5的低氮浓度组,藻细胞密度增长最为缓慢,比生长速率分别为0.093 6、0.099 1 d-1(见表4),在整个培养过程中藻细胞密度值、叶绿素a浓度均处于较低水平,叶绿素a浓度最大值分别为297.7、311.5 μg/L. Si/N为2.5、5.0的高氮浓度组,小环藻生长情况较好,但两组间差异不明显,藻细胞密度最大值分别可达6.29×105、6.31×105cells/mL,此外,在整个试验周期内这两组叶绿素a浓度也均一直处于增长阶段,小环藻长势较好.
不同Si/N下小环藻叶绿素荧光参数变化如图6所示. 由图6可见,Si/N为2.5、5.0的高氮浓度组,Fv/Fm、α值在培养前11 d均可维持在较高水平;而各Si/N的低氮浓度组,Fv/Fm、α值在培养5 d后便出现大幅下降,且各值显著低于其余各组(P<0.05). 在整个试验周期中,不同Si/N下,Ik、ETRmax均呈下降趋势,随着Si/N的增加,其降幅依次减小. 各Si/N的高氮浓度组,Ik、ETRmax显著高于低、中氮浓度组(P<0.05). 其中,Si/N为2.5、5.0的高氮浓度组,Ik、ETRmax值降幅最小.

图5 不同Si/N下各试验组小环藻的藻细胞密度及叶绿素a浓度的变化

表4 不同Si/N对各试验组小环藻比生长速率(μ)的影响

图6 不同Si/N下各试验组小环藻叶绿素荧光参数Fv/Fm、α、ETRmax、Ik的变化
3 讨论
3.1 N/P对小环藻的生长和生理的影响
Redfield[25]于1958年提出藻类健康生长及生理平衡所需的最适N/P为16. 然而浮游藻类对营养元素的需求及利用特性存在差异,致使藻类生长的最适比例并不一定遵循这一规律. 该试验结果显示,小环藻生长最适N/P为30. 在试验所设浓度范围内,提高N/P可促进小环藻的生长. 在N/P为20、30的高磷浓度组,小环藻生长差异不明显,这说明氮浓度为6 mg/L时已经达到小环藻生长的饱和浓度. 可见氮、磷浓度较充足时,营养盐的绝对浓度比N/P对小环藻生长的影响更大. 整个培养过程中,小环藻在各N/P的低磷浓度组,生长最为缓慢,叶绿素a浓度及光合活性均处于较低水平,这一结果可能是因为磷缺乏,光合作用中的Calvin循环受到抑制,小环藻PSII反应中心受损,使得细胞分裂、叶绿素合成受阻,光合活性降低[26]. 如果以“Redfield”比(16∶1)为判断标准,在N/P 为10~30范围内,小环藻的生长应从氮限制转为磷限制,而该试验中小环藻生长一直受氮限制,这可能是由氮的绝对浓度低于限制小环藻生长的阈值所致[27]. 在汉江硅藻水华暴发期,水体TN/TP大于16,硅藻密度(Y)与TN/TP(X)之间呈指数型关系(Y=30.07e-0.221X,R2=0.628 1)[6],该趋势与笔者所得结果不同,可能是由水华期间水体处于磷限制状态(TP浓度为0.05~0.19 mg/L)所致. 由此可见,在研究氮磷比值对硅藻生长的影响时,需加以考虑水体中氮磷实际浓度. 吴世凯等[28]研究表明,硅藻门的藻类在TN/TP为12~30的环境中有较好的生长潜力. 曾艳艺等[29]研究表明,条纹小环藻的最适N/P在22~25之间. 在笔者所设浓度下,小环藻生长最适N/P为30,与上述已有研究结果相近.
3.2 Si/P对小环藻的生长和生理的影响
刘霞[30]研究发现,硅、磷共限制的水体环境会抑制浮游硅藻的生长繁殖. 该试验结果显示,在中、低磷营养盐浓度下,提高Si/P对小环藻的生长具有明显的促进作用,Si/P为100时,最适宜小环藻生长;而在高磷营养盐浓度条件下,Si/P为50时小环藻生长情况最佳,最大藻细胞密度达7.29×105cells/mL,继续提高Si/P至100,小环藻生长变得迟缓,光合活性降低. 另外,Si/P为20、50的低浓度组(磷浓度为0.03 mg/L),小环藻的藻细胞密度、叶绿素a浓度及叶绿素荧光参数值均显著低于其余各组. 这说明硅、磷浓度分别低于0.03、1.5 mg/L时,能极大地限制小环藻的生长. 胡胜华等[31]对武汉月湖水体营养物质及硅藻密度的监测发现,月湖溶解性无机磷(DIP)、溶解性硅(DSi)平均质量浓度分别为0.077、3.70 mg/L,此时硅藻与DSi/DIP比值呈极显著正相关,同时,DSi与DIP浓度的上升还可提高硅藻的生长速率. 该研究中在磷浓度低于0.1 mg/L、硅浓度低于10 mg/L条件下,Si/P对小环藻生长的影响结果进一步支持了胡胜华等[31]的结论. 然而在高磷浓度下,小环藻Si/P的最适生长比例为50,这可能是因为小环藻生长存在最适硅浓度,且在该研究中,小环藻在硅浓度为15 mg/L时生长最佳. 这与已有研究结果一致,例如,王珺等[32]发现,微小小环藻生长繁殖的最适硅浓度为25 mg/L,适宜浓度为10~30 mg/L. Shatwell等[33]研究表明,低温、低DSi浓度的条件可增强硅藻的竞争优势,且当硅浓度较低时,能更早地阻止春季硅藻的生长. 自然水体在正常情况下,硅浓度一般低于10 mg/L[18,34-35],尚未超过小环藻生长的最适浓度,此时硅浓度的增加会进一步促进小环藻的生长,因此,在硅藻水华的防治过程中应加强水质硅浓度的监测.
3.3 Si/N对小环藻的生长和生理的影响
YE等[36]研究表明,Si/N为1.0可作为硅藻生长受限的重要标准,在Si/N大于1.0的水体中硅藻易于占据优势地位. 在硅藻水华暴发期,硅是主要限制元素,当水体硅被耗尽后,氮元素将限制硅藻生长[35]. 该研究发现,Si/N升高对小环藻的生长具有显著的促进作用,在试验所设浓度范围内,最适宜小环藻生长的Si/N为5.0. 在整个试验过程中,Si/N为2.5、5.0的高氮浓度组,小环藻生长情况较好,光合活性高,但两组小环藻生长差异不明显,说明氮浓度为6 mg/L时,小环藻生长最适硅浓度为15 mg/L. 此外,Si/N为1.0、2.5的低氮浓度组,小环藻生长最为缓慢,叶绿素a浓度及叶绿素荧光参数值均处于较低水平. 这表明氮浓度低于0.6 mg/L、硅浓度低于1.5 mg/L时,可极大地限制硅藻生物量. 从目前天目湖治理经验来看,全年水体总氮浓度低于1.0 mg/L、总磷浓度低于0.025 mg/L,能显著降低硅藻水华发生风险[9],此时,若能将硅浓度控制在1.5 mg/L以下,则可进一步抑制硅藻水华的暴发. 吴兴华等[18]研究表明,汉江中下游干流硅藻水华发生期,水体氮浓度为1.24~1.67 mg/L,硅浓度为2.21~9.21 mg/L,硅藻水华细胞密度与水体中硅浓度、硅氮比均呈显著正相关,认为较高的硅氮比是引发硅藻水华的主要原因之一. 该研究中,氮浓度低于2 mg/L、硅浓度低于10 mg/L时,Si/N对小环藻生长的影响结果可进一步支持吴兴华等[18]的研究结论. 此外,水体Si/N以及硅浓度的降低还会在很大程度上造成硅藻种类及生物量的减少[15]. 可见,在较低的硅浓度及Si/N下,硅藻水华暴发的可能性较小.
对比不同营养盐结构下小环藻的生长情况发现,Si/P对小环藻生长的影响最为显著. 在试验所设浓度内,小环藻Fv/Fm、α值在硅、磷共限制体系中仅出现轻微下降,试验末期仍能维持在较高水平,而在氮磷、硅氮共限制条件下,试验5 d后叶绿素荧光参数值便出现大幅下降;另外,Si/P为50的高磷浓度组,藻细胞密度值最高达7.29×105cells/mL,显著高于其余各组. 可见,小环藻生长受Si/P的影响最大. 此外,从以上研究可以发现,即使在营养盐结构不变的条件下,营养盐浓度变化对小环藻生长亦有明显的影响,因此,探究营养盐结构对小环藻的生长影响需要结合营养盐的绝对浓度来进行.
4 结论
a) 营养盐比例对小环藻的生长有显著影响,其中Si/P的影响最为明显. 小环藻在N/P为30、Si/N为5.0的环境中具有较好的生长潜力. 在低、中营养水体中,小环藻生长潜能与Si/P呈正相关,最适Si/P为100;在高浓度水体中,最适Si/P为50.
b) 氮、磷浓度较高时(氮浓度不低于6 mg/L、磷浓度不低于0.1 mg/L),硅是小环藻生长的主要限制因素,最适浓度为15 mg/L.
c) 磷浓度在0.03 mg/L以及氮浓度低于0.6 mg/L、硅浓度低于1.5 mg/L时,不利于小环藻的正常生长. 因此,实际水体营养盐浓度若低于此水平,将能有效控制硅藻水华的暴发.
