Cu/Al2O3低温催化氧化H2S研究
2021-05-20尹梦雪樊飞跃
尹梦雪, 樊飞跃, 赵 龙, 侯 红
中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012
硫化氢(H2S)是最常见的有毒污染物之一[1-2],能够通过多种化学过程产生[3-4],广泛存在于石油、天然气,沼气和化石燃料加工产生的气流中,也常见于污水和垃圾堆等废物处理的化学反应过程中[2,5]. H2S具有强烈的恶臭和毒性[4],对环境和化学工艺过程有极大的危害[6-7],能够引起管道和设备的腐蚀,并使石油化工中使用的诸多金属/氧化物催化剂迅速失活或中毒[4-5,7-8],同时也是酸雨的主要来源之一. 此外,H2S对人体健康具有严重的危害,低浓度的H2S对人的呼吸、神经和生殖系统有强烈的刺激作用[1-2,9-10],而高浓度H2S的吸入则会使人直接死亡[11]. 目前,相关的环境法律法规对含硫恶臭气体的排放也有越来越严格的要求[4,8,12],因此有必要将H2S的排放浓度降至允许的排放水平.
目前,脱除H2S的方法主要有吸附法、吸收法和催化氧化法[13-15]. 吸附法具有快速吸附低浓度H2S、工艺简单、运行温度低等优点,但价格高、消耗大、再生效果差[16]. 吸收法虽然处理设备简单、材料价格低廉,但吸收效率低,只能吸收高浓度的气体[17]. 由于投资成本低、脱硫精度高(尾气浓度小于10-7mol/L)、无二次污染等优点,低温催化氧化法特别适合于低温、低浓度H2S的精脱除[18],已被研究人员广泛关注.
金属阳离子对H2S有很强的化学亲和力[5],是去除H2S的良好选择. 然而,由于比表面积和孔体积低,具有催化性能的金属氧化物利用率有限,吸附过程中形成的硫化物会堵塞孔,导致H2S去除能力降低[19]. 介孔材料通常用作载体和结构稳定剂,将金属阳离子分散在它们的表面[5,18],良好的相互作用可以防止活性相的聚集[4]. 已经研发出多种用于催化氧化去除H2S的材料,通常使用活性炭和具有介孔结构的金属氧化物材料做载体,制备活性炭基和金属氧化物基催化剂[5,20]. 虽然,碳基催化剂被证明具有良好的催化性能[20-22],但由于制备过程复杂,很难推广应用. 金属氧化物基催化剂由于制备方式简单,催化性能良好被广泛研究. Al2O3、TiO2、SiO2等金属氧化物是使用最广泛的3种氧化物载体. 由于热力学的限制,目前已有研究的金属氧化物基催化剂的低温脱硫性能(<200 mg/g)并不理想[10,23-25],因此迫切需要开发一种催化活性高、制备工艺简单、成本低的催化剂.
金属氧化物基催化剂的研究主要是基于铁、铜、锌、钒、碱金属和稀土基催化剂在低温下去除H2S[5,12,18,26-28]. 然而,钒基材料具有毒性,铁基催化剂需要充足的氧气,容易失活[29]. 此外,稀土基催化剂的高成本和碱金属基催化剂脱硫效果差等缺点,制约了二者的应用. ZnO或Cu/CuxO纳米多孔复合物可以快速有效地吸附H2S[2,7,9-10],从而引起了研究人员的广泛关注. Elyassi等[30]认为CuO的硫化速度比ZnO快, Balsamo等[23]也发现催化剂活性相的利用率随着铜含量的增加而增加,因此Cu/CuxO是脱除H2S的良好选择.
溶胶凝胶法是催化剂载体制备的常用方法,但将Cu/CuxO负载在活性Al2O3上的研究较为鲜见. 因此,该研究利用浸渍法将Cu负载在处理好的商业Al2O3载体上,通过N2物理吸附、XRD (X射线衍射分析)、XPS (光电子能谱)、FT-IR (傅里叶变换红外光谱)等表征手段研究Cu基催化剂的表面结构、物相组成等,设置不同反应条件探讨反应温度、相对湿度、Cu负载量对催化剂脱除H2S的影响,从而筛选出一种脱硫效果好、成本低的催化剂,以期为后续恶臭处理应用提供理论基础和应用可行性.
1 材料与方法
1.1 材料与试剂
Al2O3购自国药化工试剂有限公司,经过高速粉碎机研磨后过20~40目 (380~830 μm) 筛,放入坩埚中于马弗炉内500 ℃煅烧4 h,冷却后取出备用. 硝酸铜〔Cu(NO3)2·3H2O〕购自西亚化学科技(山东)有限公司.
1.2 催化剂制备方法

图2 H2S动态脱附流程
1.3 催化剂性能测试
H2S动态吸附是在标准大气压条件下进行的,反应流程如图2所示. 将1 g催化剂与1 g石英砂(过20~40目筛)混合,装入石英管反应器(内径14.0 mm×200.0 mm)中,并通过控温装置将温度分别控制在0、30、50和70 ℃. 使用质量流量控制器控制N2/H2S (浓度为 7 606 mg/m3)和空气的流量,混合后的气体总流量为150 mL/min,H2S浓度控制在(1 521±76)mg/m3. 相对湿度分别控制在0、30%、50%和70%. 通过配有火焰光度检测器(FPD)的气相色谱仪〔GC-9860(Ⅲ) 型,上海奇阳信息科技有限公司〕检测H2S的浓度,尾气通过NaOH溶液进行吸收.
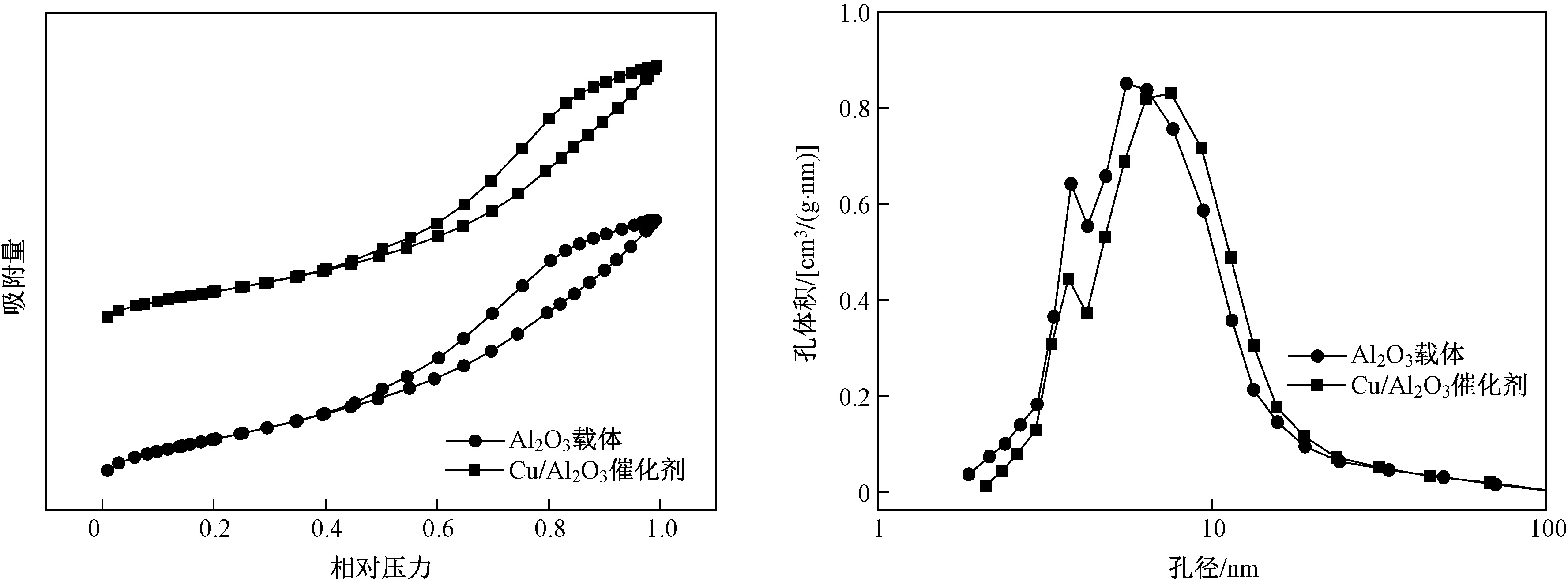
图3 Al2O3载体与Cu/Al2O3催化剂的N2吸附-解析等温线及孔径分布
当出口气体中的H2S浓度超过76 mg/m3时终止测试. 使用穿透硫容量(出口浓度为进口浓度5%时每克催化剂所吸附的H2S的质量,单位为mg/g)评估催化剂的性能,计算公式:
(1)
式中:Sc是催化剂的穿透硫容量,mg/g;M为硫的原子量,32 g/mol;Vmol为气体的摩尔体积,标准条件下为22.4 L/mol;u为气体流速,mL/min;cin和cout分别为进、出气体中H2S浓度,mg/m3;m为反应器中催化剂的质量,g;t为达到穿透浓度所需的时间,min.
1.4 催化剂的表征
在连续加热的硝酸/盐酸溶液中消解后,使用ICP-OES仪器(Optima5300DV,珀金埃尔默仪器有限公司,美国)通过电感耦合等离子体光谱法确定催化剂中金属含量. 将样品在恒温(反应前200 ℃,反应后50 ℃)下前处理6 h后,使用比表面与孔隙度分析仪(TRISTAR Ⅱ 3020M,麦克仪器公司,美国)在-196 ℃下测量N2吸附-解吸等温线. 使用智能X光衍射仪(SmartLab,上海仁特检测仪器有限公司)进行X光粉末衍射分析,衍射角在10°~80°之间. 使用SXM光谱仪(PHI Quantera,Ulvac-Phi公司,日本)进行X光电子能谱测量.
2 结果与讨论
2.1 催化剂结构表征
2.1.1N2物理吸附
图3为Al2O3载体和Cu/Al2O3催化剂的N2吸附-解吸等温线和孔径分布. 表1给出了Al2O3载体与Cu/Al2O3催化剂的物理结构特征. 由图3可见,Al2O3载体与Cu/Al2O3催化剂的滞后环均为Ⅳ型等温线,且孔径主要分布在3~20 nm范围内,表明Al2O3载体和Cu基催化剂都是典型的介孔材料[31]. 由表1可见,Cu的负载降低了Al2O3载体的比表面积,孔体积也有小幅降低,表明负载的金属Cu堵塞了一部分孔. 值得注意的是,孔径显示出相反的趋势,负载金属Cu后的Cu/Al2O3催化剂孔径略有增加,这是由于酸性浸渍液对Al2O3载体的部分侵蚀导致的. 由表1还可见,反应后Cu/Al2O3催化剂的比表面积和孔体积均有较大程度的下降,而平均孔径变大,这主要是因为催化反应生成物的沉积堵塞了催化剂的微孔结构所致.
柳眉倒竖,杏眼圆睁的萧琼见老者没有丝毫恶意,又震惊老者出神入化宛若陆地神仙的身手才收起怒意噘嘴道:“怎要命了?我是谁的姑奶奶?您又是谁的老哥哥?”老者叹了一口气道:“你羽弟是老哥哥的师弟,所以我就是你的老哥哥;老哥哥的师弟特别关照不能让你有闪失,你就是老哥哥的姑奶奶。姑奶奶大清早没头没脑的纵马奔腾不是要了老哥哥的命么?”看到萧琼惊愕地瞪大眼睛老者松开马的缰绳叹息道:“老哥哥游仓海,受你羽弟之托驻守于此。你羽弟叮嘱老哥哥:除了老哥哥的徒子、徒孙,任何人不许靠近,也不允许任何人获悉萧家人去向。姑奶奶这会要去哪里?”
2.1.2X射线衍射(XRD)分析
为研究Cu基催化剂的物相结构,对Al2O3载体以及反应前、后的Cu/Al2O3催化剂进行XRD表征,结果如图4所示. 由图4可见,Al2O3载体和Cu/Al2O3催化剂均在2θ为19.580°、37.603°、45.788°、66.761°处出现与γ-Al2O3标准卡片(JCPDS 29-0063)相对应的衍射峰. 对于Cu/Al2O3催化剂,没有发现Cu相关物种的衍射峰,这可能是由以下原因导致:①铜物种在氧化铝载体上高度分散;②铜物种的负载量低于XRD检测限.

表1 Al2O3载体与Cu/Al2O3催化剂的物理结构特征

图4 Al2O3载体以及反应前、后Cu/Al2O3 催化剂的XRD图谱
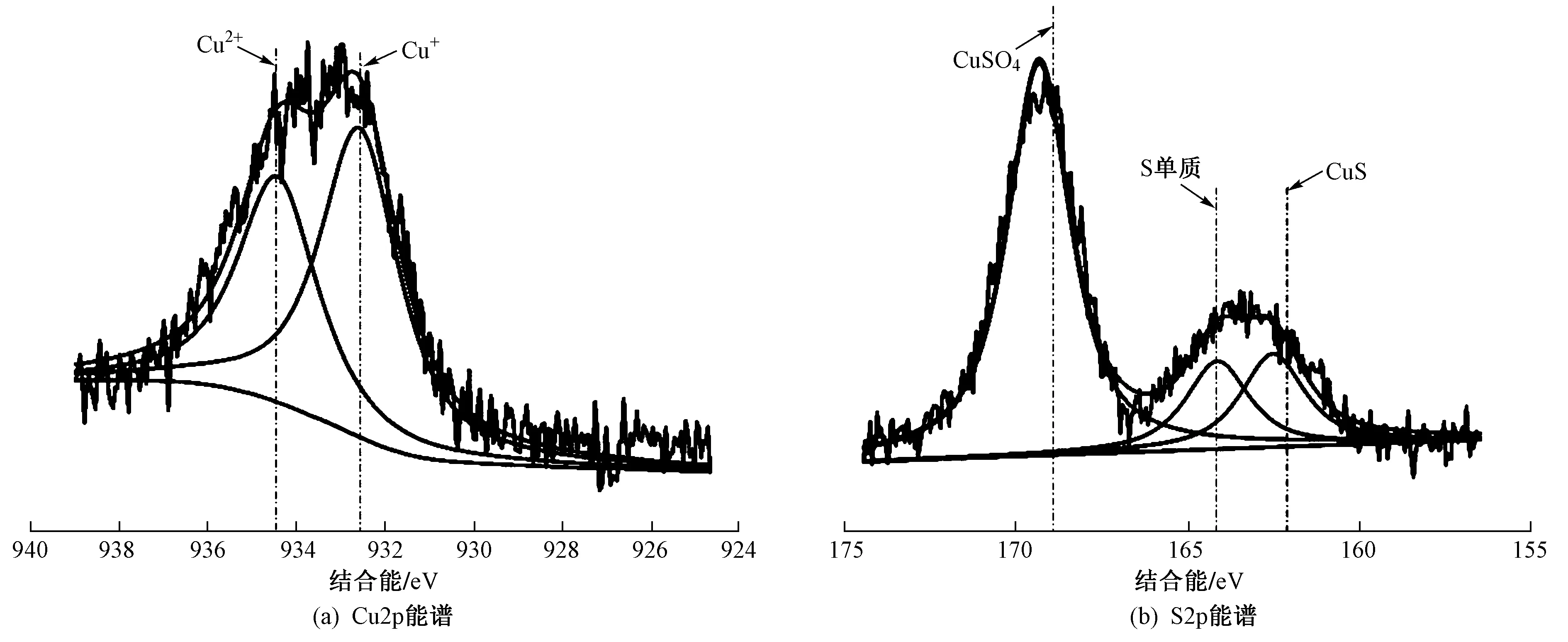
图5 Cu/Al2O3催化剂反应前、后的XPS谱图
对比反应后Cu/Al2O3催化剂的XRD谱图可以看出,反应后的Cu/Al2O3催化剂表面有大量的S单质及少量硫酸盐生成. 由于硫物种在催化剂表面的覆盖,γ-Al2O3的峰强度明显变弱. 在XRD谱图中没有发现CuS的生成,可能同样是由于其生成量低于XRD检测限所致.
2.1.3X射线光电子能谱(XPS)分析
为进一步考察Cu基催化剂表面组分的价态,对反应前的Cu/Al2O3催化剂进行XPS表征,结果如图5(a)所示. 由图5(a)可见,Cu2p能谱在933.5 eV处出现一个明显的特征峰,经分峰拟合后观察到分别在934.5和932.7 eV处出现2个特征峰,分别对应Cu2+和Cu+,说明催化剂表面同时存在CuO和Cu2O两种物质[32]. ZHANG等[7]研究表明,Cu2O是铜基催化剂的热力学稳定相,Bajaj等[9]也发现当Cu负载在载体表面时CuO和CuxO同时存在,与笔者研究结果一致.
为进一步探明催化剂表面物质的生成,对反应后的Cu/Al2O3催化剂进行XPS表征,结果如图5(b)所示. 由图5(b)可见,S2p经分峰拟合后在162.3、163.9和169.3 eV处分别出现3个特征峰,分别对应于CuS、S单质和CuSO4. XPS结果检测到大量硫酸盐的生成,在XRD中未发现硫酸盐的特征峰,这是可能是由于XPS是表面分析,而XRD给出的是材料的体相结构信息所致. 催化剂表层CuSO4含量高达68%,CuS和S单质的占比相似. 结合XRD结果可知,催化剂在脱除硫化氢的过程中S单质进入催化剂深层孔结构中,位于催化剂表面的S单质则在水分和氧气的作用下生成硫酸盐.
2.1.4傅里叶红外光谱(FT-IR)分析
反应前、后Cu/Al2O3催化剂的FT-IR光谱图如图6所示. 由图6可见:在 3 452 和 1 631 cm-1处观察到的特征峰对应于材料结合水中羟基(—OH)的伸缩振动[33-34],反应后催化剂的羟基振动峰变弱,表明羟基参与了H2S催化氧化反应;在586和850 cm-1处的特征峰分别归属于Al—O和Cu—O的伸缩振动键[35],反应后Cu—O振动键消失,说明CuxO与H2S发生化学反应,是H2S脱除的关键因素;出现在 1 142 cm-1处的特征峰说明反应后的催化剂表面有少量催化氧化反应产生的SO42-. 此外,在光谱中没有检测到NO3-(1 380 cm-1处)的相关峰,因此Cu(NO3)2在煅烧过程中完全分解成金属氧化物[24].

图6 反应前、后Cu/Al2O3催化剂的FT-IR光谱图
基于以上分析发现,Cu基催化剂是一种典型的介孔材料,表面存在高度分散的CuO和Cu2O两种物质,存在一定的结合水,无NO3-的存在. 结合水中的羟基和CuxO均在H2S催化氧化过程中发挥作用,反应过程中有S单质、CuS以及CuSO4的生成. 因此该反应可能存在以下反应机理:
H2S(ads)+H2O→H++HS-+H2O
(2)
Cu2O+CuO+H2O→Cu(OH)2+OH-
(3)
H2S+OH-→H2O+HS-
(4)
Cu(OH)2+H2S→CuS+2H2O
(5)
HS-+O2→S+H2O
(6)
S+H2O+O2+Cu(OH)2→CuSO4+H2O
(7)
2.2 催化剂脱硫性能研究
2.2.1不同Cu负载率对催化剂脱硫效果的影响
根据Cu在催化剂上的负载率,将制备的Cu/Al2O3催化剂命名为CatCux%,其中x%是负载在催化剂上CuO的质量占总催化剂质量的比例.
在催化温度50 ℃、相对湿度50%、混合气体空间速度 6 100 h-1的条件下,H2S动态吸附结果如图7所示. 由图7可见:Al2O3载体对H2S几乎没有催化和吸附作用,仅作为载体和结构稳定剂存在,Cu活性组分的加入显著提高了对H2S的催化氧化性能;同时,随着Cu负载量的增加,催化剂的脱硫效果随之增强,在负载量为3%时(CatCu3%)的穿透时间最长,有最大穿透硫容量(220.92 mg/g). 这是由于H2S的脱除主要是由催化剂表面CuxO与H2S发生化学反应所致,Cu活性组分的增加会增强对H2S的脱除. 然而,随着负载量的进一步增加,催化剂的穿透硫容量随之降低. 这主要是因为催化剂表面的微孔结构主要用于接收反应产物,当表面中孔结构全部被堵塞时,催化剂则会失活,不再参与反应,而过多的Cu活性组分也会使Cu基催化剂的中孔结构被堵塞[18],加速催化剂的失活. 此外,在尾气中未检测到其他硫物种(如SO2),说明催化剂的孔结构会接收所有反应产物,不会造成二次污染.

图7 不同铜负载量Cu/Al2O3催化剂的催化氧化H2S穿透曲线
2.2.2不同反应条件对催化剂脱硫效果的影响
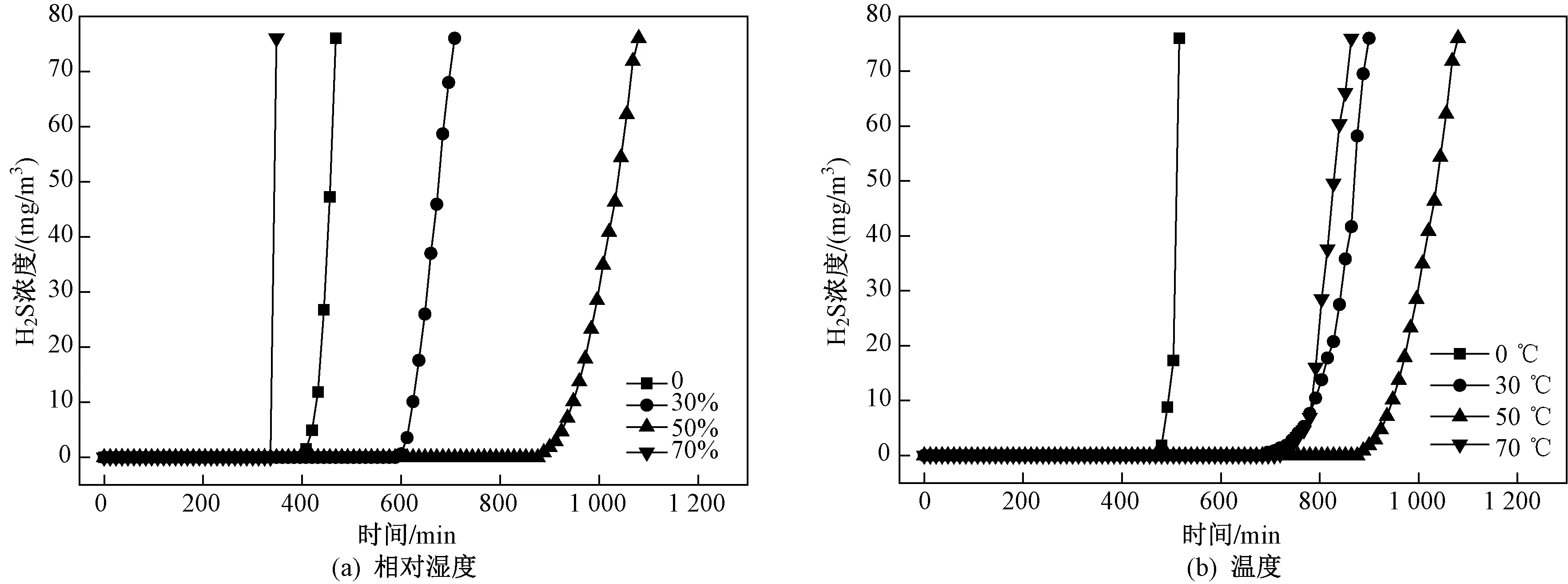
图8 不同相对湿度、温度条件下CatCu3%催化氧化H2S穿透曲线
为评价催化剂(以CatCu3%为例)的活性,研究不同温度、相对湿度条件下催化剂催化氧化H2S动态吸附情况,结果如图8所示. 当温度为50 ℃、混合气体空间速度为 6 200 h-1时,设置催化剂的反应相对湿度分别为0、30%、50%、70%. 由图8(a)可见:当相对湿度为0时,催化剂的脱硫性能较低,H2O的增加会大幅提高催化剂的脱硫性能;相对湿度在0~50%范围内,催化剂的穿透时间随相对湿度的增加而增加,并在相对湿度为50%时穿透硫容量达到最大值(220.92 mg/g);然而,随着相对湿度的进一步增加,催化剂的穿透时间迅速下降. ZHANG等[32]研究发现,氧化的金属基催化剂不仅可以稳定地将H2O吸附在表面,还可以将另一部分解离成羟基,与笔者FT-IR结果一致. 因此,水汽在H2S催化氧化过程中起着非常重要的作用,而过多的水汽会导致催化剂颗粒粘结,降低催化剂的利用率.
在相对湿度50%、混合气体空间速度 6 100 h-1的条件下,分别设定反应温度为0、30、50、70 ℃. 由图8(b)可见:在0~50 ℃范围内,催化剂的穿透时间随温度的升高而增加,当温度为50 ℃时有最长穿透时间;然而,当温度升至70 ℃时,催化剂的穿透时间下降. 这主要是由于金属氧化物表面H2O解离成羟基需要大量的热能,因此温度的升高会提高催化剂的脱硫效果,但是金属氧化物在脱硫过程中首先要吸附水汽[36],过高的温度不利于水分子在催化剂表面的附着. 因此,催化剂在50 ℃是有最佳穿透硫容量,穿透硫容量高达220.92 mg/g.
综上,催化剂的Cu负载量、温度、相对湿度均对催化剂的脱硫性能有一定的影响. 当Cu负载量为3%、温度为50 ℃、相对湿度为50%时,有最佳穿透硫容量,最高可达220.92 mg/g.
2.2.3不同催化剂脱硫性能对比分析
为进一步分析该研究所制备催化剂的脱硫性能,对用于低温(<100 ℃)催化氧化H2S的不同催化剂进行总结,结果如表2所示. 由表2可见,已有文献中报道的炭基催化剂和金属氧化物基催化剂的穿透硫容量均未超过200 mg/g. 在反应条件差别不大的情况下,同样以Al2O3为载体的ZnO/Al2O3穿透硫容量为92 mg/g,仅为笔者研究所制CatCu3%催化剂的41%. WANG等[5]制备的三维有序大孔结构的Cu基吸附剂以及Seongwoo等[37]制备的α-FeOOH/活性炭均有良好的脱硫效果,穿透硫容量分别为137和171 mg/g,但均低于笔者所制备的催化剂的脱硫效果(220.92 mg/g). 除此之外,CatCu3%催化剂采用简单的浸渍法制备而成,制备方法简单,所用材料价格低廉,金属负载量低,制备成本低. 因此,CatCu3%催化剂具有良好的应用潜力.
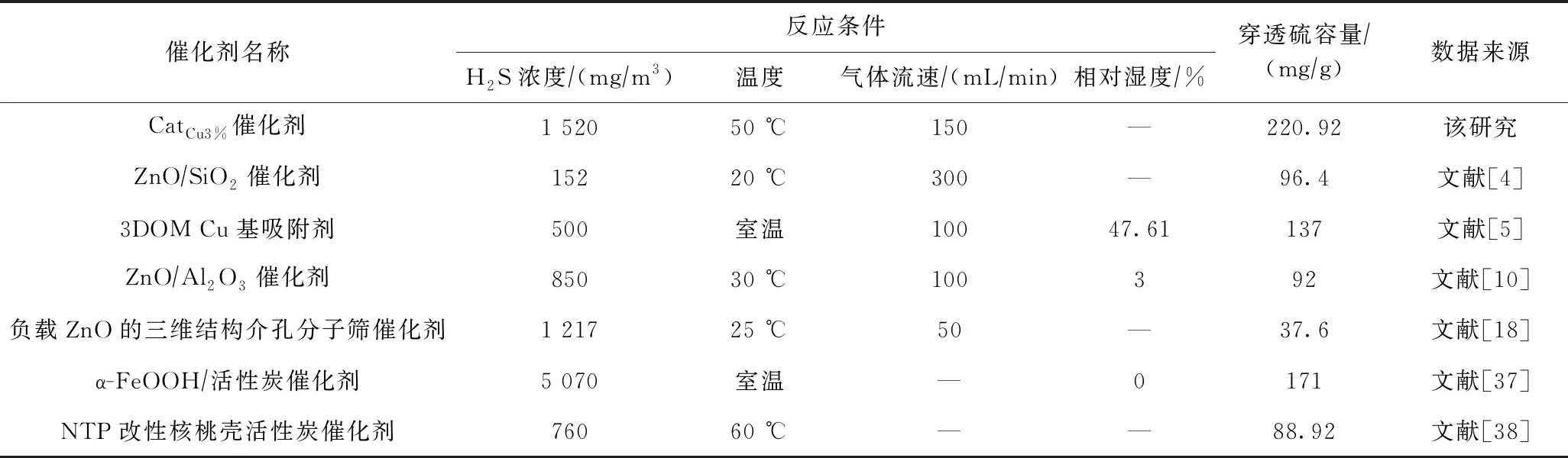
表2 用于低温催化氧化H2S的不同催化剂的对比分析
目前,许多研究已经不满足于仅利用一种活性组分制备改性催化剂,许多学者利用第二组分的添加来增强催化剂的催化性能,为以后的研究提供思路,说明Cu/Al2O3催化剂有进一步增强H2S催化氧化性能的可能性,该催化剂良好的催化性能为后续应用提供了良好的研究基础和应用可行性.
3 结论
a) 通过浸渍法研制了Cu/Al2O3催化剂,Cu基催化剂是一种典型的介孔材料,CuO和Cu2O高度分散在Al2O3载体表面.
b) 金属氧化物将H2O分解为羟基,羟基的存在能够参与H2S催化氧化反应,增加催化剂脱硫性能. 脱硫过程生成了S单质、CuS以及CuSO4.
c) 通过对不同温度和相对湿度条件下催化剂催化氧化H2S动态吸附的研究,发现适宜的温度(50 ℃)和相对湿度(50%)会显著增强催化剂的脱硫性能.
d) 催化剂的最佳穿透硫容量为220.92 mg/g,高于大部分已有研究的单组分催化剂. 但是催化剂的性能还可以通过添加第二组分进一步提高,且再生性能不明,因此以后的研究可以从双金属催化剂和再生性能方面考虑.
