硅藻通过消化道淋巴系统进入实验兔体内的途径
2022-06-21杜宇坤刘景建康晓东余仲昊郑冬云石河徐曲毅任建军刘超赵建
杜宇坤,刘景建,康晓东,余仲昊,郑冬云,石河,徐曲毅,任建军,刘超,赵建
1.南方医科大学法医学院,广东 广州 510515;2.昆明医科大学法医学院,云南 昆明 650500;3.广州市刑事科学技术研究所 法医病理学公安部重点实验室,广东 广州 510442;4.常州大学城乡矿山研究院,江苏 常州213164
在法医学实践中,水中尸体的死亡原因鉴定是法医学实践中最常见,也是最复杂的问题之一[1-2]。硅藻检验被认为是诊断溺死的可靠方法。溺水过程中,硅藻随溺液被吸入肺中,部分硅藻穿过肺泡-毛细血管屏障进入肺血管,并随血流循环到达肺、肝、肾等器官[3-5]。因此,在肺、肝、肾等器官中发现硅藻被认为是诊断溺死的支持性证据。
然而,硅藻检验诊断溺死的可靠性存在争议,主要是在非溺死者尸体的肺和肝、肾等器官中也可发现硅藻[6-10]。这些硅藻在生前已经进入体内,消化道是其可能的来源之一[5,11]。某些食物,特别是贝类,含有大量的硅藻[5]。有研究[11]发现,硅藻可通过消化道屏障进入体循环而到达组织器官,而且肺组织和心血中发现的硅藻远远大于毛细血管内皮间隙或者肝血窦直径,说明硅藻可能并不是经过消化道静脉系统进入体循环。考虑到毛细淋巴管的通透性较大,蛋白质、细菌、异物等很容易通过胞吞作用进入。因此,硅藻可能是通过消化道的淋巴系统进入体内[11-12]。
本研究通过对实验兔灌胃模拟硅藻进入消化道的过程,分析实验兔的淋巴液、肺、肝、肾组织中的硅藻含量和大小,探讨硅藻是否通过淋巴液进入体内以及其在肺、肝、肾的分布。
1 材料与方法
1.1 实验样本及分组
20只新西兰大白兔,雌雄不限,体质量2.5~3.0 kg,由北京金牧阳实验动物养殖有限责任公司提供,精神状态良好,饮食正常,在处理实验前12 h 仅喂食超纯水,分为实验组(10 只,编号A1~A10)和对照组(10 只,编号B1~B10)。本研究通过常州大学实验动物伦理委员会批准(审批号2021002)。
提取广州市区段珠江水样作为灌胃硅藻样本。植物油200 mL 用于使淋巴液呈乳白色[13]。
1.2 方法
实验组处理:使用50 mL 注射器吸取植物油10 mL和珠江水样20 mL 灌胃。灌胃30 min 后采用七氟烷吸入麻醉,麻醉完全后使用组织剪沿腹中线打开腹腔,找到肠系膜根部,可见充满乳白色淋巴液的淋巴管(图1)[14]。使用采集玻璃针吸取可见的淋巴液,依次提取肝、肾、肺,提取的样本置于-30°C 保存待检。
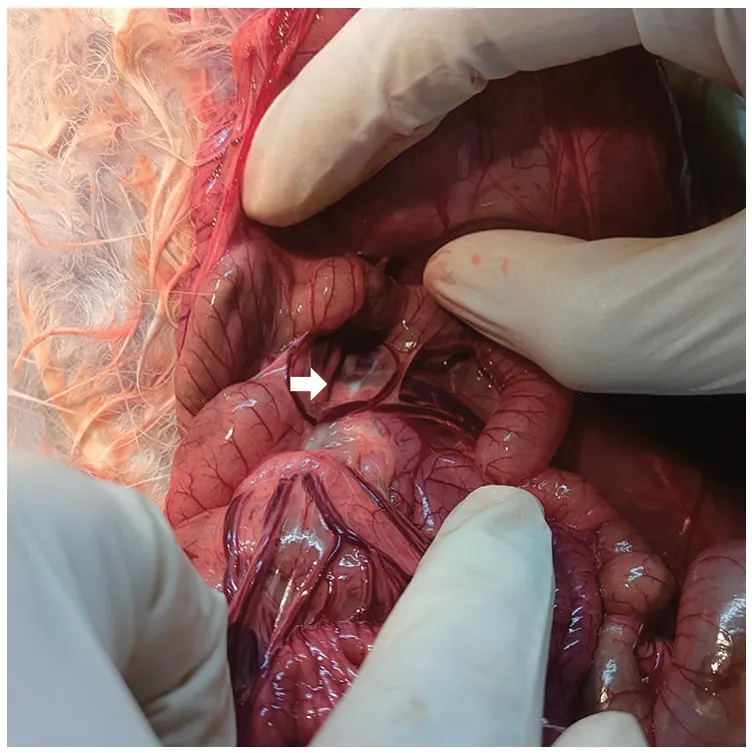
图1 植物油灌胃后淋巴液显乳白色(箭头)Fig.1 Lymph appears milky white after gavage with vegetable oil(Arrow)
对照组处理:使用50 mL 注射器吸取植物油10 mL和超纯水20 mL 进行灌胃。处理及取材同实验组。
硅藻检验:使用微波消解-扫描电子显微镜法进行硅藻检验[15]。取每只实验兔的全部淋巴液及肺、肝、肾组织各2 g 置于消解管中,加入8 mL 65%浓硝酸溶液(德国Merck 公司)和1 mL 30%过氧化氢溶液(德国Merck 公司),置于Multiwave 7000 微波消解仪(奥地利Anton Paar 公司)中进行微波消解。消解完成后使用HL-6 多联真空抽滤仪(珠海黑马医学仪器有限公司)抽滤消解液并制作电子显微镜样品座,置于Phenom XL G2 台式扫描电子显微镜(荷兰PhenomWorld 公司)下观察。记录硅藻含量、大小和种类(分类到属)。
取灌胃水样、超纯水及植物油各3 份,每份2 mL,按上述方法进行硅藻检验。
1.3 统计分析
计算硅藻含量(各组样本硅藻含量均值)和硅藻大小(各组样本所有检出完整硅藻的长径和短径平均值),数值以均数±标准差()表示,使用SPSS 24.0软件(美国IBM 公司)进行统计分析。若数据符合正态分布但不具有方差齐性,选择F检验;若数据不符合正态分布也不具有方差齐性,选择秩和检验。实验组与对照组的淋巴液硅藻阳性率和硅藻种类进行χ2检验。检验水准α=0.05。
2 结果
2.1 硅藻含量
超纯水、植物油中未检出硅藻。从表1可见,实验组淋巴液硅藻阳性率为100%(10/10),对照组淋巴液中硅藻阳性率为30%(3/10)。实验组与对照组的淋巴液硅藻阳性率比较时,总样本量n<40,故选用Fisher精确性检验,结果显示实验组阳性率高于对照组(P<0.05)。实验组与对照组的淋巴液和水样间硅藻含量不符合正态分布,故选择秩和检验,结果显示实验组淋巴液硅藻含量高于对照组(P<0.05),水样硅藻含量高于实验组淋巴液(P<0.05)。

表1 淋巴液与水样中的硅藻含量Tab.1 The concentration of diatoms of lymph and water sample
实验组中,在A4、A6、A9 3例肺样本中分别检出2、1、1 个硅藻,在A3、A6 2例肝样本中各检出1 个硅藻,肾样本中未检出硅藻。对照组中,在B4、B9 2例肺样本中分别检出1、2 个硅藻,在B2、B4、B7 3例肝样本中各检出1 个硅藻;肾样本中未检出硅藻。
2.2 硅藻种类
实验组淋巴液中检出冠盘藻、圆筛藻、小环藻、直链藻、菱形藻、针杆藻、桥弯藻和舟型藻共8 类硅藻,其中中心纲占74.4%、羽纹纲占25.6%;对照组淋巴液中检出冠盘藻、圆筛藻和小环藻共3 种硅藻,全部为中心纲;水样中检出冠盘藻、圆筛藻、小环藻、直链藻、菱形藻、针杆藻、桥弯藻和舟型藻共8 种硅藻,其中中心纲占88.7%,羽纹纲占11.3%。实验组淋巴液与水样的硅藻种类比较时,n≥40 且所有的T≥5,故选用Pearson χ2检验,结果显示,硅藻种类之间差异有统计学意义(P<0.05),实验组的中心纲硅藻比例低于水样,羽纹纲硅藻高于水样(表2)。
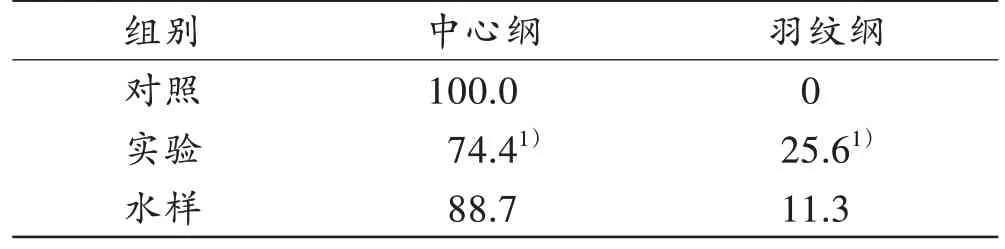
表2 淋巴液与水样的硅藻种类Tab.2 Diatom types in the lymph and water sample(%)
实验组中,肺样本中仅检出冠盘藻,肝样本中检出冠盘藻和小环藻,肾样本中未检出硅藻。对照组中,肺样本中分别检出圆筛藻和冠盘藻,肝样本中检出冠盘藻,肾样本中未检出硅藻。
2.3 硅藻大小
对照组淋巴液、实验组淋巴液和水样中检出硅藻大小如表3 所示。实验组淋巴液中硅藻长径长于对照组和水样(P<0.05);实验组淋巴液中硅藻短径长于对照组(P<0.05),而与水样中硅藻短径之间差异无统计学意义(P>0.05)。实验组淋巴液与水样的硅藻大小相关数据不符合正态分布且方差不齐,秩和检验显示实验组淋巴液的中心纲硅藻直径与水样相比差异有统计学意义(P<0.05),而羽纹纲硅藻的长径和短径与水样相比差异无统计学意义(P>0.05);实验组淋巴液中羽纹纲硅藻长径长于中心纲硅藻,而短径短于中心纲硅藻(P<0.05)。
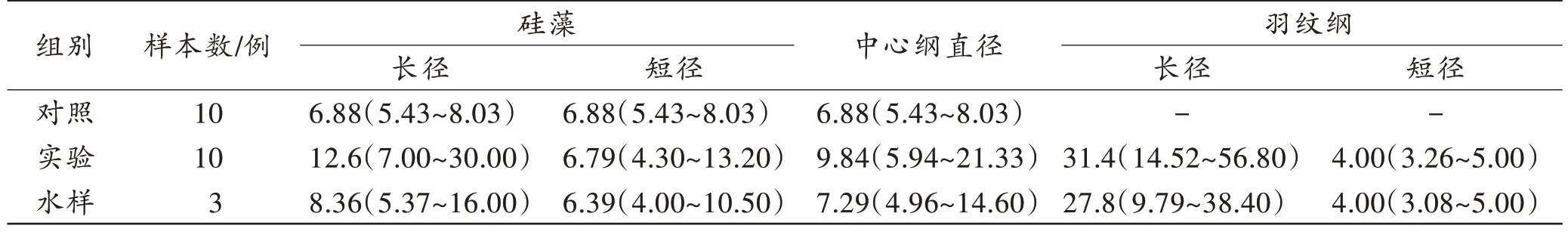
表3 淋巴液与水样中硅藻大小Tab.3 The size of diatoms in lymph and water sample [M(P25~P75),μm]
3 讨论
硅藻在非溺死尸体组织中的检出,使其诊断溺死的价值备受争议[6-9]。法医学者们一直努力找到非溺死尸体组织中硅藻的来源。HÜRLIMANN 等[4,6,16-17]研究结果表明,硅藻可随食物进入消化道而被摄入体内。张平萍的研究[11]也取得相似结果,发现肺和心血中硅藻的直径可大于100 μm,远远超过毛细血管内皮间隙或者肝血窦直径。因此,这些较大的硅藻并非通过肝静脉系统进入体内。而毛细淋巴管基膜不完整,内皮细胞薄且连接疏松,是液体和大分子物质迅速通过的主要途径,考虑硅藻可能通过淋巴系统进入体内[11-12,18]。
本研究从肠系膜根部淋巴管中提取淋巴液进行硅藻检验,结果发现,实验组淋巴液的硅藻阳性率、含量、长径、短径与对照组之间差异均有统计学意义(P<0.05),且实验组淋巴液中发现的硅藻种类与灌胃水样中的硅藻种类一致,说明灌胃水样的硅藻进入了淋巴液。实验组淋巴液中的硅藻含量低于水样(P<0.05),这是因为胃肠道的黏膜屏障阻挡了大部分的硅藻,仅有少量硅藻可以通过屏障进入淋巴液[19]。硅藻类型统计分析结果显示,实验组淋巴液中羽纹纲硅藻的比例高于水样(P<0.05),这说明羽纹纲硅藻更容易进入淋巴管。其原因可能是实验组淋巴液中羽纹纲硅藻与中心纲硅藻比较,其长径更长,短径更短,当毛细淋巴管腔扩张,内皮细胞连接处张开时,形态更细长的硅藻更容易通过内皮细胞的间隙进入淋巴液[18]。实验组淋巴液中硅藻的长径高于水样,原因是实验组淋巴液中的中心纲硅藻占74.4%,较水样低,以直径5~30 μm 的冠盘藻、圆筛藻和小环藻为主;而形状细长的羽纹纲占比25.6%,较水样高,菱形藻、针杆藻等长径分布在30~80 μm。在实验组和对照组各有5 个肺和肝组织样本检出了少量硅藻,这部分硅藻可能是在实验兔生前进入体内的。实验组肺、肝、肾组织的硅藻含量没有显著增加,其原因可能是从灌胃到提取淋巴液的时间较短,而淋巴液流速较慢,硅藻没有足够的时间随淋巴液回流进入体循环[5,18]。
综上所述,硅藻可以通过消化道淋巴系统进入体内,这可能是非溺死尸体组织器官内含有硅藻的原因之一,但是这并不能成为否定硅藻诊断溺死价值的证据。因为消化道的屏障作用导致仅有少量硅藻可以进入组织器官,非溺死尸体组织器官的硅藻含量低于溺死尸体,通过量化分析仍然可以根据硅藻检验结果诊断溺死[5,10]。
