基于RNA-seq转录组学分析一贯煎对 酒精性脂肪性肝病小鼠TGFBR2受体表达的影响
2021-05-20邱丰俊李杜朱一唯闫晓风王晓玲胡旭东
邱丰俊,李杜,朱一唯,闫晓风,叶䁎杰,王晓玲,胡旭东
上海中医药大学基础医学院,上海 201203
酒精性脂肪性肝病(alcoholic fatty liver disease,AFLD)是长期过量饮酒而导致肝脏的早期病变,主要以肝脏中脂质沉积为特征[1]。酒精已成为慢性肝病的主要因素之一[2]。Ohashi等[3]发现,约90%酗酒者会发展为AFLD,并进一步发展成酒精性肝炎、肝纤维化,甚至肝硬化等。因此,防治AFLD对遏制肝脏不可逆损伤从而截断酒精性肝病进程有重要意义。一贯煎是养肝阴、疏肝气中医经典方剂,对酒精性肝病患者有良好的降脂和保肝作用[4],但一贯煎治疗AFLD的具体分子机制尚未阐明。因此,本研究通过AFLD小鼠模型和细胞模型,探讨一贯煎防治AFLD的潜在信号通路。
1 实验材料
1.1 动物和饲料
C57BL/6雌性小鼠24只,8周龄,体质量18~22 g,购于上海西普尔-必凯实验动物有限公司,动物生产许可证号SCXK(沪)2018-0006,动物使用许可证号SYXK(沪)2014-0008。饲养于上海中医药大学实验动物中心SPF级饲养室,动物伦理审查编号PZSHUTCM190712014。Lieber-DeCarli液体饲料(TP4030C、TP4030D),购于江苏南通特洛菲饲料科技有限公司。
1.2 细胞和药物
AML12小鼠肝细胞株(ATCC编号CRL-2254),购于中国科学院细胞库。一贯煎(生地黄18 g,北沙参10 g,麦冬10 g,当归10 g,枸杞子12 g,川楝子4.5 g),饮片购自上海康桥中药饮片有限公司,按原方比例和制法由上海中医药大学附属曙光医院国家中医药管理局中药制剂中心制成流浸膏,再由上海中医药大学中药学院制成干粉(批号20180515),冷藏保存,每克干粉含原药材2.196 g。
1.3 主要试剂与仪器
无水乙醇(沪式10009218AR)、二甲基亚砜(沪式30072418AR),国药集团化学试剂有限公司;胰酶(货号25200-072)、DMEM/F12培养基(货号12400-024)、胰岛素-转铁蛋白-硒(货号41400-045),Thermo Fisher Scientific公司;地塞米松(货号D1756),Sigma公司;青-链霉素溶液(货号GNM15140),吉诺生物医药技术有限公司;Nile Red荧光染料(货号HY-D0718)、DAPI荧光染料(货号HY-D0814),MCE公司;总RNA提取试剂盒(货号15596026),Life Technologies公司;反转录试剂盒(货号K1622),Thermo Fisher Scientific公司;扩增试剂盒(货号M3003L),Luna公司;丙氨酸氨基转移酶(ALT)试剂盒(货号C009-1)、天冬氨酸氨基转移酶(AST)试剂盒(货号C010-1)、三酰甘油(TG)测试盒(货号A110-1),南京建成生物工程研究所;TGFBR2抗体(货号abs101230)、SLC2A4抗体(货号abs131486),爱必信(上海)生物科技有限公司。Forma371细胞培养箱(Thermo Fisher Scientific公司),BSC-1600IIB2生物安全柜(上海上净净化设备有限公司),5418R低温离心机(Eppendorf公司),Axiovert40 CFT荧光倒置生物显微镜(徳国Zeiss公司),Synergy 2酶标仪(BioTek公司),LightCycler96实时荧光定量PCR仪(Roche公司)。
2 实验方法
2.1 造模及给药
将小鼠随机分为对照组、模型组和一贯煎组,每组8只。按照文献[5]方法制备AFLD小鼠模型。对照组给予Lieber-DeCarli液体饲料(TP4030C)喂养15 d;模型组和一贯煎组先予Lieber-DeCarl液体饲料(TP4030C)适应性喂养5 d,再连续喂食含5.0%乙醇的Lieber-DeCarli液体饲料(TP4030D)10 d。同时一贯煎组每日给予一贯煎溶液灌胃,对照组和模型组按体质量给予等体积生理盐水灌胃。第16日上午,对照组和模型组予等体积生理盐水灌胃,一贯煎组予一贯煎溶液灌胃;1 h后模型组和一贯煎组按20 μL/g小鼠体质量给予31.5%乙醇(V/V)灌胃,对照组按相同剂量予45.0%糊精(W/V)灌胃;9 h后(期间禁食不禁水)处死所有小鼠,取肝组织备用,血液标本以3000 r/min离心15 min,取上层血清分装备用。
一贯煎溶液配制:每次称取一定量一贯煎干粉,生理盐水溶解,配制成浓度为含原药材0.793 8 g /mL一贯煎溶液,预热后每日给予7.938 g/kg(按65 kg成人体质量临床用量8倍)剂量进行小鼠灌胃[6]。
2.2 HE染色
石蜡切片,脱蜡至水(将切片依次放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、75%酒精5 min,自来水洗);苏木素染色(将切片放入苏木素染液染3~5 min,自来水洗,分化液分化,自来水再洗,返蓝液返蓝,流水冲洗);伊红染色(将切片依次放入85%、95%酒精分别脱水5 min,然后放入伊红染液中染色5 min);脱水封片(将切片依次放入无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、无水乙醇Ⅲ 5 min、二甲苯Ⅰ 5 min、二甲苯Ⅱ 5 min透明,中性树胶封片);显微镜观察,图像采集分析。
2.3 油红O染色
油红O染色法常用于组织内TG等中性脂肪的特异性染色。按贮备液∶稀释液=5∶2配制油红O应用液,配好后滤纸过滤2遍,去除残渣。将肝组织冰冻切片放置在切片架上,室温回温10 min,然后将切片放入装有油红O应用液的染缸中染色13 min,37 ℃蒸馏水洗20 s,复染液中染色5 min,自来水洗60 s,表面水分干透前滴加水性封固剂加盖玻片封片,镜下观察肝组织内脂肪生成情况。
2.4 丙氨酸氨基转移酶、天冬氨酸氨基转移酶和三酰甘油含量测定
将5 μL血清样本和不同浓度标准品分别加入96孔板,各孔分别加入20 μL基质液,37 ℃水浴孵育30 min;各孔分别加入20 μL 2,4-二硝基苯肼液,37 ℃水浴孵育20 min;各孔分别加200 μL 0.4 mol/L氢氧化钠溶液,室温放置15 min,于酶标仪波长510 nm处测定各孔OD值,采用标准曲线法计算血清ALT、AST含量。将2.5 μL血清样本加入96孔板,同时设校准孔和空白孔;加入200 μL工作液,37 ℃水浴孵育10 min,于酶标仪波长510 nm处测定各孔OD值,计算TG含量。TG(mmol/L)=(样本OD值- 空白OD值)÷(校准OD值-空白OD值)×校准品浓度(2.26 mmol/L)。
2.5 RNA-seq转录组学分析
2.5.1 测序
根据试剂盒(RNAiso Plus试剂盒和RNeasy Mini试剂盒)的标准操作流程分别抽取各组小鼠肝组织样本总RNA,所得总RNA经Agilent Bioanalyzer 2100电泳质检合格后,使用RNAClean XP Kit和RNase-Free DNase Set对总RNA进行纯化。将纯化后的总RNA进行mRNA的分离、片段化、第一链cDNA合成、第二链cDNA合成、末端修复、3’末端加A、连接接头、富集等步骤,完成测序样本文库构建。所建文库分别采用Qubit®2.0 Fluorometer检测其浓度,Agilent2100检测文库大小。依据cBot操作指南中的相应流程,采用Illumina测序仪配套的cBot完成cluster的生成和第一向测序引物的杂交。依据Illumina User Guide提供的测序试剂,将带有cluster的流动池上机,用paired-end程序进行双端测序。并采用Illumina提供的数据收集软件对测序进行控制,同时进行实时数据分析。
2.5.2 数据预处理
通过Seqtk(https∶//github.com/lh3/seqtk)对测序所得读长进行筛选,主要过程:去除读长中的接头序列;去除3’端质量Q<20的碱基(碱基错误率<0.01);去除长度<25的读长;去除所属物种的核糖体RNA数据。用筛选后的测序读长进行下一步分析。
2.5.3 基因表达差异性分析和KEGG富集
为获得样品的可比较差异基因数据,通过StringTie软件计数、TMM(M值的修剪平均值)标准化和perl脚本计算3个步骤将测序读长转换为FPKM(每百万映射读长外显子模型的每千个碱基片段),从而将基因表达标准化。采用edgeR[7]进行样本间差异基因分析,得出P值后进行多重假设检验校正,通过控制FDR(false discovery rate)决定P的阈值,校正后的P值即q值。同时,根据FPKM值计算差异表达倍数。差异基因筛选条件如下:q≤0.05,差异表达倍数≥2。以上实验委托上海伯豪生物技术有限公司完成。
筛选出模型组和正常组的差异表达基因及一贯煎组和模型组的差异表达基因后,将筛选出的差异基因作进一步交集分析,并将交集中的差异表达基因导入DAVID Bioinformatics Resources 6.8(https∶//david. ncifcrf.gov/summary.jsp)完成KEGG通路富集分析。
2.6 RT-qPCR检测
将RNA-seq转录组测序后返回的肝组织样本总RNA进行部分基因的RT-qPCR实验,检验RNA-seq转录组测序结果的可靠性。首先将样本总RNA反转录合成cDNA,并进一步扩增,用2-ΔΔCt法定量分析,以GAPDH为内参,检测各组样本中FOXO信号通路(KEGG富集所得分析差异最显著的信号通路)相关基因表达变化。所有引物由北京鼎国昌盛生物技术有限责任公司合成,引物序列见表1。

表1 各基因PCR引物序列
2.7 细胞培养及给药
称取0.301 g一贯煎干粉(每克干粉含原药材2.196 g),溶于3 mL完全培养液,制成原药材浓度为220 mg /mL的一贯煎母液,0.22 μm滤膜过滤,每管50 μL分装,-80 ℃冰箱保存备用。
将AML12细胞按104cells/孔接种于96孔板,使用含10%FBS、1%ITS、40 ng/mL地塞米松的DMEM/F12培养基,37 ℃、5%CO2、95%湿度培养箱中培养。根据实验设计对照组、模型组(50 mmol/L酒精)、一贯煎组(50 mmol/L酒精+一贯煎900、300、100、33 μg/mL)、TGFBR2抗体组(50 mmol/L酒精+TGFBR2抗体500、50、5 ng/mL)、SLC2A4抗体组(50 mmol/L酒精+SLC2A4抗体500、50、5 ng/mL),加入相应试剂后分别孵育24 h,待测。
2.8 Nile Red染色
Nile Red是一种广泛使用的亲脂性荧光染料,可用于评价细胞中TG等中性脂肪的含量[8]。将孵育24 h的96孔板从培养箱中取出,吸去细胞上清液,PBS洗3次;10%中性福尔马林常温固定细胞20 min,PBS洗3次;用1 μg/mL Nile Red染液37 ℃染色10 min,PBS洗3次;37 ℃、1 μg/mL DAPI染细胞核10 min,PBS洗3次,荧光显微镜下拍照,用Image J软件进行数据处理。
3 统计学方法
采用GraphPad8.0统计软件进行分析。实验数据以±s表示,不同样本之间比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 HE染色结果
模型组酒精液体饲料喂养后,小鼠肝细胞呈脂肪样空泡,气球样变明显,肝索结构紊乱;一贯煎组小鼠肝细胞内空泡状物质减少,气球样变减少。见图1。
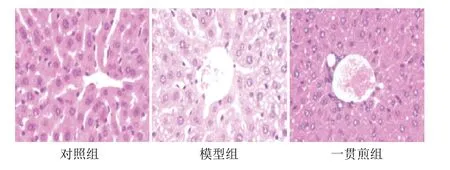
图1 各组小鼠肝组织形态(HE染色,×200)
4.2 油红O染色结果
模型组小鼠肝组织中红色脂滴含量增加,且脂滴明显变大;一贯煎组脂滴变小,含量降低。见图2。
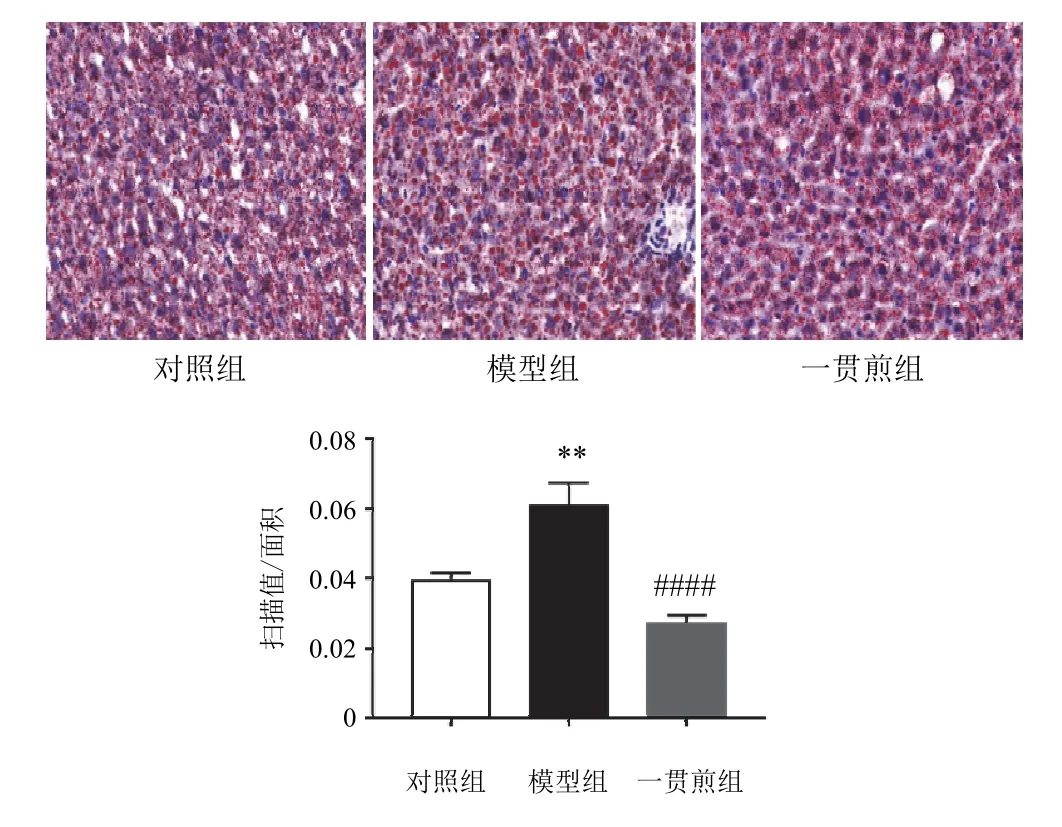
图2 各组小鼠肝组织TG含量比较(油红O染色,×200,±s,n=3)
4.3 一贯煎对模型小鼠血清丙氨酸氨基转移酶、天冬氨酸氨基转移酶和三酰甘油含量的影响
与对照组比较,模型组小鼠血清ALT、TG含量显著增加,差异有统计学意义(P<0.000 1);与模型组比较,一贯煎组小鼠血清ALT、TG含量显著减少,差异有统计学意义(P<0.000 1);模型组、一贯煎组血清AST含量较对照组均增加,但差异无统计学意义(P>0.05)。见图3。
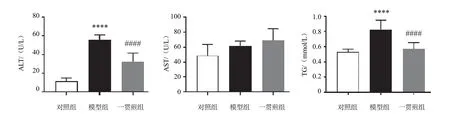
图3 各组小鼠血清ALT、AST、TG含量比较(±s,n=3)
4.4 靶点基因及主要靶点通路筛选结果
与对照组比较,模型组817个基因显著上调,358个基因显著下调;与模型组比较,一贯煎组197个基因显著上调,347个基因显著下调。为明确一贯煎防治AFLD小鼠主要靶点基因,对模型组与对照组及一贯煎组与模型组的差异表达基因进行交集分析。共得到133个靶点基因,其中模型组表达降低、一贯煎干预后表达升高的靶点基因33个;模型组表达升高、一贯煎干预后表达降低的靶点基因100个。将交集分析所得的133个靶点基因进一步通过KEEG数据库进行信号通路富集。结果显示,靶点基因在FOXO通路上富集最为显著(P=8.8E-3),共有5个靶点基因分布在该通路,分别是TGFBR2、SLC2A4、KLF2、SGK2、TNFSF10(见表2、图4),其中TGFBR2和SLC2A4是细胞膜受体蛋白。该结果提示,一贯煎可能通过TGFBR2和SLC2A4介导的信号通路发挥防治小鼠AFLD的作用。
4.5 RT-qPCR验证结果
差异基因RT-qPCR检测结果与RNA-seq测序结果一致,见图5、表3。
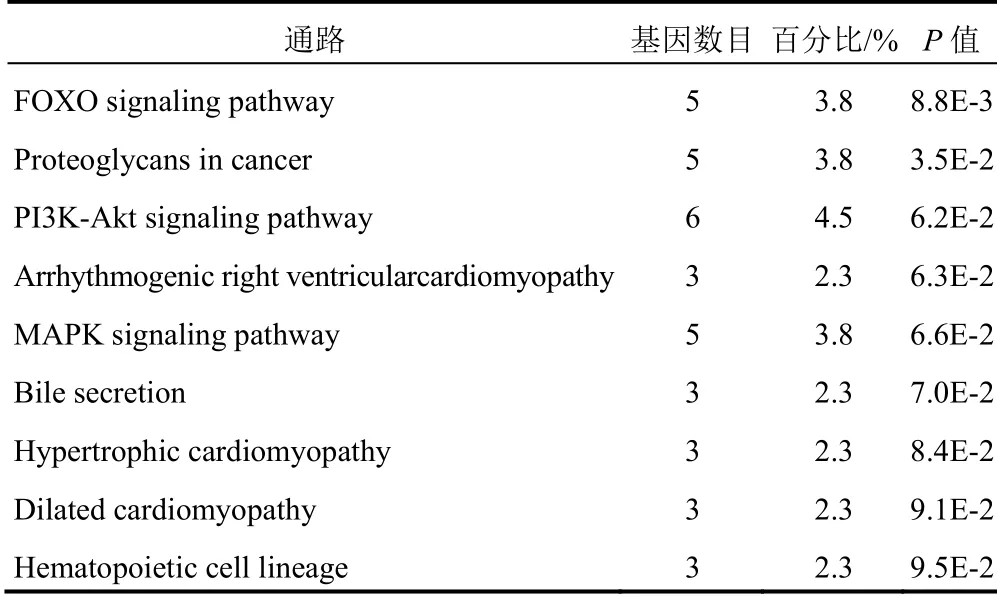
表2 一贯煎防治小鼠AFLD靶点基因KEGG通路富集结果
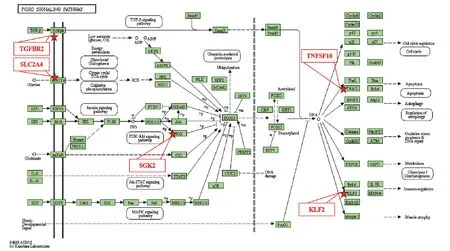
图4 一贯煎治疗AFLD关键靶点及其相关信号通路示意图
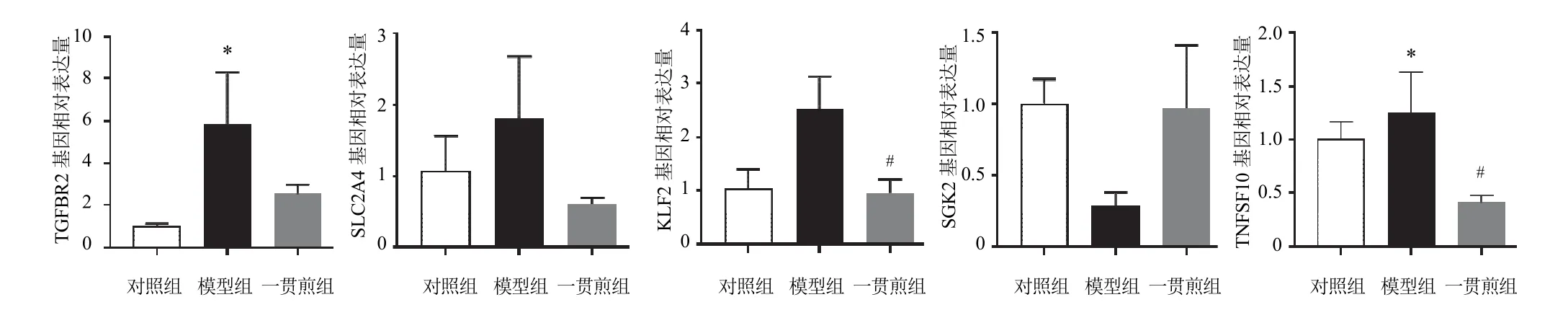
图5 各组小鼠肝组织TGFBR2、SLC2A4、KLF2、SGK2、TNFSF10基因表达比较(±s,n=3)
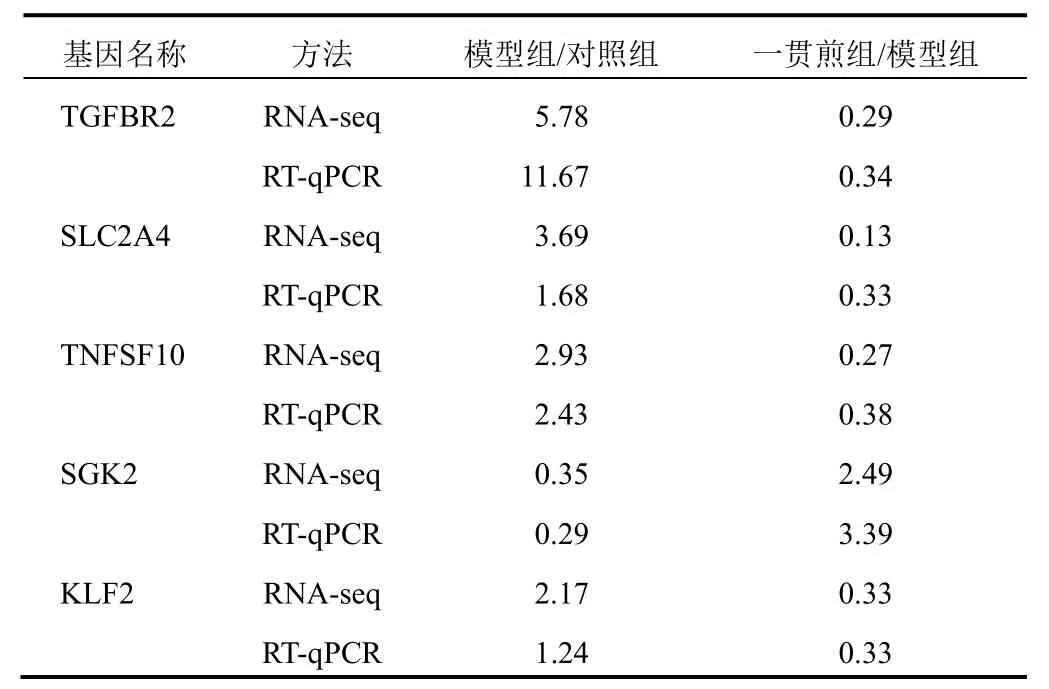
表3 FOXO通路差异基因表达变化倍数
4.6 TGFBR2和SLC2A4抗体对AML12细胞脂肪变性的影响
小鼠肝组织RNA-seq转录组测序结果表明,细胞膜受体蛋白TGFBR2和SLC2A4可能在小鼠肝细胞脂肪变性过程中发挥重要作用,因此后续通过酒精体外诱导肝细胞脂肪变性进行进一步验证。分别使用浓度为500、50、5 ng/mL的TGFBR2和SLC2A4抗体与50 mmol/L酒精同时孵育AML12细胞。结果显示,各浓度SLC2A4抗体对酒精诱导的AML12细胞内脂质生成作用差异无统计学意义(P>0.05);TGFBR2抗体50、5 ng/mL能显著抑制酒精诱导的AML12细胞内脂质生成(P<0.05),且50 ng/mL TGFBR2抗体降脂效果更明显,差异有统计学意义(P<0.001),见图6。提示TGFBR2与肝细胞酒精性脂肪变性密切相关,后续研究选用50 ng/mL的TGFBR2抗体进行实验。
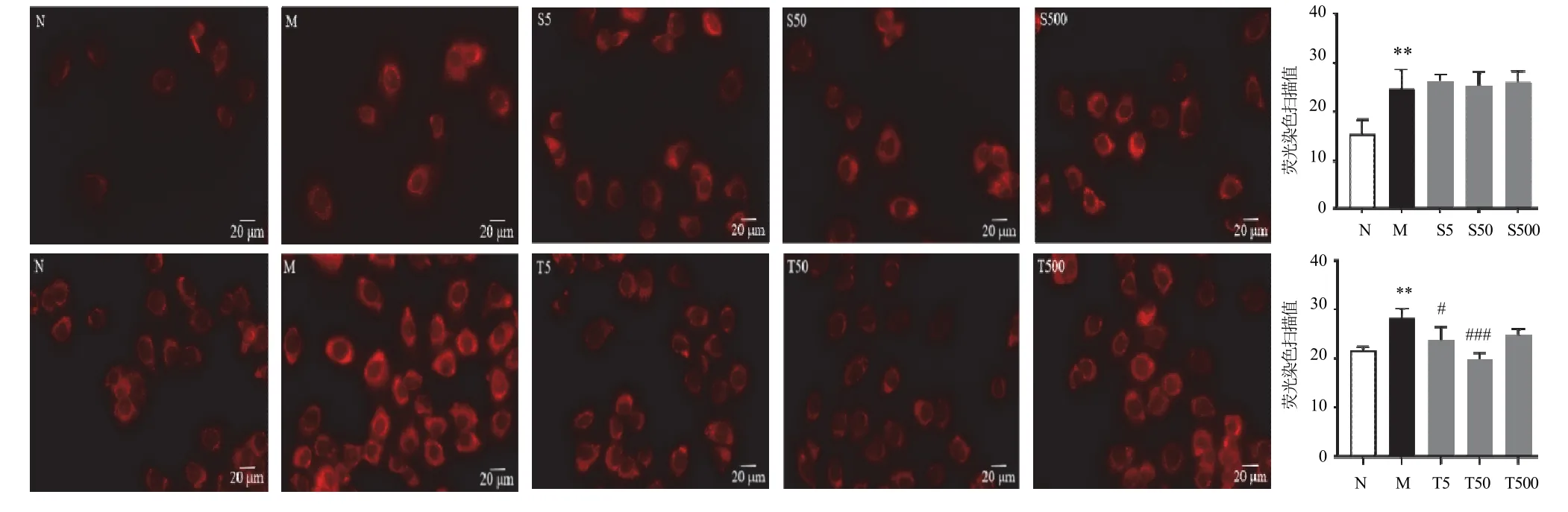
图6 不同浓度TGFBR2和SLC2A4抗体对AML12细胞脂肪变性的影响(Nile Red染色,±s,n=3)
4.7 一贯煎对酒精诱导的AML12细胞脂肪变性的影响
为验证一贯煎对酒精诱导肝细胞脂肪变性的影响,将原药材浓度分别为900、300、100、33 μg/mL一贯煎溶液与50 mmol/L酒精同时孵育AML12细胞24 h,结果300 μg/mL一贯煎溶液抑制脂质生成效果最明显(P<0.001),见图7。因此,后续研究选用浓度为300 μg/mL一贯煎溶液进行实验。
4.8 一贯煎和TGFBR2抗体对AML12细胞脂肪变性的影响
将300 μg/mL一贯煎溶液和50 ng/mL TGFBR2抗体单独或联合与50 mmol/L酒精共同孵育AML12细胞。结果300 μg/mL一贯煎、50 ng/mL TGFBR2抗体、300 μg/mL一贯煎+50 ng/mL TGFBR2抗体均能显著减轻酒精诱导的AML12细胞内脂质生成,差异有统计学意义(P<0.000 1),见图8。提示一贯煎可能通过TGFBR2通路减轻酒精诱导的AML12细胞脂肪变性。
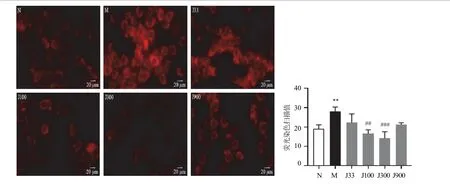
图7 不同浓度一贯煎对酒精诱导的AML12细胞脂肪变性的影响(Nile Red染色,±s,n=3)
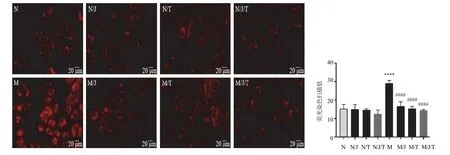
图8 一贯煎和TGFBR2抗体对AML12细胞脂肪变性的影响(Nile Red染色,±s,n=3)
5 讨论
一贯煎出自《续名医类案》,由北沙参、麦冬、当归、生地黄、枸杞子、川楝子6味中药组成[9],主治肝肾阴虚证,可统治胁痛、吞酸、吐酸、疝瘕一切肝病[10]。临床研究发现,其对酒精性肝病具有一定作用[4]。研究表明,一贯煎可降低酒精性肝损伤大鼠血清ALT、AST、碱性磷酸酶和总胆红素等水平,对酒精灌胃所致大鼠肝细胞损伤有一定防治作用[11]。此外,一贯煎具有抗脂肪肝功能[12],但防治AFLD的分子机制尚无报道。本研究通过一贯煎灌胃给药作用于AFLD模型小鼠,结果显示其可显著降低小鼠血清ALT、TG含量,减轻小鼠肝损伤及肝脏脂肪变性。体外细胞实验也表明,一贯煎可显著减轻酒精诱导的AML12细胞脂肪变性。
RNA-seq转录组测序技术又称全转录组鸟枪法测序,主要以高通量测序技术为基础,将mRNA、small RNA和non-coding RNA等通过高通量测序技术检测其碱基序列[13]。针对中药具有多组分、多靶点的特点,为进一步明确一贯煎改善小鼠AFLD的分子机制,本实验采用RNA-seq转录组测序技术检测小鼠肝组织基因表达,共发现了133个差异表达基因。通过差异表达基因的KEEG通路富集分析发现,FOXO信号通路基因关联度最高(P=8.8E-3),TGFBR2、SLC2A4、TNFSF10、KLF2、SGK2这5个基因富集于FOXO信号通路,其中TGFBR2和SLC2A4是膜受体蛋白。进一步的体外细胞实验显示,拮抗TGFBR2受体蛋白可显著减轻酒精诱导的肝细胞脂肪变性,但拮抗SLC2A4受体蛋白并不能减轻酒精诱导的肝细胞脂肪变性,表明TGFBR2介导的信号通路在小鼠AFLD进程中起到更重要的作用。细胞实验结果还显示,一贯煎、TGFBR2抗体单用或联用均能显著减轻酒精诱导的肝细胞内脂质生成,但三者作用相互间无明显差异,提示一贯煎可能通过TGFBR2通路减轻酒精诱导的AML12细胞脂肪变性。
金云云[14]发现,TGFBR2与成脂细胞分化和凋亡相关;Yang等[15]使用肝细胞特异性TGFBR2基因敲除小鼠研究发现,TGFBR2缺失后可通过增加与β氧化相关基因的表达减轻胆碱缺乏饲料诱导的肝细胞脂肪变性和炎症。可见TGFBR2与调控细胞脂质代谢有关。本研究发现,TGFBR2通路与AFLD联系密切,但具体分子机制尚需进一步探索和阐明。
综上所述,一贯煎可能通过影响小鼠肝细胞膜受体蛋白TGFBR2介导的信号通路,减少细胞内脂质沉积,从而减轻酒精诱导的肝细胞脂肪变性,起到防治AFLD的药理效应。
