废磷酸铁锂全组分资源化及杂质定向控制
2021-05-19祝宏帅袁中直薛银银刘金成
祝宏帅, 张 欢, 袁中直, 陈 超, 薛银银, 刘金成
(湖北金泉新材料有限公司, 湖北 荆门 448000)
1 前 言
锂离子电池具有环境友好、能量密度大、输出电压高、使用寿命长、无记忆效应等优点,在新能源汽车行业、储能领域得到广泛应用,有效缓解了资源消耗、工业发展对人类生存环境造成的巨大压力[1-3]。然而,巨大的锂离子电池生产消费带来了许多废锂离子电池。锂离子电池的正极材料、电解液、隔膜等物质依然具有易燃性、浸出毒性、腐蚀性等对环境及人类健康有害的性质[4],如果不能对废锂离子电池进行有效回收利用,将会给人类生存环境带来灾难性的危害。锂离子电池报废后,组成元素本身仍然存在,而废锂离子电池回收是对“城市矿产”的资源化利用,促进新能源产业链闭环[5]。锂离子电池产品按照所使用的正极材料分类主要有:磷酸铁锂电池、三元电池、钴酸锂电池等,废锂离子电池的回收也主要是回收正极材料中的有价金属元素[6-7]。废三元、钴酸锂中含有大量钴、镍、锂元素,回收价值较高,相应的研究报道也较多[8-9],废磷酸铁锂中仅锂元素的价值较高,国内许多电池回收厂家也仅回收其中的锂元素。随国内锂盐价格逐年下降,电池回收厂家不得不亏本对磷酸铁锂电池进行处理,因而废磷酸铁锂全组分高值化回收利用技术研究刻不容缓[10-11]。
废磷酸铁锂电池经过破碎、分选、筛分处理后,得到废磷酸铁锂粉。用碱溶等方法除去废磷酸铁锂粉中的铝杂质后,引入锂、铁、磷源以调整此3 种元素的摩尔比,然后加入蔗糖、分散剂,经球磨、煅烧后即可重新合成磷酸铁锂材料[12]。杨则恒等[13]将废磷酸铁锂与乙炔黑、聚偏氟乙烯(polyvinylidene fluoride,PVDF)按照质量比80:15:5 混合后重新做成正极片,并以金属锂作为负极组装成半电池。通过不断的小电流充放电循环,使负极的锂补充到失效的正极材料中,达到修复再生的目的。此类修复法在环保和资源化效率方面的表现均十分优秀,具有广阔的应用前景。但是修复法首先要求分离出洁净的废磷酸铁锂,而目前的分离技术还需要持续改进才能达到实际应用的要求,另外,与首次合成的磷酸铁锂材料相比,修复材料性能参差不齐,容量密度、充放电性能均有所下降[12,14]。Shin 等[15]先通过湿法工艺合成晶型FePO4·2H2O,然后与锂源、碳源混合后在700 ℃混合煅烧,重新合成LiFePO4/C 电池材料。Yang等[16]提出,将废磷酸铁锂氧化浸出后,采用氨水将溶液pH 值调至5~6,沉淀出非晶态的FePO4·xH2O 重新用于磷酸铁锂制备,含锂溶液用于制备锂盐。采用氢氧化钠溶解铝元素,高酸浸出锂,锂回收率高,但消耗大量碱进行中和,同时会引入钠杂质[17-18]。采用磷酸和双氧水作为浸取剂处理废磷酸铁锂粉,可以直接获得纯度较高的磷酸二氢锂精制溶液,但这种方法一方面会使铝、铜、镁等金属杂质和磷酸铁一起沉淀,导致磷酸铁水合物滤饼难以再利用;另一方面,磷酸二氢锂精制溶液应用范围窄,难以直接用于生产碳酸锂、氯化锂等常用锂盐[19]。
为了实现废磷酸铁锂粉中锂、铁、磷元素全组分高值化利用,需要将系统中铝、铜、镁等杂质元素进行定向控制、排出系统,得到的锂盐的精制溶液可经蒸发、干燥工序直接产出工业级锂盐产品,而磷酸铁水合物滤饼经酸化后可用于制备电池级磷酸铁。本文根据对系统热力学分析结果,以盐酸、双氧水作为浸取剂,以氢氧化锂作为除杂剂开展实验研究。
2 实 验
2.1 实验材料
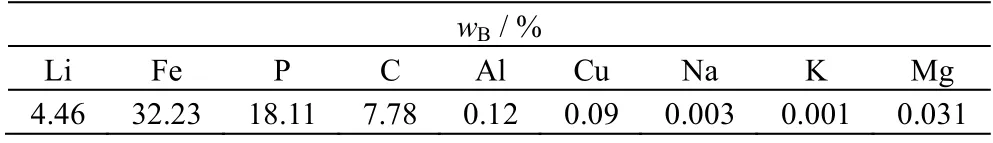
表1 实验原料成分Table 1 Composition of the experimental raw material
本研究所用的废磷酸铁锂粉,由本公司报废磷酸铁锂电池经粉碎分选系统处理后输出,成分分析结果列于表1。表中wB为质量分数,由表1 可知,此磷酸铁锂粉中的主要杂质金属元素为铝、铜、镁。其中铝、铜来源于正负极集流体,而镁是磷酸铁锂材料自带的杂质元素。实验中所用的盐酸、双氧水、单水氢氧化锂均为分析纯,由长沙升阳化工材料有限公司提供。
2.2 实验设备及测试仪器
本研究所用实验设备:DF-101S 集热式恒温加热油浴锅;JJ-1 型机械搅拌机;SHZ-D( Ⅲ)水循环式多用真空泵;BT100-2J 型蠕动泵。本研究所用分析仪器:电感耦合等离子体发射光谱仪 Agilent 710 ICP-OES,用于样品中Li、Fe、Al、Cu、Mg、Na、K、P 元素的检测;电子微量天平(精度为±0.1 mg) Sartorius BP211D,用于样品称重。
2.3 实验方法
1) 调浆:水与磷酸铁锂粉料按液固质量比m(H2O):m(磷酸铁锂)=2:1 置于反应釜内调浆并以一定的转速持续搅拌,然后将浆料预热至指定温度。
2) 氧化浸取:用蠕动泵将指定剂量的盐酸、双氧水分别以均匀的速度在指定时间内加入反应釜内。
3) 沉淀铁、磷:向反应釜中加入LiOH·H2O,将系统pH 值调至指定值并稳定0.5 h 后过滤,实现浸出液与磷酸铁水合物滤饼的分离。
4) 定向除杂:向浸出液中加入LiOH·H2O,将系统pH 值调至指定值,稳定0.5 h 后过滤,实现氯化锂粗溶液与系统中残存的铁、磷、铜、铝杂质滤渣的分离。
5) 除镁:采用LiOH·H2O 将氯化锂粗溶液的pH 值调至11.0~11.5,使剩余的微量镁杂质以氢氧化镁的形式沉淀出来。过滤,采用盐酸将滤液的pH 值调回7.0~8.0,即可得到氯化锂精制溶液。具体工艺流程图如图1 所示。锂的浸出率、回收率均按式(1)进行计算。

式中:x(Li)为锂的浸出率(或回收率),%;V 为氯化锂溶液的体积,L;ρ(Li+)为氯化锂溶液中锂离子的质量浓度,g·L-1;w(Li+)为废磷酸铁锂原料中锂的质量分数,%;m 为废磷酸铁锂原料质量,g;m0(Li)为加入LiOH·H2O 的质量,g。

图1 工艺流程图Fig.1 Process flow chart
3 实验结果与讨论
3.1 实验原理

在该系统中,可能存在的电离及沉溶平衡反应列于表2,可能存在的络合平衡列于表3(由于系统中Al 杂质的量较少且AlPO4是Al3+的主要沉淀方式,因此在沉溶平衡计算中只考虑铝离子的单核配合物[21])。表2 中,Ka1~Ka3分别为磷酸的1~3 级解离常数;Ksp1~Ksp7分别表示相应难溶盐的溶度积。表3 中,i 表示金属阳离子对阴离子的配合数;lg βi表示累积稳定平衡常数的对数。根据提锂过程中HCl 溶液浓度以及除杂实验液相中磷元素常规残留浓度实际情况,可设总氯浓度cT(Cl)=3 mol·L-1,总磷浓度cT(P)分别为0.1、0.000 1 mol·L-1。首先根据式(5)计算磷酸根的浓度c(PO43_),并将其代入式(6)~(10)计算出5 种游离金属离子的浓度;然后根据式(11)及表3 中的累积稳定平衡常数的对数lg βi计算出溶液中各金属络合物离子的浓度;最后根据物料平衡式(10)、(12)~(15)计算出溶液中可溶解的5 种金属元素的总量,将计算结果图形化可得如图2、3 所示,图2、3 中lg [cT(M)]表示包含M 型阳离子的所有配合物、简单离子的摩尔浓度之和的对数。由图2 可知,在pH=0.8~2.0 时,锂、镁、铜均不易沉淀;铝元素沉淀趋势较弱;铁元素易于沉淀,且铁的沉淀趋势远强于铝。系统中的铝元素较少,因此可以在此pH 段将铝、镁、铜杂质元素保持在浸出液中,获得纯度较高的磷酸铁水合物。在pH=7.0~8.0 时,铝、铁、铜杂质元素均有较强的沉淀趋势,因此可在此阶段实现浸出液的定向除杂。由图3 可知,当系统中cT(P)较低时需要将pH调至11.0~11.5,促使系统中微量的镁元素以Mg(OH)2的形式沉淀。

表2 系统中的电离及沉溶平衡[22-23]Table 2 Ionization and precipitation equilibrium in the system[22-23]

表3 系统中的络合平衡Table 3 Complexation equilibrium in the system

图2 cT(Cl)=3 mol·L-1、cT(P)=0.1 mol·L-1,系统中的沉溶平衡Fig.2 Equilibrium of precipitation and dissolution in the system (cT(Cl)=3 mol·L-1, cT(P)=0.1 mol·L-1)
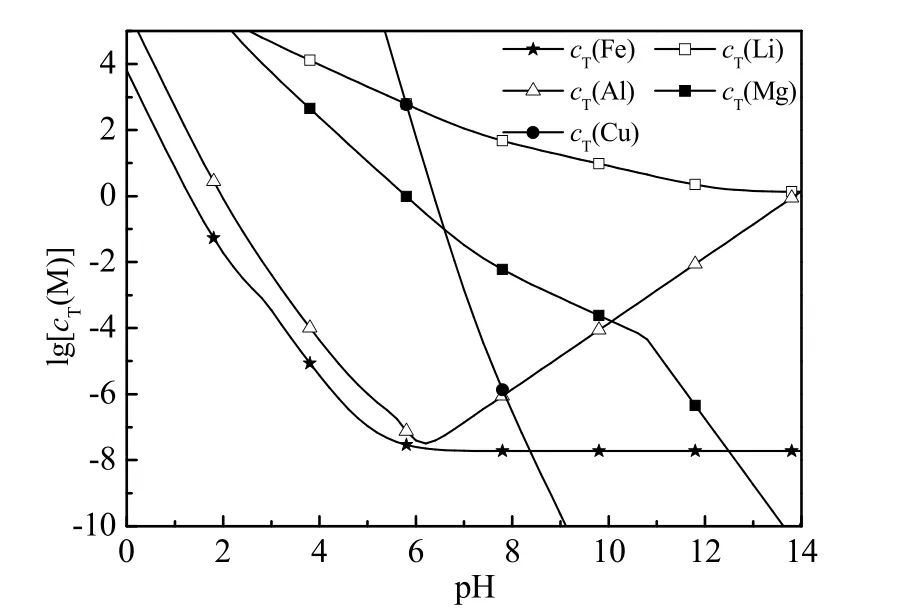
图3 cT(Cl)=3 mol·L-1、cT(P)=0.000 1 mol·L-1,系统中的沉溶平衡Fig.3 Equilibrium of precipitation and dissolution in the system (cT(Cl)=3 mol·L-1, cT(P)=0.000 1 mol·L-1)
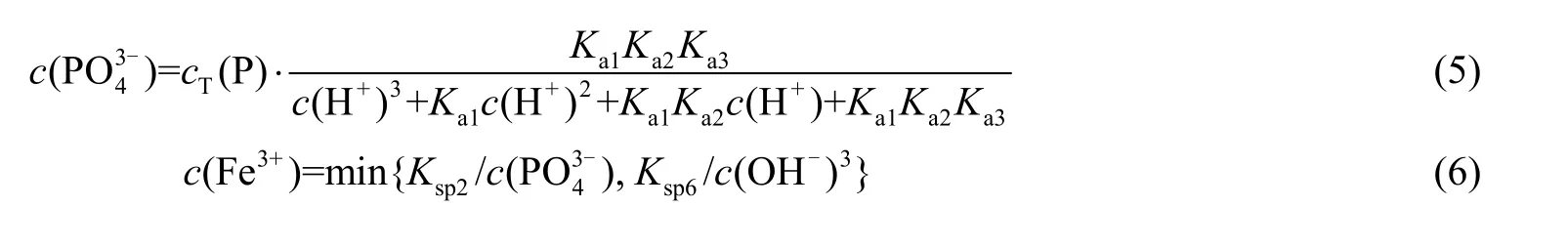

式中:cT(P)、cT(Li)、cT(Fe)、cT(Al)、cT(Mg)、cT(Cu)分别为溶液中含有P、Li、Fe、Al、Mg、Cu 元素的离子的总浓度;c(M)为溶液中M 型阳离子的浓度,M 为Li+、Fe3+、Al3+、Mg2+、Cu2+;c(L)为溶液中L型阴离子的浓度,L 为OH-或Cl-;c(MLi)为溶液中MLi型络合离子的浓度。
3.2 氧化浸出
为了研究氧化浸出阶段各实验条件对锂浸出率的影响,本小节是在指定实验条件下对废磷酸铁锂进行氧化浸出后直接取样,检测滤液中锂的浓度及滤渣中锂的质量分数,按照式(1)计算锂的浸出率。
3.2.1 H2O2及HCl 试剂浓度对锂浸出率的影响
搅拌转速n=300 r·min-1,反应温度θ=60 ℃,反应时间t=3 h,改变H2O2及HCl 试剂浓度以研究其对锂浸出率的影响,实验结果如图4 所示。由于HCl 为还原性酸,H2O2遇HCl 会发生缓慢自分解,因此当H2O2浓度为0.5 mol·L-1时,锂的浸出率较低,仅有90.3%~96.1%。随着H2O2浓度增加,抵消了发生自分解的H2O2,因而锂的浸出率显著提高,并在0.7 mol·L-1时接近最高值。
增加HCl 试剂浓度可以提高废磷酸铁锂的反应活性、促进锂离子的浸出,当HCl 于1.0 mol·L-1时,锂的浸出率无明显增长。HCl 浓度过高意味着余酸的增加,而大量的余酸会促使磷酸铁的溶解。因此,HCl 浓度过高不仅会大幅增加后续沉淀铁、磷阶段LiOH·H2O 试剂消耗,还会因大量的FePO4·xH2O 经历“溶解—沉淀”的过程导致滤渣结晶水数量提高、晶粒变小,滤饼呈胶态,极难过滤或洗涤。综合考虑试剂成本、锂的浸出率及易操作性,H2O2及HCl 试剂浓度分别为0.7 和1.0 mol·L-1。

图4 HCl 及H2O2 试剂浓度对锂浸出率的影响Fig.4 Effects of HCl and H2O2 reagent dosages on lithium leaching rates

图5 搅拌转速对锂浸出率的影响Fig.5 Effects of agitation speeds on lithium leaching rates
3.2.2 搅拌转速对锂离子浸出率的影响
当反应温度θ=60 ℃,H2O2及HCl 试剂浓度分别为0.7 和1.0 mol·L-1,反应时间t=3 h,搅拌转速n对锂离子浸出率的影响如图5 所示。由于H2O2遇HCl 会发生自分解,因此必须要为系统提供充分的搅拌,促使反应(2)向右进行,避免系统中HCl 的淤积、提高浸取剂的利用率。由图5 可知,当搅拌速度为50 r·min-1时,锂的浸出率仅为89.3%,浆料也出现了结块现象。随着搅拌速度的提升,物料混合更加充分,H2O2能够及时与LiFePO4颗粒接触并反应,锂的浸出率迅速提高。当搅拌速度提升至300 r·min-1时,锂的浸出率为99.9%,继续提高转速,锂的浸出率基本不再增长。因此,搅拌转速为 300 r·min-1时,可为系统提供充分的搅拌。
3.2.3 反应温度及时间对锂离子浸出率的影响
当n=300 r·min-1,H2O2及HCl 试剂浓度分别为0.7 和1.0 mol·L-1时,反应温度及时间对锂离子浸出率的影响如图6 所示。由于该浸出反应放热现象明显,若将反应时间控制在2 h 以内,则难以再将系统温度维持在60 ℃以下。锂的浸出率随着反应时间的延长而升高,但当反应时间延长至3 h 达到平衡状态,因此反应时间取3 h 较为合适。当反应时间为3 h、反应温度小于60 ℃时,锂的浸出率接近100%,但当反应温度提高至90 ℃时,会促使双氧水自分解,不利于该浸出反应的进行,锂的浸出率迅速降至96.50%。较低的反应温度有利于浸出反应正向进行,但反应温度越低,需要的冷却水越多,因此可将反应温度设定在60 ℃。

图6 反应温度及时间对锂浸出率的影响Fig.6 Effects of reaction temperatures and times on lithium leaching rates
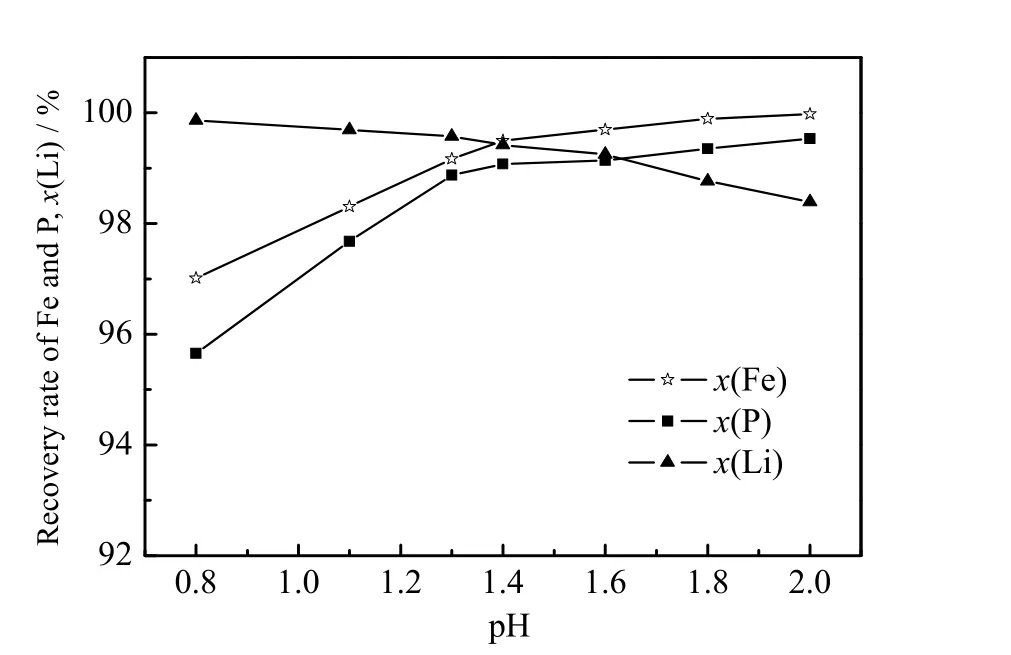
图7 铁、磷沉淀率及锂浸出率随系统pH 值变化趋势(25 ℃)Fig.7 Profiles of iron and phosphorus precipitation rates and lithium leaching rate as a function of system pH (25 ℃)
3.3 沉淀铁、磷
以2.2 节中最佳浸取条件进行反应,反应完成后加入LiOH·H2O 将系统pH 值调至0.8~2.0 并保持稳定0.5 h 后过滤,研究铁、磷、锂、铝、铜、镁6 元素的迁移规律,以求将铁、磷以FePO4·xH2O 的形式沉淀,同时将铝、铜、镁杂质以及锂留在浸出液中。铁、磷的沉淀率以及锂元素的浸出率随pH 变化结果如图7所示;FePO4·xH2O 渣中未检出铜、镁元素,锂、铝杂质元素质量分数w(Li)、w(Al)随pH 变化结果如图8所示。

图8 FePO4·xH2O 渣中铝、锂杂质的质量分数随pH 值变化趋势(25 ℃)Fig.8 Profiles of aluminum and lithium contents in FePO4·xH2O slag as a function of system pH (25 ℃)
由图7 可知,在pH≤1.3 时,锂的浸出率始终保持在99.0% 以上,但随着pH 值升高,由于滤渣吸附、夹杂等原因,锂的浸出率开始下降,在pH=2.0 时降至98.4%。铁、磷沉淀率随pH 升高而提高,在pH=1.4时分别为99.4%、99.1%,继续提高pH 值,铁、磷的沉淀率变化很小。由图8 可知,当pH=0.8 时,FePO4·xH2O 渣中铝的质量分数仅为0.002 9%,未检出锂元素。在pH=1.3 时,滤渣中铝的质量分数提升至0.018 0%,也出现了0.002 0%的锂元素,并且铝、锂元素的质量分数随着pH 值升高迅速增长,在pH=2.0 时分别提高到0.071 4%和0.101 6%。综合考虑锂的浸出率,铁、磷沉淀率以及FePO4·xH2O渣中杂质元素的质量分数,选取pH=1.1±0.05 来沉淀铁、磷[24-25]。参考文献[25],采用质量分数为5% 磷酸溶液对FePO4·xH2O 渣进行陈化、洗涤、脱水操作,最终得到的无水磷酸铁可达到《T/ATCRR 18—2020无水磷酸铁》一等品标准,该产品的扫描电镜图见图9。

图9 无水FePO4 产品的扫描电镜图Fig.9 SEM micrograph of anhydrous FePO4
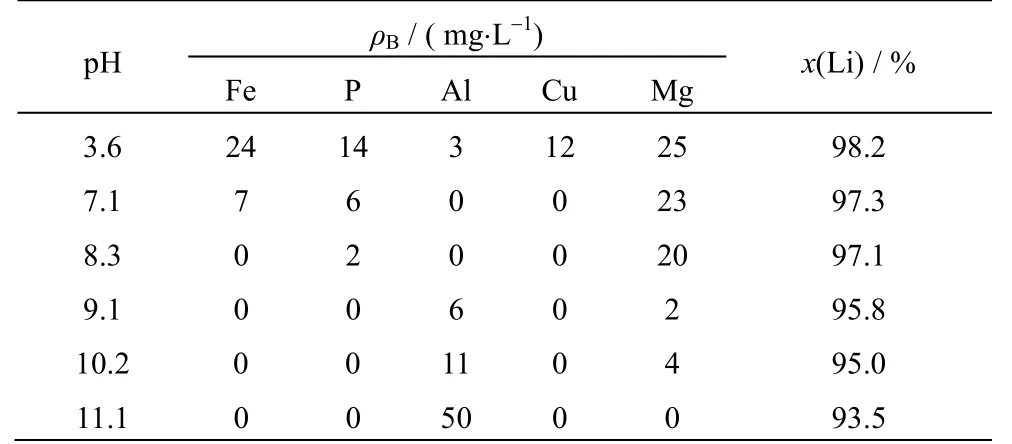
表4 氯化锂粗溶液中杂质元素的质量浓度及锂回收率Table 4 Impurities in crude LiCl solution and related lithium leaching rates
3.4 定向除杂
从2.2 节最佳沉淀铁、磷条件下得到的浸出液中,含有少量铁、磷、铝、铜、镁5 种杂质。由图1可知,当pH=7.0~8.0 时,铝、铁、铜杂质元素理论上都可以降至10-5mol·L-1以下。因此采用LiOH·H2O将浸出液pH 值调至上述区间附近,研究锂的回收率以及溶液中杂质元素质量浓度变化规律,实验结果如表4 所示,表中ρB为质量浓度。
由表4 可知,当pH=3.6 时,锂元素的回收率为98.2%,但铁、铝、铜、镁的沉淀趋势都较弱,因此上述杂质元素浓度都较高。当pH 升高到7.1 时,浸出液中除镁以外,其他杂质元素的质量浓度都有明显下降。继续升高pH,铁、磷、铜杂质元素的质量浓度呈持续下降趋势,在pH=8.3 时基本沉淀完全,而锂的回收率出现小幅下降,但依然保持在97.1%。若继续提高pH,FePO4·xH2O 沉淀将会在Fe(OH)3沉淀优势区发生转化,并产生Li3PO4沉淀,导致锂的回收率大幅降低。当pH>8.3 时铝元素又重新被溶解,当pH>10.2 时,镁杂质的质量浓度才开始下降。上述规律验证了2.1 中沉溶平衡热力学分析结果,因此选取定向除杂pH=7.0~8.0,将铁、磷、铝、铜杂质元素定向移出系统,镁元素保持在氯化锂粗溶液中。
3.5 除镁
浸出液经过定向除杂后得到的氯化锂粗溶液中P 元素的质量浓度较低,由2.4 节中的实验结果及图2可知,可以将pH 调至11.0~11.5,促使系统中微量的镁元素以氢氧化镁的形式沉淀。实验结果表明,由于镁杂质的质量很少,难以称重,该过程可认为没有锂的损失。采用盐酸将除镁后的溶液pH 值调回7.0~8.0,即可得到氯化锂精制溶液。
本研究采用200 kg 规模废磷酸铁锂进行综合实验,最终得到品质较好的FePO4·xH2O 渣、氯化锂精制溶液以及少量的定向除杂渣,3 种产物的质量分数及成分如表5 所示。由表5 可知,锂元素回收率高达97.3%,氯化锂精制溶液可用于制备氯化锂或碳酸锂;FePO4·xH2O 渣可用于制备电池级磷酸铁。定向除杂渣中锂的质量分数高达13.39%,依然可以进行回收,从而提高锂的综合回收率。

表5 系统输出物料的成分Table 5 Components of output materials
4 结 论
(1)水调浆与磷酸铁锂粉料液固比m(H2O):m(磷酸铁锂)=2:1,搅拌转速n=300 r·min-1,反应温度θ=60 ℃,反应时间t=3 h,H2O2及HCl 试剂浓度分别为0.7 和1.0 mol·L-1时,锂元素浸出率可以达到99.9%,但浸出液中铁、磷杂质的质量浓度分别达到18.3、11.2 g·L-1。
(2) 在浸出反应完成后,将系统pH 调控至1.1±0.05,可控制锂、铝、铜、镁元素保留在浸出液中,而铁、磷以FePO4·xH2O 形式沉淀。此时,锂的浸出率为99.6%,铁、磷回收率分别为98.3%、97.7%,FePO4·xH2O 渣中铝、锂的质量分数分别降至0.006 1%、0.000 9%,可用于电池级FePO4·2H2O 的制备。
(3) 采用LiOH·H2O 将浸出液pH 值调至7.0~8.0,实现对铁、磷、锂、铝、铜元素的定向除杂。再将pH 调至11.0~11.5,即可将镁元素以氢氧化镁的形式沉淀,最后采用盐酸将溶液pH 值调回中性,即可得到氯化锂精制溶液,锂的回收率为97.3%。氯化锂精制溶液可用于生产无水氯化锂或碳酸锂,实现废磷酸铁的近全组分的资源化回收利用。
