HBV相关原发性肝癌患者循环血miR-155水平与相关免疫细胞因子、HBV-DNA载量的关系及意义
2021-05-19杜敬佩王园园李长安赵巍峰
杜敬佩 王园园 李长安 赵巍峰
(新乡医学院第三附属医院感染性疾病科,河南 新乡 453000)
近些年来,逐渐发现了较多的与原发性肝癌(PHC)发病相关的微小RNA(miRNA),并成为临床诊断和治疗中最具潜力的生物分子标志物[1]。而且由于缺乏免疫原性,某些miRNAs也逐渐成为抗病毒治疗的理想靶点[2]。众多循证医学研究业已证实,乙型肝炎病毒(HBV)感染引起的急慢性肝疾病是PHC发病的独立危险因素[3-5];而且我国也属于HBV高感染地区,90%以上的PHC患者都具有HBV感染背景[6]。因此,本研究从靶基因水平寻找与HBV相关miRNA,并进一步分析其与HBV相关PHC发生、HBV病毒载量、相关免疫细胞因子的关系,旨在为PHC的早期诊断及靶向治疗提供一定的理论依据。
1 材料与方法
1.1 材料来源
收集2019年1月—2020年3月于我院肝病科乙肝表面抗原(HBsAg)或HBV-DNA检测阳性患者的血液样本共180例。包括HBV相关PHC患者(PHC组)75例,乙型肝炎肝硬化患者(HBV-LC组)45例,慢性乙型肝炎患者(CHB组)30例,无症状慢性HBV携带者(HBV组)30例。所有患者采集血液样本前均未行外科手术或其他抗癌治疗,其中HBV组患者经相关血清学检查确诊,HBV-LC组经肝穿刺活检或影像学检查确诊,PHC患者经组织病理学检查确诊;排除标准:①其他肝炎病毒感染、酒精、自身免疫、代谢因素等引起的肝脏疾病;②合并心、肾等功能严重障碍者或其他恶性肿瘤、血液系统疾病者。根据PHC患者肝功能状态、肿瘤特点、治疗方式等进行BCLC分期。另外收集同时期健康人群血液样本50例作为对照组,各项生化指标均在正常参考范围内且体格检查、影像学检查等均无异常。各组受检者年龄、性别、体质量指数(BMI)、吸烟史者比例,差异无显著意义(P>0.05)。本研究所有受检者均签署了知情同意书,并符合《赫尔辛基宣言》。
1.2 实验方法
1.2.1肝功能检测 采用UniCelDxI800免疫分析仪(美国Backman-Coulter公司)检测所有受检者血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(T-BIL)以及血清白蛋白(ALB)的水平。根据临床生化指标,包括肝性脑病(期)、腹水、血清T-BIL水平、ALB水平、凝血酶原时间进行肝功能Child-Pugh分级,分为A级:5~6分,B级:7~9分,C级:>9分。
1.2.2血浆总RNA提取和实时荧光定量聚合酶链式反应(RT-qPCR)方法检测受检者血浆中miR-155的水平 从-80 ℃样本库中取出血浆样本,采用miR-cute miRNA提取试剂盒提取总RNA,加入30 μL DEPC处理过的ddH2O溶解RNA并分装保存。取2 μL用超微量紫外分光光度计检测RNA浓度和纯度。取1 μg RNA采用TransScript miRNA First-Strand cDNA Synthesis试剂盒进行茎环法逆转录反应,miR-155引物:5′-GTCGTATCCA-GTGCAGGGTCCGAGGTATCGCACTGGATAC-GACCAGACTCC-3′。取2 μL cDNA作为模板,加入正、反向引物序列各0.5 μL后,利用SYBR®Premix Ex TaqTM试剂盒进行PCR扩增:95 ℃预变性1 min,1个循环;94 ℃变性10 s,58.5 ℃延伸40 s,72 ℃退火40 s,共37个循环。使用StepOne Software软件分析数据,以2-△△CT表示目的基因的表达量。miR-155引物:上游引物5′-GCAGTCA-TCCTTCATTCCACC-3′,下游引物5′-GTGCAG-GGTCCGAGGTAT-3′;小分子内参U6,上游引物5′-CATTGGGAGTTTCAAATCAGC-3′,下游引物5′-CTTTGCATTCTTGGACGAGG-3′。每个样品重复实验3次。
1.2.3血清中免疫细胞因子的检测 采用(双抗体夹心法)酶联免疫吸附测定试剂盒检测各组受检者血清中Th1类细胞因子[白细胞介素-12(IL-12)、干扰素-γ(IFN-γ)、肿瘤坏死因子α(TNF-α)]和Th2类细胞因子(IL-4、IL-6、IL-10)的水平。试剂盒购自上海西唐生物科技有限公司。
1.2.4血清中HBV病毒载量的检测 采用PCR荧光探针法检测各组受检者血清中HBV病毒载量。首先采用一步法在血清中加入核酸释放剂,然后采用HBV核酸扩增荧光检测试剂盒检测各受检者血清中HBV-DNA含量,扩增条件:50 ℃ 2 min,94 ℃ 5 min,94 ℃ 15 s,57 ℃ 30 s,45个循环。乙型肝炎病毒荧光定量PCR检测试剂盒购自于广州Targene公司。
1.2.5血清甲胎蛋白检测 采用化学发光微粒子免疫检测法检测PHC患者血清甲胎蛋白水平。试剂盒购自上海雅培公司。
1.3 统计学分析

2 结 果
2.1 各组受检者血浆中miR-155和血清中相关免疫细胞分子水平的比较
各组受检者血浆中miR-155和血清中IL-12、TFN-γ、IL-4、IL-6、IL-10水平比较,差异有统计学意义(F=8.252~661.419,P<0.05),但是各组血清TNF-α水平比较,差异无统计学意义(P>0.05);与对照组相比,PHC组患者血浆中miR-155水平明显升高,同时血清中IL-12、IFN-γ、IL-4、IL-6、IL-10水平均明显降低(P<0.05);与HBV组、CHB组和HBV-LC组患者相比,PHC组患者血浆中miR-155水平明显升高,血清中IL-12、IFN-γ、IL-6水平明显降低(P<0.05);HBV相关肝疾病的4组患者血清中TNF-α、IL-4和IL-10水平比较,差异无统计学意义(P>0.05)。见表1。
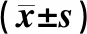
表1 各组受检者血浆中miR-155和血清中相关免疫细胞分子水平比较
2.2 PHC组患者血浆中miR-155与血清中相关免疫细胞分子水平的相关性
HBV相关PHC患者血浆中miR-155的水平与血清中IL-12、IFN-γ水平呈负相关(r=-0.595、-0.478,P<0.01),同时与血清中IL-4、IL-6、IL-10水平则均呈正相关(r=0.285~0.548,P<0.01、0.05)。
2.3 PHC组患者血浆中miR-155与HBV-DNA载量的相关性
Pearson相关性分析显示,PHC组患者血浆中miR-155水平与HBV-DNA载量呈正相关性(r=0.714,P<0.01)。
2.4 PHC组患者血浆中miR-155水平与血清中甲胎蛋白水平的相关性
Pearson相关性分析显示,PHC组患者血浆中miR-155水平与血清中甲胎蛋白水平呈正相关性(r=0.656,P<0.01)。
2.5 血浆中miR-155水平和PHC组患者临床特征的关系
血浆中miR-155水平与PHC患者性别、年龄、肿瘤是否微血管侵犯无关(P>0.05),然而肝功能Child-Pugh分级C级患者血浆中miR-155水平高于A~B级患者(t=3.218,P<0.01),肿瘤BCLC分期C~D期患者血浆中miR-155水平高于A~B期患者(t=3.455,P<0.05),同时肿瘤直径>5 cm患者血浆中miR-155水平显著高于直径≤5 cm患者(t=5.187,P<0.01)。见表2。
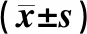
表2 血浆中miR-155水平和PHC组患者其他病理特征的关系
2.6 血浆中miR-155对HBV相关性PHC的诊断价值
ROC曲线分析显示,血浆中miR-155对HBV相关性PHC诊断的灵敏度为94.5%,特异度为68.5%,AUC为0.892(95%CI=0.810~0.942)。见图1。
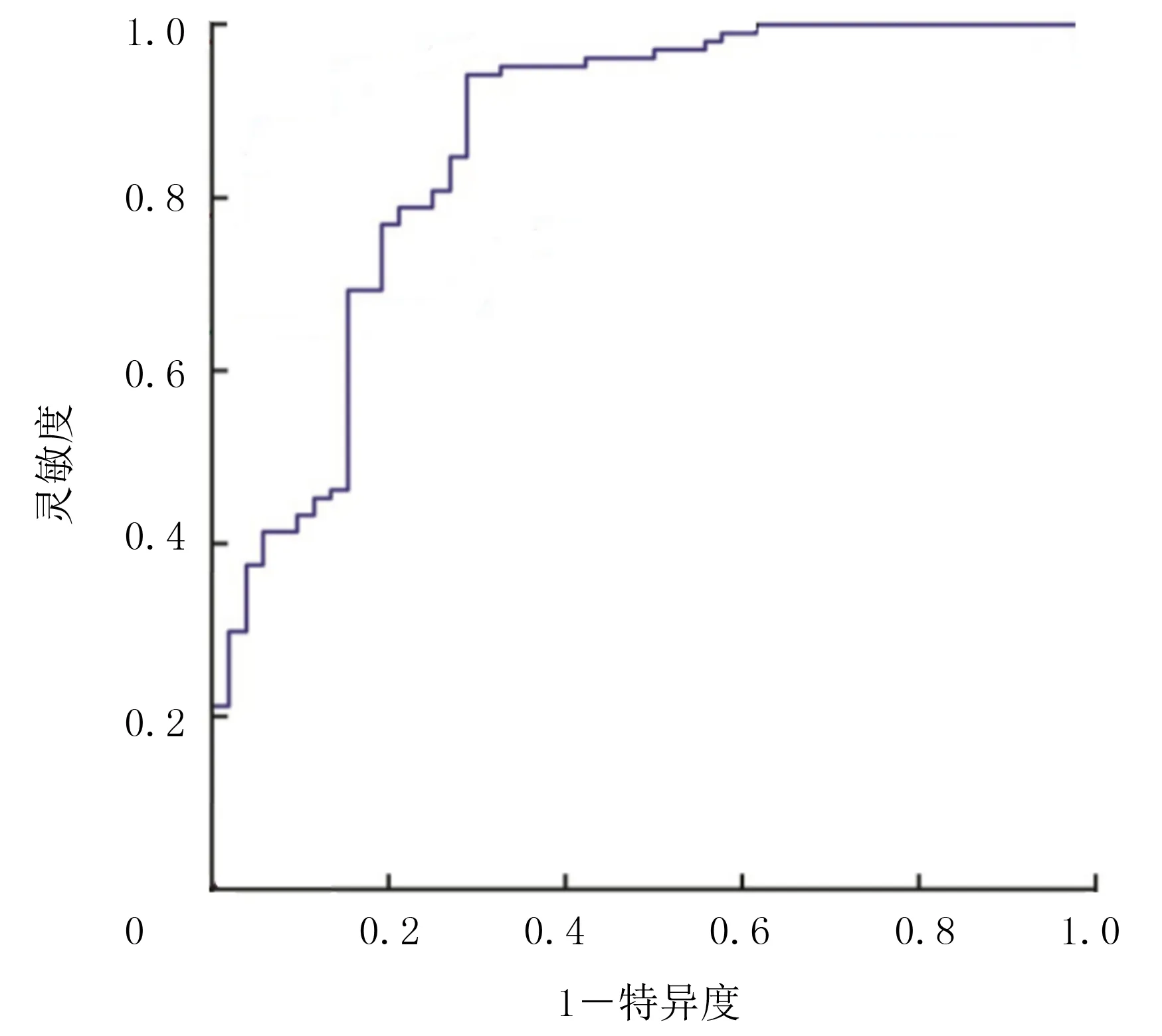
图1 血浆中miR-155诊断HBV相关性PHC的ROC曲线图
3 讨 论
众多研究证实,HBV活跃复制是肝炎肝硬化和PHC发生的独立危险因素[7-8],但是其潜在的HBV导向致癌的分子机制尚存在巨大的争议。随着分子生物学和生物信息学技术发展,miRNAs组学分析对于推动PHC临床精准医疗提供新的研究思路。
慢性HBV感染的自然过程可分为三个阶段:免疫耐受期、免疫清除期和残留期或非活动期,然而其中确切的相关机制仍不清楚。miRNAs是一类小的非编码RNA,大约有22个核苷酸长度,参与先天性以及后天性免疫应答。几乎所有的DNA病毒包括HBV,都具有自己独特的miRNA体系[9]。但由于通过计算机模拟手段,并未获得与3′端人类基因组相匹配的HBV编码miRNA[10],因此HBV编码的miRNA是否具有致癌功能尚存有争议,而众多研究却证实,HBV产物可影响宿主细胞miRNAs表达谱,包括某些具有促癌或抑癌活性的miRNAs,进而参与宿主细胞的恶性癌变过程[11-13]。HBV尤其是乙肝病毒X蛋白(HBx)通过上调宿主细胞miR-155表达,进而抑制抑癌基因ZHX2,从而促进肝癌细胞的增殖,HBx是肝癌中主要的HBV蛋白之一,可激活癌基因,导致表观遗传修饰,调控非编码RNA的表达,进而影响肿瘤细胞的增殖、凋亡、代谢、转移等[14]。因此基于细胞实验的结果,推断miR-155水平明显升高可能是HBV相关肝细胞癌进展的重要因素,而且本研究也证实,PHC患者肝功能越差、肿瘤分化程度越高、肿瘤直径越大,血浆中miR-155表达水平越高。miR-155是PHC发生过程中重要的致癌基因,如FU等[15]证实,miR-155通过靶向PTEN基因激活PI3K/AKT通路促进肝细胞癌细胞体内和体外增殖。本研究结果亦显示,HBV相关性肝疾病患者血浆中miR-155表达水平均显著高于对照组,提示miR-155在HBV相关性肝疾病中属于功能性基因,这与上述基础研究结论基本一致;而且在PHC患者中,随着HBV-DNA载量增加,血浆中miR-155表达量也相应上升,说明两者存在一定的调控关系,miR-155表达量在一定程度上可反应HBV病毒复制程度。
此外,HBV持续感染状态导致PHC的发生过程是一个多因素参与,涉及多种机制的复杂过程[16],与宿主的免疫功能也密切相关,包括CD4+T细胞亚群功能紊乱[17]、细胞因子的分泌[18]以及某些特异信号通路的转变[19]等。如CD4+T细胞亚群可进一步分化为Th1和Th2,分别介导细胞免疫应答和体液免疫应答[20-22]。本研究显示,在HBV相关性肝疾病患者体内Th1/Th2平衡逐渐发生偏移,虽然Th1类细胞因子(IL-12、INF-γ)和Th2类细胞因子(IL-4、IL-6、IL-10)表达量较对照组均显著降低,但是Th1类细胞因子(IL-12、INF-γ)表达水平降低更明显,说明HBV相关性肝疾病患者体内细胞免疫和体液免疫功能均受到不同程度抑制,尤其是PHC患者,Th1型细胞因子表达水平明显降低,而Th2型细胞因子则占据相对优势。而且PHC患者体内miR-155水平与Th1类细胞因子(IL-12、INF-γ)表达量呈负相关性,但是与Th2类细胞因子(IL-4、IL-6、IL-10)表达量则呈正相关性,说明miR-155可诱导Th1/Th2平衡向Th2型偏移,Th1细胞减少,细胞因子IFN-γ则分泌减少,对Th0分化为Th2细胞的抑制作用减弱,Th2细胞增加,细胞免疫功能下降,从而形成宿主对HBV抗原的免疫耐受,导致HBV持续感染,并向HBV-LC和PHC方向演变。
我国是HBV感染以及肝癌的高发病国家之一[23],根据中国疾病防治中心预估的流行病学数据显示,我国的HBsAg携带率约为5%~6%,而约85%的PHC患者携带HBV感染标志物[24]。虽然我国乙肝疫苗接种已基本实现全国范围普及,但是仍有部分儿童(16.89%~35.07%)在完成初次三针全接种后出现无应答或低应答情况[25],因此加强HBV预防和PHC早期筛查工作一直是公共卫生领域面临的巨大挑战[26]。甲胎蛋白是早期筛查和诊断PHC最常使用的血清肿瘤学指标[27],其检测特异度高,但是仍有30%~40%的肝癌患者呈阴性[28-30],因此寻找新的血清肿瘤学分子势在必行。本研究结果显示,血浆中miR-155对于HBV相关性PHC的诊断灵敏度和特异度较高,说明miR-155在PHC的诊断和精准治疗方面具有一定的优势,但是是否能够实现临床转化尚需进一步验证。
综上所述,miR-155在HBV相关性PHC患者血浆中表达量升高,并且与HBV-DNA载量、Th1/Th2免疫失衡密切相关,可为该类患者临床早期诊断和筛查提供一定的参考作用。
