冻融循环对大目金枪鱼质构与蛋白质特性变化的影响
2021-05-19蓝蔚青孙雨晴
蓝蔚青,孙雨晴,肖 蕾,梅 俊,谢 晶,
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
金枪鱼是一种极具营养价值的经济鱼类,主要分布在印度洋、太平洋与大西洋中部等热带、亚热带海域,属大洋性高洄游性鱼[1]。其肉质滑嫩鲜美、低脂肪、高蛋白,被国际营养组织推荐为世界三大营养鱼类之一[2]。金枪鱼为远洋运输鱼类之一,为防止鱼肉在运输过程中营养价值降低,其贮藏温度一般要求在-55~-60 ℃,甚至更低温度[3]。但实际生产中,金枪鱼经捕捞屠宰后在供消费者食用前需经过多次中转,受到冷链技术条件和外界条件限制,并不能严格确保产品始终贮藏在此温度下,温度变化导致产品反复冻融循环最多可达4~6 次[4]。此外,因金枪鱼价格较高,易出现部分一次未售完的鱼肉经多次冻藏后被再次销售的现象,反复冻融处理会导致鱼肉组织中冰晶重结晶,蛋白质变性,严重影响了金枪鱼的食用品质[5-6]。因此,研究冻融循环对金枪鱼品质变化影响意义重大。目前,已有部分学者针对反复冻融对水产品品质的影响开展了相关研究工作。其中,邓思杨等[7]研究得出冷冻-解冻循环会破坏锦鲤鱼肌原纤维蛋白的完整结构,降低蛋白质的功能特性;井月欣等[8]分析了冻融循环对大菱鲆不同部位肌肉品质的影响,结果显示背部肌肉的质量损失小于腹部,冻融循环次数越多,肌肉品质越差;Tan Mingqian等[9]研究了冻融循环对即食海参品质的影响,结果表明多次冻融循环会导致海参的胶原含量下降与显微结构破坏,理化性质随之发生改变。
目前关于冻融循环对金枪鱼品质变化影响的研究还不多。本实验以大目金枪鱼(Thunnus obesus)为原料,模拟两种冻融循环方式(超市冻融处理F1与家庭冻融处理F2),通过测定鱼肉解冻后的理化指标(汁液流失率、质构特性、高铁肌红蛋白相对含量、肌原纤维蛋白含量、总巯基含量与Ca2+-ATPase活力),同时结合十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)、低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)与核磁共振成像(magnetic resonance imaging,MRI)技术共同表征冻融循环过程中冻融循环次数对大目金枪鱼组织与蛋白质特性的影响,旨在为大目金枪鱼流通销售过程中冷链技术发展提供理论参考。
1 材料与方法
1.1 材料与试剂
大目金枪鱼于2019年6月由远洋控股集团(中国)有限公司在太平洋近海捕捞后直接屠宰抽真空并冻藏(-55 ℃)。
总巯基含量测定试剂盒、超微量Ca2+-ATPase活力测定试剂盒 南京建成生物工程研究所;十二水合磷酸氢钠、二水合磷酸氢钠 国药集团化学试剂有限公司;氯化钾、氢氧化钠、氯化钠 上海埃彼化学试剂有限公司;硫酸铜、酒石酸钾钠四水合物、SDS、三羟甲基氨基甲烷、反丁烯二酸、甘氨酸(均为分析纯) 上海生工生物工程股份有限公司。
1.2 仪器与设备
SLFPTAD型多功能酶标仪 上海基因有限公司;DW-86L388型立式超低温保存箱 青岛海尔特种电器有限公司;FJ200-S型数显高速均质机 杭州齐威仪器有限公司;TGL-16M型台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;BS210S型电子天平 北京赛多利斯仪器系统有限公司;722型可见分光光度计上海舜宇恒平科学仪器有限公司;MesoMR23-060H-1型LF-NMR仪 上海纽迈电子科技有限公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;1658001型小型垂直电泳槽 美国Bio-Rad公司。
1.3 方法
1.3.1 冻融循环设计
将质量为400~500 g真空包装的大目金枪鱼鱼样分为两组平铺于指定温度下的冰箱内。其中,F1组(超市冻融处理)样品在-55 ℃冰箱中贮藏24 h后取出,置于2 ℃陈列柜中自然解冻,将温度采集仪的热电偶探头插入鱼块中,解冻至样品中心温度-5 ℃为解冻终点,全过程为完成一次冻融,按上述方法共反复冻融5 次;F2组(家庭冻融处理)样品在-18 ℃冰箱中贮藏24 h后取出,置于4 ℃冰箱中自然解冻,将温度采集仪的热电偶探头插入鱼块中,解冻至样品中心温度-5 ℃时为解冻终点,全过程为完成一次冻融,按上述方法共反复冻融5 次。
1.3.2 汁液流失率的测定
参考张丹等[4]的方法对大目金枪鱼汁液流失率进行测定。解冻后的鱼块用滤纸吸去表面水分,使用电子天平分别对解冻前后鱼块精确称质量,鱼肉解冻后汁液流失率按公式(1)计算。

1.3.3 质构特性测定
将大目金枪鱼背部鱼肉切成20 mm×15 mm×10 mm的方块,样品按垂直于其厚度的方向平放。参考李念文等[10]的实验条件进行质构分析:平底柱形探头P/6(直径6 mm);测前速率3 mm/s;测试速率1 mm/s,测后速率1 mm/s,压缩变形率50%,探头2 次测试间隔5.00 s;数据采集速率200 Hz;测试环境温度12~16 ℃。测定其硬度、黏性、弹性和咀嚼性,每组样品平行测定6 次,取其平均值。
1.3.4 高铁肌红蛋白相对含量的测定
参考Thiansilakul等[11]的方法进行高铁肌红蛋白相对含量测定。准确称取剁碎的鱼肉3.0 g加入离心管,量取15 mL磷酸盐缓冲液(40 mmol/L)加入离心管,均质,4 ℃、10 000 r/min离心20 min后取上清液,在525、545、565 nm和572 nm波长处测定吸光度,按公式(2)计算高铁肌红蛋白相对含量。

1.3.5 肌原纤维蛋白含量的测定
肌原纤维蛋白含量的测定参照刘琴等[12]的方法并稍作改动。称取剁碎的大目金枪鱼肉3.0 g于离心管,按料液比1∶4添加pH 6.6的磷酸盐缓冲液(phosphate buffered saline,PBS),均质后,在4 ℃下10 000 r/min离心10 min后弃去上清液,接着向沉淀中加入比例同上的PBS均质后,4 ℃、10 000 r/min离心10 min,均质-离心重复3 次后,用0.7 mol/L NaCl溶液清洗沉淀,离心后所得上清液即为肌原纤维蛋白样品,根据双缩脲法对肌原纤维蛋白含量进行测定。
1.3.6 Ca2+-ATPase活力的测定
根据超微量Ca2+-ATPase活力测定试剂盒操作步骤,对提取的肌原纤维蛋白进行酶促反应,混匀后于3 500 r/min离心10 min,取上清液加入显色剂后混匀定磷。室温下静置5 min,在636 nm波长处测定吸光度。按试剂盒说明书计算Ca2+-ATPase活力,Ca2+-ATPase活力用每毫克蛋白中所含酶活力单位表示(U/mg)。
1.3.7 总巯基含量的测定
参照总巯基含量测定试剂盒中操作步骤加入相应试剂,静置5 min,在405 nm波长处用酶标仪测定其OD值,按试剂盒说明书计算总巯基含量。
1.3.8 SDS-PAGE分析
参照高艳利等[13]的实验方法进行SDS-PAGE分析。将20 μL肌原纤维蛋白提取液与5 μL Loading buffer混合,100 ℃下水浴15 min,冷却到室温后取15 μL混合液进行SDS-PAGE分析。电泳条件:浓缩胶电压90 V、分离胶电压180 V。使用考马斯亮蓝将凝胶染色30 min后取出,放入脱色液中脱色,直至蛋白质条带及背景清晰,用电泳自动成像仪拍摄凝胶后进行分析。
1.3.9 LF-NMR与MRI分析
使用CPMG(Carr-Purcell-Meiboom-Gill)序列测定LF-NMR横向弛豫时间(T2),参照赵宏强[14]的T2测定参数。为防止水分损失,将质量约为10 g的鱼肉用保鲜膜包封后放入核磁管中分析,每组样品平行测定3 次。采用MRI技术分析鱼样的氢质子密度与分布,参照赵宏强[14]的测定条件,最终的鱼肉质子密度图谱由8 次扫描重复累加所得,质子密度图由上海纽迈科技公司统一进行映射、伪彩处理得到。
1.4 数据处理与分析
使用SPSS 13.0软件中的Duncan新复极差法对数据间差异进行方差分析与多重比较,采用Origin 8.5软件绘制曲线,最终实验数据均为每组样品的3 次平行实验平均值,并以平均值±标准偏差表示。
2 结果与分析
2.1 冻融循环对大目金枪鱼汁液流失率的影响
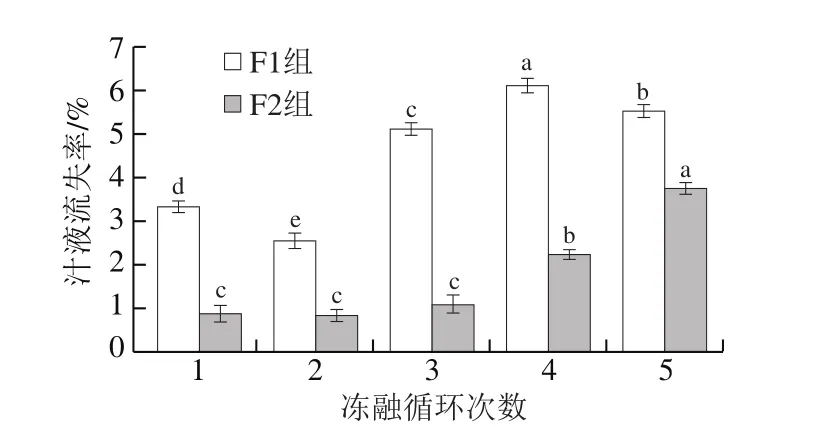
图1 冻融循环对大目金枪鱼汁液流失率的影响Fig.1 Effect of freeze-thaw cycles on thaw drip loss rate in big-eye tuna
如图1所示,大目金枪鱼在冻融过程中发生了不同程度的汁液流失,其中F1组鱼样冻融循环过程中的汁液流失率更高,表明温度波动幅度越大,汁液流失越严重。第5次冻融循环后F1组鱼样解冻汁液流失率稍有下降,可能是由于鱼样在第5次冻融时,其品质超过最大冻融循环次数极限,开始出现腐败;F2组鱼样在5 次冻融循环过程中解冻汁液流失率呈缓慢增长趋势。反复冻融过程中温度波动引起冰晶重结晶,导致其组织结构被破坏,肌原纤维脱水,引起蛋白质变性,鱼样完全解冻后水分流失现象严重。叶伏林等[15]研究了反复冻融对黄鳍金枪鱼品质影响,结果表明随着反复冻融循环次数的增加,汁液流失率升高,其结果与本研究结果相似。
2.2 冻融循环对大目金枪鱼质构特性的影响
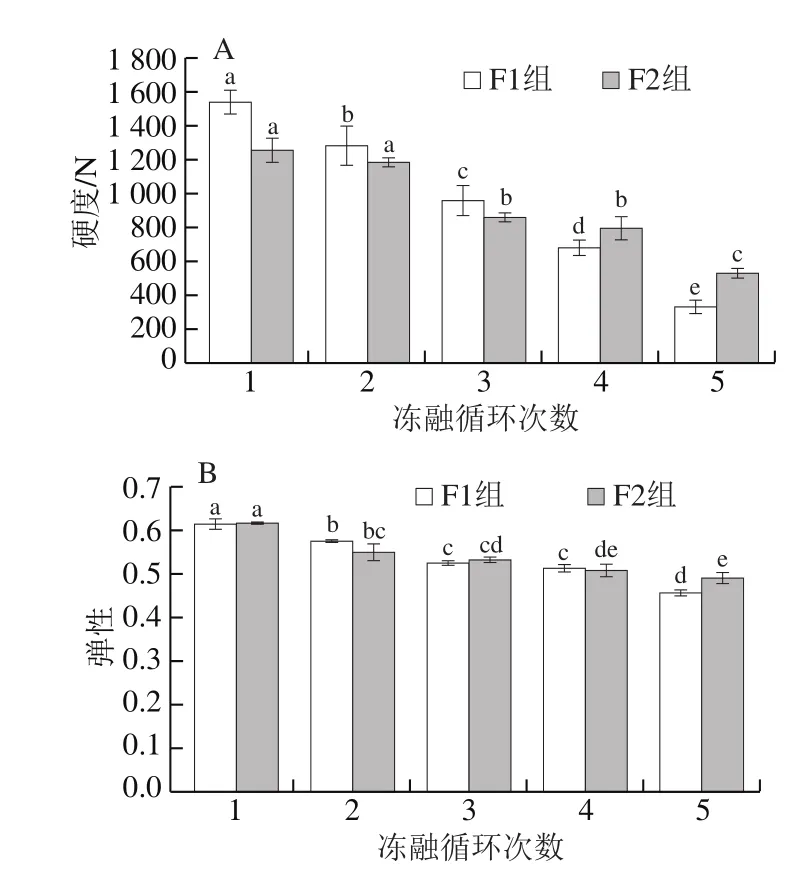

图2 冻融循环对大目金枪鱼质构特性的影响Fig.2 Effect of freeze-thaw cycles on TPA parameters of big-eye tuna
如图2所示,随着冻融循环次数的增加,蛋白质的降解变性相对剧烈,质构劣变则越来越显著。F1和F2组鱼肉冻融过程的硬度(图2A)、弹性(图2B)与咀嚼性(图2C)均呈下降趋势,黏性(图2D)呈上升趋势。到第4次冻融时,F1组样品的硬度低于F2组,而咀嚼性、黏性略高于F2组。这可能是由于大目金枪鱼在反复冻融过程中汁液流失率逐渐上升,蛋白质肌肉组织发生降解,导致其硬度下降[15]。黏性明显上升,说明其在反复冻结解冻过程中,微生物的作用使其腐败速率加快,由此产生黏液。已有研究表明,鱼类肌肉蛋白中占主导地位的肌原纤维降解是导致其硬度和弹性降低的主因[16]。Tan Mingqian等[9]的研究表明反复冻融对即食海参的质构特性有显著影响,这与本实验结果相符。
2.3 冻融循环对大目金枪鱼高铁肌红蛋白相对含量的影响

图3 冻融循环对大目金枪鱼高铁肌红蛋白相对含量的影响Fig.3 Effect of freeze-thaw cycles on metmyoglobin relative content in big-eye tuna
新鲜大目金枪鱼肉所呈鲜红色主要是氧合肌红蛋白作用的结果。鱼肉在冻藏过程中含Fe2+的氧合肌红蛋白与还原型肌红蛋白进一步被氧化成含Fe3+的高铁肌红蛋白,导致鱼肉呈褐色;高铁肌红蛋白相对含量越高,鱼肉褐变越严重,降低冻藏温度可有效减缓鱼肉中的氧合肌红蛋白氧化为高铁肌红蛋白的速率[15]。如图3所示,F1和F2组鱼肉随冻融循环次数的增加,高铁肌红蛋白相对含量呈整体上升趋势,这是由于鱼肉中的还原型肌红蛋白与氧合肌红蛋白发生自动氧化,生成呈褐色含Fe3+的高铁肌红蛋白[17]。在反复冻融过程中,F2组鱼肉的高铁肌红蛋白相对含量上升速率较快,说明与冻藏温度-55 ℃相比,冻藏温度-18 ℃下反复冻融更易生成高铁肌红蛋白。杨金生等[18]研究了不同冻藏温度对金枪鱼高铁肌红蛋白相对含量的影响时发现,高铁肌红蛋白相对含量随着冻藏时间的延长逐渐上升,冻藏温度越高,高铁肌红蛋白相对含量的上升速率越快,其研究结果与本实验结果相一致。
2.4 冻融循环对大目金枪鱼肌原纤维蛋白含量的影响
肌原纤维蛋白是鱼类肌肉中最主要的蛋白质,约占总蛋白含量的50%~55%,具有重要生物学功能[19]。其形态特征是鱼肉的组织学基础,在某种程度上决定了鱼肉品质,因此通常可用肌原纤维含量及结构变化评价鱼肉品质[20]。Li Fangfei等[21]研究发现,冻融循环过程中的蛋白质变性聚集是导致肌肉蛋白质溶解性显著降低的重要原因。

图4 冻融循环对大目金枪鱼肌原纤维蛋白含量的影响Fig.4 Effect of freeze-thaw cycle on myofibrillar protein content in big-eye tuna
如图4所示,随着冻融循环次数的增加,大目金枪鱼的肌原纤维蛋白含量下降。其中,F1组样品的肌原纤维蛋白含量降幅不明显,而F2组样品的肌原纤维蛋白含量随着冻融循环次数的增加逐渐降低,第5次冻融时已从冻融1 次时的28.11 mg/g降至10.37 mg/g。说明相较于冻藏温度-55 ℃下的反复冻融,冻藏温度-18 ℃下的反复冻融鱼肉中肌原纤维蛋白含量下降程度更显著。肌原纤维蛋白属盐溶性蛋白,冻藏温度高于共晶点时,蛋白质变性程度随温度升高而加剧,同时盐溶性蛋白含量下降速率变快。Benjakul等[22]的研究证明,反复冻融会对鳕鱼中蛋白质含量产生明显影响,盐溶性蛋白含量随冻融循环次数的增加呈下降趋势,经过5 次反复冻融后盐溶性蛋白含量明显下降。
2.5 冻融循环对大目金枪鱼总巯基含量的影响
肌原纤维蛋白总巯基包含活性巯基和隐藏巯基两部分,其含量可反映鱼肉蛋白质变性聚合程度[23]。肌球蛋白的总巯基含量可作为判断蛋白质变性程度的重要指标,反映蛋白质空间构象变化[24]。冻融循环与温度波动对大目金枪鱼总巯基含量的影响如图5所示。
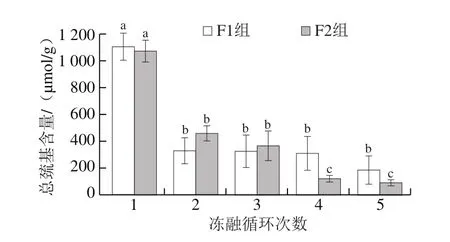
图5 冻融循环对大目金枪鱼总巯基含量的影响Fig.5 Effect of freeze-thaw cycles on total sulfhydryl content in big-eye tuna
如图5所示,随着冻融循环次数增加,各组样品的总巯基含量均显著下降,F2组样品经5 次反复冻融后,与冻融1 次相比降幅达91.73%。表明样品在冻融过程中由于蛋白质发生降解,蛋白质内部的活性巯基暴露,被氧化为二硫键,总巯基含量降低。Zhang Longteng等[25]通过实验证实了反复冻融会导致鳙鱼鱼肉中的总巯基含量下降,与本实验结果相符。
2.6 冻融循环对大目金枪鱼Ca2+-ATPase活力的影响
肌原纤维蛋白具有Ca2+-ATPase活力,鱼肉在冻藏过程中,蛋白质变性会引起Ca2+-ATPase活力的变化,因此该酶活力被广泛用于评价鱼肉蛋白质变性程度[26]。
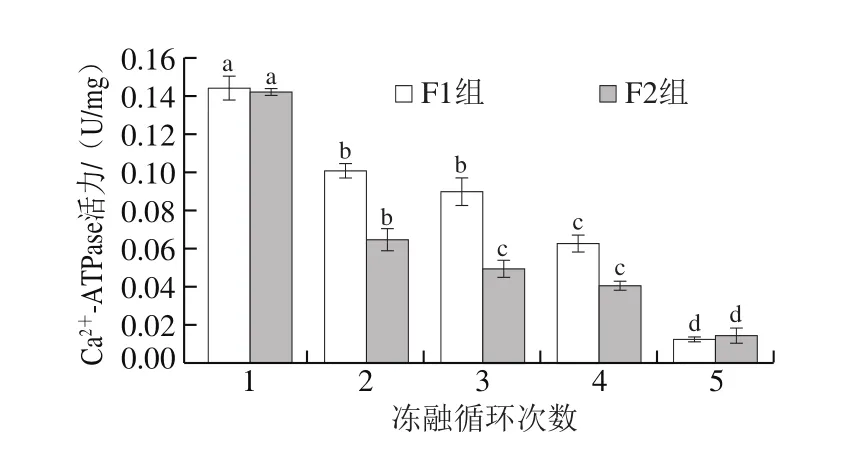
图6 冻融循环对大目金枪鱼Ca2+-ATPase活力的影响Fig.6 Effect of freeze-thaw cycles on Ca2+-ATPase activity in big-eye tuna
如图6所示,随着反复冻融循环次数的增加,两组样品的Ca2+-ATPase活力均呈下降趋势,其中F2组下降更明显,可见样品中的Ca2+-ATPase活力与冻融循环次数、冻藏温度密切相关。有研究表明Ca2+-ATPase活力降低与肌浆球蛋白头部构象变化及该部分蛋白聚集或相互作用引起的重排、巯基氧化形成二硫键导致分子发生聚合等因素密切相关[27]。不同温度下导致肌原纤维蛋白Ca2+-ATPase活力下降的因素不同,较高温度下Ca2+-ATPase活力降低是由巯基氧化和pH值下降引起;较低温度下,pH值下降缓慢,Ca2+-ATPase活力降低则主要由巯基氧化引起[28]。曾名勇等[28]研究发现在不同冻藏温度下,鱼肌肉蛋白的Ca2+-ATPase活力均呈下降趋势,且冻藏温度的降低有利于减缓Ca2+-ATPase活力的下降。
2.7 冻融循环对大目金枪鱼总蛋白降解作用的影响
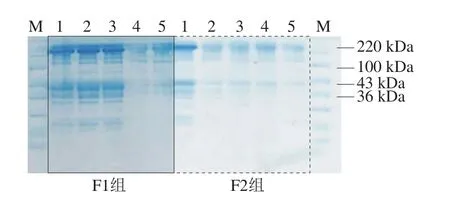
图7 冻融循环对大目金枪鱼总蛋白降解作用的影响Fig.7 Effect of freeze-thaw cycles on total protein degradation in big-eye tuna
由图7可以看出,肌原纤维蛋白主要有4 个条带,这些条带由上至下依次是肌球蛋白重链(220 kDa)、副肌球蛋白(100 kDa)、肌动蛋白(43 kDa)、原肌球蛋白(36 kDa)。
如图7所示,大目金枪鱼肉经反复冻融后,蛋白条带随冻融循环次数的增加而逐渐变窄变淡,5 次冻融循环后220、100、43 kDa和36 kDa处蛋白条带已基本消失。其中,F2组的变化最明显,其在第1次冻融后蛋白条带灰度已明显减弱,而F1组样品的变化较缓,其在第3次冻融时条带仍保持较明显的灰度。结果表明反复冻融会使肌肉蛋白发生部分降解,冻融循环次数越多,则蛋白质降解越明显,同时巯基基团间相互作用导致更多二硫键生成,蛋白质溶解度下降,发生变性聚集;冻藏、解冻温度越高,其降解速度也越快。Lan Weiqing等[29]研究了反复冻融对南美白对虾蛋白质变化影响,结果与本实验相符。大目金枪鱼在冻融过程中的肌原纤维蛋白含量、总巯基含量、Ca2+-ATPase活力与SDS-PAGE分析结果均能反映其蛋白质功能特性显著劣变,由此判断随着冻融循环次数的增加,样品的蛋白质功能特性发生显著变化,在第4次冻融时已发生腐败。
2.8 大目金枪鱼水分LF-NMR与MRI分析结果
LF-NMR技术一般将氢核(1H)作为研究对象。弛豫是通过非辐射的方式,使氢核从高能态向低能态转变的过程。与纵向弛豫时间(自旋-晶格弛豫时间)T1相比,横向弛豫时间(自旋-自旋弛豫时间)T2能更准确区分样品中不同状态的水分,因此食品中弛豫时间多用氢质子的横向弛豫时间T2表示。T2越小,表示水与其他分子结合越紧密;反之水分越自由。根据T2弛豫谱中曲线的波峰位置可判断出样品中水的存在状态,大分子结构中存在的水波峰区域为T2b(<1 ms),与大分子紧密结合水波峰区域为T21(1~10 ms),不可移动水波峰区域为T22(30~100 ms),可自由流动水波峰区域为T23(>100 ms)[30]。
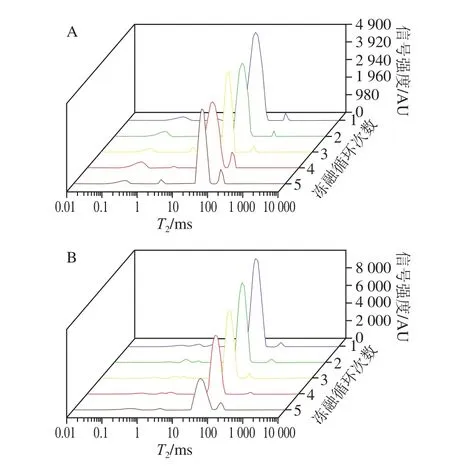
图8 冻融循环对大目金枪鱼横向弛豫时间变化的影响Fig.8 Effect of freeze-thaw cycles on water proton relaxation time in big-eye tuna
如图8所示,两组样品在冻融期间均呈现出T22峰的相对面积逐渐降低、T23峰相对面积相应升高的趋势;结合水相对含量基本保持不变,说明不可移动水随冻融循环次数的增加转变为自由水流出。其中,F1组样品随冻融循环次数增加自由水相对含量始终呈增加趋势,因为温度越低,汁液流失也越严重,F2组样品在冻融初期时不可移动水相对含量较高,到第4次冻融时则开始下降,两组冻融过程T2变化与汁液流失及蛋白质变性结果相符。由此可知,反复冻融会促进蛋白质的去折叠与变性,减弱蛋白质分子作用力,鱼肉组织结构发生物理变化导致肌节与肌纤维分离、肌纤维间缝隙增加、肌纤维保水性下降,处于鱼肉肌原纤维内的水分散失。Li Fangfei等[21]研究表明反复冻融过程中冰晶的重新分布与蛋白质变性造成的机械损伤是水分转移和流失的根本原因。
核磁成像伪彩图中的红色表示1H质子密度高,该部分鱼肉的水分含量高,蓝色表示水分含量低,因此由信号颜色变化可反映其水分含量与迁移特点[31]。
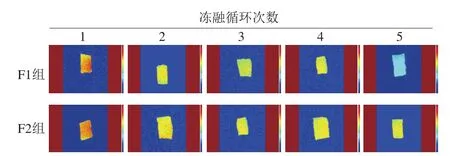
图9 冻融循环对大目金枪鱼MRI图像变化的影响Fig.9 Effect of freeze-thaw cycles on MRI image of big-eye tuna
由图9可知,氢质子密度图与鱼肉的横向弛豫时间T2结果相符,随着冻融循环次数的增加,伪彩图中鱼肉的亮度逐渐下降。其中,F1组鱼样经过5 次反复冻融后,呈现较多蓝色,可见其解冻后汁液流失明显;F2组鱼样的含水量变化不明显。由此表明反复冻融过程中,F1组鱼肉的蛋白质结构已发生改变,存在于肌原纤维内的不可移动水随着冻融循环次数的增加而转变为自由水流失。蛋白质在冻藏过程中疏水性的增加可归因于蛋白质的展开、疏水性脂肪酸与芳香族氨基酸的暴露。李侠等[32]通过MRI表征了不同冻藏温度下牛肉解冻后的汁液流失率,其结果与本实验结论相符。
3 结 论
反复冻融会引起大目金枪鱼肌肉质构特性变化,破坏其蛋白结构,影响食用品质。随着冻融循环次数的增加,解冻汁液流失率升高,鱼肉硬度、弹性与咀嚼性显著下降;肌原纤维蛋白含量、总巯基含量与Ca2+-ATPase活力下降,高铁肌红蛋白相对含量升高。反复冻融会使肌肉蛋白部分降解,冻融循环次数越多,蛋白质降解程度越明显,冻藏温度越高,其降解速度越快。其中,与F2相比,F1冻融处理虽能抑制鱼样中蛋白质的降解变性,但会导致汁液流失率升高,质构特性变差。因此,金枪鱼在运输、贮藏与消费过程中应健全冷链技术,尽量避免因温度波动引起肌肉的反复冻融,温度波动不宜剧烈,以减少其品质劣变。
