葫芦白粉病病原菌观察及系统进化分析
2021-05-19崔浩楠
丁 卓,崔浩楠,高 鹏
(1.东北农业大学 园艺园林学院,哈尔滨 150030;2.农业部东北地区园艺作物生物学与 种质创制重点实验室,哈尔滨 150030)
白粉病是危害葫芦科蔬菜的世界性真菌病害之一,在葫芦科作物的生产过程中广泛发生,严重影响葫芦科作物的产量和品质。到目前为止,研究发现的引起葫芦科蔬菜感染白粉病的真菌属于子囊菌亚门、核菌纲、白粉菌目下白粉菌属、内丝白粉菌属、单囊壳属等3个属,可细分为6个种[1]。在中国侵染葫芦科作物使其感染白粉病的主要病原菌是二孢白粉菌(Golovinomycescichoracearum,Gc;也为Erysiphecichoracearum)和单囊壳白粉菌(Podosphaeraxanthii,Px)[2]。白粉病的发病速度和传播速度极快,其孢子可通过空气传播,在高温高湿条件下更有助于病害的发生。国内春秋两季的生产中,温室大棚以及陆地都有不同程度的发生,影响葫芦科作物的生长,使其生长缓慢,对产量和品质造成严重危害[3]。选择抗病品种是防治白粉病的有效途径,抗白粉病育种成为主要的育种目标。
葫芦(Lagenariasiceraria)属于葫芦科葫芦属,具有食用、药用价值,是中国南方主要的蔬菜。同时葫芦作为工艺品有经济和收藏价值,此外葫芦作为西瓜重要的砧木材料,选择抗白粉病的葫芦作为嫁接砧木,能够降低西瓜白粉病危害[4]。引起葫芦科作物的白粉病菌有很多,不同地区致病的菌种并不相同。顾海峰等[5]对上海不同地区进行鉴定,引起致病的主要白粉病菌为单囊壳白粉菌(Podosphaeraxanthii),优势生理小种为1号生理小种,浦东地区发现的生理小种为2F。引起北京地区的白粉病菌主要是Podosphaeraxanthii,优势生理小种则为2F[6]。徐志豪等[7]对侵染甜瓜的白粉病菌进行研究发现,生理小种主要为Podosphaeraxanthii生理小种1。虽然前人有关于葫芦科相关作物白粉病菌研究的报道,但中国对于侵染葫芦的白粉病菌研究报道少见,并且系统发育关系不明,观察鉴定葫芦白粉病的病原菌及其生理小种对葫芦白粉病抗性育种具有重大意义。本研究于2018年8月在黑龙江省哈尔滨市东北农业大学设施园艺工程试验中心种植葫芦,等待其自然发病,观察病原真菌的形态特征,以及克隆真菌ITS区序列进行Blastn分析,对侵染葫芦的白粉病菌进行鉴定,确定其病原菌种类;同时将其ITS区与不同地区不同作物采集到的白粉病菌的ITS区进行系统进化分析;以期为葫芦抗白粉病育种提供借鉴。
1 材料与方法
1.1 白粉病菌分生孢子采集纯化及生理小种的鉴定
2018年6月,在东北农业大学设施园艺工程试验中心种植葫芦材料以及13份葫芦科白粉病鉴别寄主,待葫芦材料自然发病,从感染白粉病菌的葫芦叶片上采集白粉病分生孢子。参考郭丽霞等[8]的方法对采集到的白粉病分生孢子进行单孢子分离纯化培养,根据柯赫氏法则,将纯化后的白粉病菌回接到葫芦和13份鉴别寄主上,调查13份鉴别寄主的抗感情况。
1.2 观察病原菌形态特征
对感染白粉病的葫芦叶片采用考马斯亮蓝法进行染色观察。将感染白粉病的葫芦叶片浸泡在脱色液中(0.15%三氯乙醇-三氯甲烷),60 ℃恒温水浴直至叶片完全脱色,用清水冲洗后,浸泡于染色液中[0.15%三氯乙酸和 0.6%考马斯亮蓝 R-250(溶于99%甲醇中)混合液],染色 5 min,取出后用清水冲净,在光学显微镜下观察菌丝、分生孢子梗的形态结构以及分生孢子的形态,测定分生孢子和足细胞的长宽,与已知的白粉病病原菌形态进行比较鉴定。
1.3 白粉病菌DNA的提取
用软毛刷采集感病叶片表面由单孢子培养产生的白粉病菌分生孢子,采用改良的CTAB法[9-10]对白粉病菌的DNA进行提取,并溶解在ddH2O中。利用琼脂糖凝胶电泳检测提取到的白粉病菌DNA的质量与浓度。
1.4 PCR 扩增
1.4.1 引物序列 使用真菌核糖体ITS区段通用的ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCGTAGGTGAACCTGCGG-3′)作为扩增葫芦上白粉病菌ITS区的引物。引物由上海生工生物工程有限公司合成。
1.4.2 PCR扩增体系 PCR 扩增反应液总量为20 μL(ExTaq10 μL,上下游引物各1 μL,模板DNA 3 μL,ddH2O 5 μL)。
1.4.3 PCR反应程序 94 ℃预变性3 min, 94 ℃变性45 s,60~45 ℃退火(每个循环降 0.5 ℃)45 s,72 ℃延伸1 min,30个循环; 94 ℃变性45 s,45 ℃退火45 s,72 ℃延伸1 min,10个循环。
1.4.4 PCR产物的检测 PCR 扩增反应完毕后,取5 μL PCR产物,用1%的琼脂糖凝胶电泳进行检测。
1.5 克隆和测序分析
将PCR扩增后的产物利用胶回收试剂盒(TaKaRa)回收,将目的片段连接T1载体(TransGen Biotech)并转化大肠杆菌(DH5α),在选择培养基上筛选,挑取阳性克隆在LB液体培养基中进行培养,通过菌液PCR进行检测,将检测后的菌落交由上海生工生物公司进行测序。将测序结果提交GenBank核酸序列数据库(http://www.ncbi.nlm.nih.gov/)。并将测序得到的准确序列在NCBI网站上的GenBank核酸序列数据库进行Blastn分析,下载对比结果同源性高的菌种ITS区序列(含5.8s),利用ClustalX[11]软件对序列进行多重比对,用MEGA6.0[12]对上述序列采用邻近距离法(Neighbour-hoodJoining)构建系统进化树来进行系统进化分析。
2 结果与分析
2.1 葫芦白粉病菌的形态特征
利用考马斯亮蓝法对白粉病菌进行染色,结果如图1所示,在显微镜下观察到葫芦上的白粉病菌的菌丝生长在大小不同、形状各异的约8 μm左右宽的附着孢上,有隔膜,呈分枝状、长直或弯曲。分生孢子呈椭圆或直筒形,大小为:长(28~42 μm)×宽(15~22 μm),长宽比例平均为 1.5~ 2.0。分生孢子梗简单无分枝,长90~260 μm、宽10~14 μm。足细胞呈圆形,长38~75 μm,肌底隔轻微收缩并且有1~4个短细胞,未见闭囊壳。分生孢子串生,内含有纤维体,附着器乳头状,芽管通常较短,个别叉状,末端加粗。白粉病菌的形态特征与单囊壳白粉病菌一致[13],初步判断为单囊壳白粉菌。
2.2 侵染葫芦的白粉病菌生理小种的鉴定
对13份葫芦科白粉病鉴别寄主[14]‘IranH’ ‘Topmark’ ‘Vedrantais’ ‘PMR45’ ‘PMR5’ ‘WMR29’‘Eidisto47’ ‘PI414723’ ‘MR-1’ ‘PI 124111’ ‘PI 124112’‘PMR6’和‘Nantais Oblong’接种白粉病,其抗感情况如表1所示。结果表明,东北农业大学设施园艺工程试验中心的葫芦科白粉病菌属于单囊壳白粉菌1号生理小种。
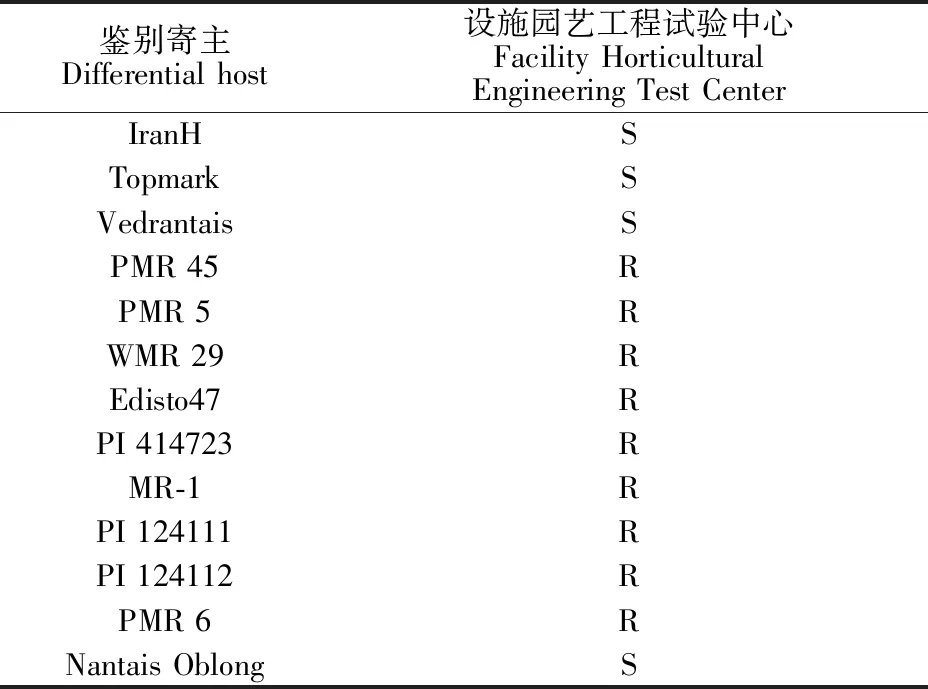
表1 鉴别寄主抗感反应Table 1 Identification of host anti-sense response
2.3 葫芦白粉病菌ITS区的PCR扩增及测序
采用真菌核糖体ITS区通用引物ITS1、ITS4对采集自葫芦的白粉病菌DNA进行PCR扩增,得到一段582 bp的5.8srRNA-ITS区序列,通过连接T1载体进行测序得到该片段的序列(图2)。这段序列已提交至NCBI(http://www.ncbi.nlm.nih.gov/)的GenBank数据库中登记,登录号为MG706136。
2.4 同源性序列的检测
将MG706136在NCBI上进行Blastn分析,得到同源性较高的ITS序列。经过统计发现,同源性较高的序列均属于子囊菌亚门,核菌纲,白粉菌目,白粉菌科,叉丝单囊壳属,如表2(1~24)所示。
2.5 ITS序列的比对及系统进化树的构建
将克隆得到的来自黑龙江省哈尔滨市的葫芦科白粉病菌的ITS序列(MG706136)与下载到的叉丝单囊壳属(Podosphaera)菌、高氏白粉菌属(Golovinomyces)菌以及白粉菌科节丝壳属杰丝壳属(Arthrocladiella)菌的ITS序列(表2)进行多序列比对,再用MEGA6.0软件采用近邻归群法(NeighborJoining,N-J)构建获得系统进化树(图3),穆氏节丝壳菌(Arthrocladiellamougeotii)作为系统进化树的外群。从系统发育树可以看出,同属于叉丝单囊壳属的KX369541、MG462908、AB046988、AB046989、AB040302、AB040319、AB040346、AB040345、AB040294、LC270779、AB040337、AB040327、AB040329、AB040295、AB040323、KM260704、KM260719、KR779869、KM260735、FJ625796、JX546297、AB040332、AB040350和AB046987聚为一大类,属于高氏白粉菌属的AF229016、AF229017、AB022413、AB077670、AB077635、AB077652、AB077696和AF031282聚为一大类,而作为外群的AF073358单独聚为一类。结果表明本研究在葫芦上采集到的白粉病菌属于叉丝单囊壳属。
3 讨 论
目前,对于葫芦科白粉病菌的鉴别主要通过镜检的方法,通过观察分生孢子是否具有纤维状体,从而区分P.xanthii与G.cichoracearums[15-16]。这种方法操作简便,但是要求试验人员具备丰富的观察经验,并且镜检方法无法得到更多的病原菌信息。被广泛采用的形态学分类鉴定方法无法支持白粉病菌的系统进化研究,不利于追踪白粉病的变异进化过程,因此必须进行分子层面的研究,核糖体RNA 的内转录间隔区(ITS)存在种内的丰富变异,进化的速率较快,广泛用于研究属内种间以及种以下个体之间的遗传关系,所以对葫芦科白粉病菌进行ITS区测序及分析,不仅可以从分子水平进行有效鉴定,还可以为追踪某一地区白粉病菌变异情况、研究白粉病菌之间的进化关系提供借鉴。
现在利用分子的手段对真菌种属鉴定以及系统进化分析比传统的方法更简便更准确[17]。真菌菌种种类多,传统方法对于某些形态特别相似的菌种鉴定过于困难,基于rDNA-ITS的序列分析能够从核酸序列中获得信息来反应亲缘关系,提高真菌鉴定的准确性。ITS区是rRNA的内部转录间隔区,存在丰富的变异以及高多态性,不同的菌种之间,即使是非常近的两个种,ITS序列都能表现出差异,但个体间的变异少见[18]。ITS区包含ITS1和ITS2两个不同的非编码区,位于18S~5.8S rDNA和5.8S~28S rDNA,具有高度保守性,ITS区的基因片段并不长,约 1 000 bp,容易对其进行克隆和序列分析[19]。
本文利用真菌形态特征以及ITS序列分析两种方法对葫芦上收集到的白粉病进行鉴定。通过镜检观察到的白粉病菌形态特征与感染葫芦科作物的单囊壳白粉菌基本一致。同时将该白粉病菌测序得到ITS区序列结果在NCBI上进行Blastn分析,结果发现得到的序列与西瓜和苦瓜上分离得到的单囊壳白粉菌(Podosphaeraxanthii)ITS区序列同源性为100%,系统进化分析结果表明,本研究分离到的病原菌与叉丝单囊壳属的真菌聚为一群,因此进一步确定采自哈尔滨东北农业大学的葫芦白粉病菌为单囊壳白粉菌。
研究表明,白粉病菌基因组内存在着大量的逆转录转座子,从而使得白粉病菌的基因组十分活泼,变异速度很快[10-23]。目前,大部分研究人员认为P.xanthii具有11个生理小种侵染葫芦科作物,而McCreight[14]在综合其他研究结果[24-34]基础上,认为P.xanthii已分化出28种生理小种侵染葫芦科作物。当前,关于甜瓜白粉病鉴别寄主的研究较少,虽然有研究者提出一种新的甜瓜白粉病鉴别方法[35],但是在甜瓜白粉病的研究中未见使用,利用13份鉴别寄主依旧是鉴别甜瓜白粉病生理小种的公认方法。同一植株对不同生理小种的真菌表现出不同的抗性,因此鉴定侵染葫芦植株的生理小种,对葫芦抗病育种具有重要 意义。
