那如三味丸治疗类风湿关节炎的网络药理分析*
2021-05-19白静茹张文兰
白静茹,白 力,张文兰
(1.内蒙古科技大学包头医学院第一附属医院风湿免疫科,内蒙古 包头 014010;2.包头医学院风湿免疫研究所;3.内蒙古自体免疫学重点实验室)
RA是一种慢性自身免疫性疾病,以侵蚀性、对称性多关节炎为主要临床表现,导致关节软骨和骨破坏,最终发展成关节畸形和功能丧失,严重影响患者生活质量[1]。蒙医中RA属于托列病的范畴。近期多种研究发现蒙药具有治愈率高、不易复发、副作用小等特点,因此蒙药用于防治RA具有良好的发展前景。
那如三味丸,又称那如苏木珠尔,由诃子,荜拨,制草乌组成,具有祛风,止痛,散寒作用,可用于治疗风湿、关节疼痛、白喉等症,是蒙医临床常用蒙药之一。有研究发现,在佐剂性关节炎(Adjuvant arthritis, AA)动物模型中,那如三味丸有明显的治疗作用,能够减轻大鼠足肿胀程度并降低炎性因子水平[2]。此外,在临床研究中,使用那如三味丸治疗RA能够缓解关节破坏,延缓疾病进展,且无明显药物不良反应[3]。其治疗RA疗效虽然明确,但是其靶点及作用机制尚有待探究。
网络药理学于2007年被提出,是建立在高通量组学数据分析、虚拟计算及网络数据库检索基础上,基于药物、成分、靶点之间的关联性,通过生物信息网络构建及网络拓扑结构分析,构建“药物-成分-靶点”网络;基于药物与药物之间的相同成分、功效和内在结构,构建“药物-药物”网络,探索药物有效成分的具体作用靶点和药物功效。综上,本次研究应用网络药理学方法全面解析那如三味丸治疗RA的机制,为后期生物学验证提供理论基础。
1 材料与方法
1.1那如三味丸活性成分信息及作用靶点的获取 从TCMSP数据库[4]获得那如三味丸的化合物信息,并以“经口服生物利用度”(OB)≥30%、“类药性指数”(DL)≥0.18为条件筛选化合物,将筛选出的药物活性成分以Smile ID格式输入到SwissTarget Prediction数据库[5],预测化合物的作用靶点,选取基因疾病多效性指数(Disease pleiotropy index for the gene, DPI)大于0.75的靶点,保留靶点Uniprot ID、名称等信息。
1.2RA靶点的获取 在DisGeNET数据库[6]中输入“Rheumatoid arthritis”,获取RA相关靶点,将上述获得的化合物作用靶点与RA靶点进行匹配,筛选出共同靶点,得到那如三味丸治疗RA的潜在靶点。
1.3蛋白-蛋白相互作用网络构建分析 将潜在靶点信息导入到String数据库[7],获得靶点间的蛋白-蛋白相互作用(Protein-protein interaction, PPI)网络关系,导出图片。
1.4网络分析及Hub节点选择 将潜在靶点的Uniprot ID导入到Cytoscape软件的GO插件中,种属设置为“Homo sapiens”,设置P≤0.05,选择Molecular Function、Biological Process、Immune System Process分析及KEGG分析,应用气泡图和Cytoscape进行可视化处理。应用CytoHubba插件在靶点通路图中筛选关键靶点及通路。
2 结果
2.1那如三味丸治疗RA的潜在靶点 根据TCMSP数据库收录情况,结合OB及DL筛选,找到那如三味丸化学成分29个,应用化合物分子结构在SwissTarget Prediction数据库预测靶点,并与DisGeNET数据库获得的RA靶点进行匹配,获得那如三味丸治疗RA的潜在靶点106个,根据DPI排序。见表1。

表1 那如三味丸治疗RA的潜在靶点

55CYP2C19P33261cytochrome P450 family 2 subfamily C member 190.85756PPARGP37231peroxisome proliferator activated receptor gamma0.85757MAPK1P28482mitogen-activated protein kinase 10.85758CYP2C9P11712cytochrome P450 family 2 subfamily C member 90.85759JUNP05412Jun proto-oncogene, AP-1 transcription factor subunit0.85760BCL2L1Q07817BCL2 like 10.85761TERTO14746telomerase reverse transcriptase0.85762HPRT1P00492hypoxanthine phosphoribosyltransferase 10.85763PLATP00750plasminogen activator, tissue type0.85764HPGDSO60760hematopoietic prostaglandin D synthase0.85765FGF2P09038fibroblast growth factor 20.85766SIRT1Q96EB6sirtuin 10.85767CASP8Q14790caspase 80.85768MCL1Q07820BCL2 family apoptosis regulator0.85769MAPK3P27361mitogen-activated protein kinase 30.85770BRAFP15056B-Raf proto-oncogene, serine/threonine kinase0.85771CCR2P41597C-C motif chemokine receptor 20.85772CFTRP13569cystic fibrosis transmembrane conductance regulator0.85773DNMT1P26358DNA methyltransferase 10.85774APPP05067amyloid beta precursor protein0.85775SHHQ15465sonic hedgehog0.85776PPARAQ07869peroxisome proliferator activated receptor alpha0.85777PTPN22Q9Y2R2protein tyrosine phosphatase, non-receptor type 220.82178ALOX5P09917arachidonate 5-lipoxygenase0.82179DHFRP00374dihydrofolate reductase0.82180STSP08842steroid sulfatase0.82181TYMSP04818thymidylate synthetase0.82182MMP1P03956matrix metallopeptidase 10.82183VCAM1P19320vascular cell adhesion molecule 10.82184NR3C1P04150nuclear receptor subfamily 3 group C member 10.82185SELEP16581selectin E0.82186NFKBIAP25963NFKB inhibitor alpha0.82187ESR2Q92731estrogen receptor 20.82188PTGS1P23219prostaglandin-endoperoxide synthase 10.82189CCR3P51677C-C motif chemokine receptor 30.82190CYP19A1P11511cytochrome P450 family 19 subfamily A member 10.82191PGRP06401progesterone receptor0.82192GSTK1Q9Y2Q3glutathione S-transferase kappa 10.82193PLGP00747plasminogen0.82194NR1I2O75469nuclear receptor subfamily 1 group I member 20.82195FLT1P17948fms related tyrosine kinase 10.82196EDNRAP25101endothelin receptor type A0.82197PTPN11Q06124protein tyrosine phosphatase, non-receptor type 110.82198CASP1P29466caspase 10.82199GSTM2P28161glutathione S-transferase mu 20.821100RAF1P04049Raf-1 proto-oncogene, serine/threonine kinase0.821101EDNRBP24530endothelin receptor type B0.821102ELANEP08246elastase, neutrophil expressed0.821103EZH2Q15910enhancer of zeste 2 polycomb repressive complex 2 subunit0.821104FGFR1P11362fibroblast growth factor receptor 10.821105MAP2K1Q02750mitogen-activated protein kinase kinase 10.821106CDC42P60953cell division cycle 420.821
2.2靶点PPI网络 将106个交集靶点导入String数据库中,设置种属为人类,获得PPI网络。图中MAPK1、MAPK3、信号传导及转录激活蛋白-3(Signal transducer and activator of transcription-3, STAT-3)、表皮生长因子受体(Epidermal growth factor receptor, EGFR)在网络中自由度较高。见图1。
2.3网络分析 将106个靶点的Uniprot ID导入Cytoscape的GO插件中,进行Molecular Function、Biological Process、Immune System Process分析,获得靶点相关功能。应用气泡图对靶点参与的功能及生物过程进行可视化处理并对靶点基因参与的免疫过程进行分析。见图2,图3,表2。

图1 那如三味丸治疗RA的PPI网络图
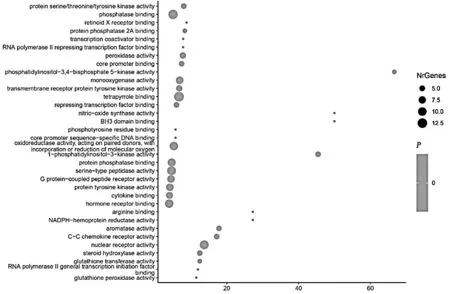
图2 那如三味丸靶点基因的主要功能

图3 那如三味丸靶点基因参与的生物过程
2.4信号通路分析及Hub节点选择 将靶点导入KEGG数据库,获得靶点参与信号通路信息,应用Cytoscape建立靶点-信号通路图;应用CytoHubba插件对网络图进行分析,筛选得到Hub节点,排名前3的信号通路为PI3K-Akt信号通路、趋化因子信号通路、HIF-1信号通路,关键靶点为MAPK1和MAPK3。见图4,图5。
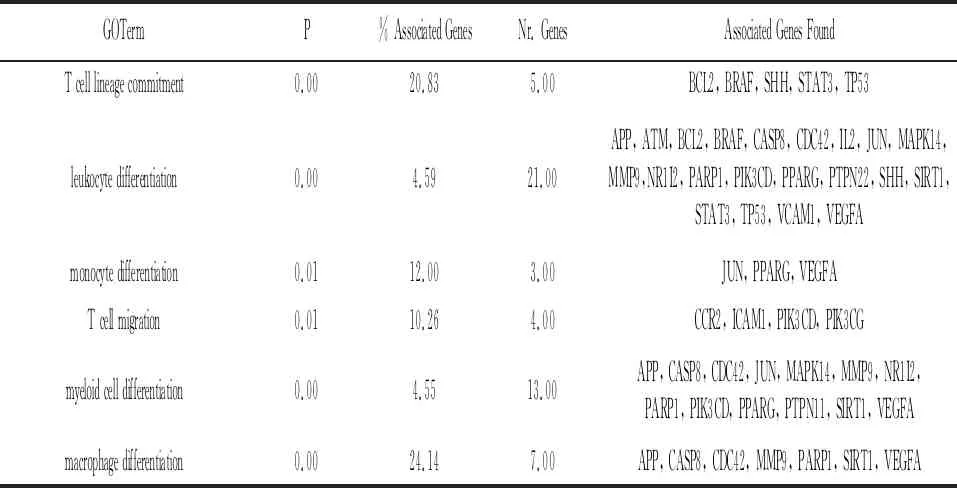
表2 那如三味丸靶点基因参与的免疫过程

图4 那如三味丸靶点-信号通路图

图5 那如三味丸治疗RA的关键靶点及通路
3 讨论
RA是由T细胞、B细胞、中性粒细胞等进入关节腔诱导的持续炎症[8-9]。由于其发病机制复杂,常用的药物以单一靶点治疗RA疗效欠佳,而蒙药具有多途径、多靶点治疗RA的作用特点,可发挥较好的治疗效果。本研究首先通过数据库预测到那如三味丸治疗RA的106个靶点,并通过String数据库构建PPI网络图,获得靶点间相互作用关系。在106个靶点中,MAPK1、MAPK3、STAT3、EGFR、AKT1与多种蛋白存在紧密联系,且炎症相关靶点Toll样受体-4(Toll-like receptor 4, TLR-4)、前列腺素内过氧化物合酶-2(Prostaglandin-endoperoxide synthase 2, PTGS2)、核因子κB1(Nuclear factor kappa-B1, NF-κB1)在网络中自由度较高[10-12]。前期研究发现那如三味丸可通过miR-250a/P65途径发挥抗炎作用[13],与本研究预测靶点相同,证明了结果的可靠性;应用GO分析,发现那如三味丸治疗RA的靶点通过调节细胞因子结合、G蛋白偶联肽受体活性、PI3K活性等功能发挥治疗作用;靶点通过参与细胞因子介导的信号通路、炎症反应的调节、调节免疫应答中涉及的细胞因子产生等29种生物过程及白细胞分化、巨噬细胞分化等6种免疫过程来影响RA的进展;应用KEGG通路分析,发现靶点参与PI3K-AKT信号通路、趋化因子信号通路、HIF-1信号通路等与RA密切相关的信号通路22条,最终确定的关键靶点及通路包括:MAPK1、MAPK3、PI3K-Akt信号通路、趋化因子信号通路及HIF-1信号通路。
关键靶点中MAPK1/ERK2和MAPK3/ERK1是ERK信号通路的关键蛋白,ERK信号通路为MAPK经典信号通路,通过磷酸化激活的级联反应对炎症起到调控作用。以往研究发现,ERK信号通路可介导RA滑膜成纤维细胞增殖,参与RA进展[14];中药复方二妙散可抑制ERK信号通路靶向治疗RA[15],与此相同。本研究预测那如三味丸可通过MAPK1、MAPK3抑制ERK信号通路,从而抑制RA滑膜成纤维细胞增殖。
关键通路中,PI3K-Akt信号通路与RA多种病理过程密切相关,由于该通路可作用多种不同的底物,决定了PI3K-Akt信号通路功能的多样性。研究发现通路在RA中以NF-κB为底物可增加抑瘤素M(Oncostatin M, OSM)的表达,OSM可诱导炎症反应并影响成骨细胞功能[16];Tian等[17]研究发现,白藜芦醇可通过抑制PI3K-Akt信号通路降低肿瘤坏死因子-α(Tumor necrosis factor-α, TNFα)诱导的白介素1-β(Interleukin 1-β, IL-1β)及基质金属蛋白酶3(Matrix metalloproteinase 3, MMP3)的表达。本研究结果预测那如三味丸可能靶向PI3K-Akt信号通路发挥治疗意义。趋化因子信号通路是与RA密切相关的信号通路,RA发生后滑膜组织大量表达趋化因子,趋化淋巴细胞和单核细胞/巨噬细胞的迁移,诱导持续的炎症发生,因此以趋化因子信号通路为靶点,可减轻滑膜组织的炎症反应。关键信号通路HIF-1在RA的血管翳形成中发挥重要作用,RA关节腔内存在缺氧情况[18],缺氧诱导的HIF-1信号通路可促进血管翳形成,最终导致关节病变及软骨破坏,因此那如三味丸可能通过HIF-1信号通路减少血管翳的形成,延缓疾病的进展。
本研究通过网络药理学方法全面分析了蒙药那如三味丸治疗RA的作用机制,通过分析发现那如三味丸可通过MAPK1、MAPK3、EGFR、AKT、STAT3等靶点,发挥抗炎、减少血管翳形成等作用,干预RA的发生发展,研究结果为临床用药提供了更多理论支持,同时为后续的基础研究提供了可靠靶点。
