基于网络药理学探讨败酱草治疗大肠癌的作用机制*
2021-05-18吴梦雪彭涛崔亚新赵丽君
吴梦雪,彭涛,崔亚新,赵丽君
山西中医药大学 山西 太原 030024
中药是我国宝贵的资源,在丰富的中医理论指导下,从整体与局部关联的角度出发,通过药物中有效成分的体内代谢,实现药物对机体的系统调控[1]。运用网络药理学的方法研究中药的药效成分、潜在作用靶点,突破了传统研究的不足,具有快速灵活、准确率更高的特点[2]。败酱草又称鹿肠、泽败、苦菜等,始载于《神农本草经》,味辛、苦,性微寒,具有清热解毒、消痈排脓、祛瘀止痛之功,常用于肠痈、肺痈、疔疮肿毒等。王登等[3]通过数据挖掘发现,败酱草常与赤芍、蒲公英等清热解毒、化瘀止血类的中药配伍,治疗以带下病、腹痛及淋证最为常见,证候以湿热下注、瘀血内阻为主。孙桂芝教授[4]运用红藤、败酱草作为治疗大肠癌的药对,有清热解毒、活血祛瘀的功效。姜良铎教授[5]运用败酱草配赤、白芍等作为治疗大肠癌的核心用药。张冰教授[6]根据肿瘤患者正邪之气偏盛的不同,将治疗分为“扶正固本法、祛邪法和护肝肾”三法,认为邪气偏盛的癌症患者常伴有痰瘀、热毒等特点,选用鱼腥草、败酱草、白花蛇舌草等。张青教授[7]以“肺与大肠相表里”为理论基础,以薏苡败酱三仁汤为主,应用方中败酱草改善肠道炎性环境治疗直肠癌术后患者的前切除综合征。成分是中药发挥作用的基础,靶点是药物与疾病的纽带。本文将应用网络药理学的方法研究败酱草治疗大肠癌的主要活性成分和作用靶点,并对其作用机制进行探索与分析。
1 资料与方法
1.1 筛选败酱草关键成分通过中药系统药理学数据库与分析平台(traditional chinese medicine systems pharmacology database and analysis platform,TCMSP)获取败酱草化合物,根据药动学特性参数,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为筛选条件,其中OB是指药物经口服给药后被机体吸收进入血液循环的相对量和速率;DL反映化合物中的特定功能基团与已知药物的相似性;二者对中药化学成分活性的评估具有重要意义[8]。同时对败酱草的作用靶点进行筛选,将所收集的靶点汇总并去除重复靶点,即为药物的关键靶点。
1.2 筛选败酱草与大肠癌基因名称在Uniprot数据库中,输入败酱草关键靶点对应的基因名称,限定物种为“human”,将得到的结果导出并整理。在Drugbank、OMIM与TTD数据库中以“colorectal cancer”为关键词查询大肠癌的基因,并取三者合集。
1.3 药物—靶点网络构建与分析将败酱草关键活性成分与靶点分别编秩,将编好的网络文件导入Cytoscape3.8.0软件,建立药物成分-靶点网络,分析败酱草成分中起关键作用的靶点。
1.4 蛋白互作网络构建为了阐明关键蛋白质之间的相互作用,将筛选出的关键靶点导入STRING数据库,以高置信度≥0.700为条件导出,并导入Cytoscape3.8.0软件进行网络可视化分析,其中靶点的度值表示相互作用的靶点数。
1.5 GO功能、KEGG通路富集分析运用Metascape3.8.0数据库对败酱草抗大肠癌的靶点蛋白进行GO功能和KEGG富集通路分析,筛选P<0.05的GO功能和KEGG通路。
2 结果
2.1 败酱草化合物与靶点筛选结果通过TCMSP数据库查询到败酱草全部活性成分共52种,以 OB≥30%、DL≥0.18为筛选条件,得到关键成分13种,见表1。同时查询TCMSP数据库的败酱草关键成分对应的靶点,获得422个靶点,去除重复靶点,得到209个靶点,其中一种成分黄草乌碱丙(vilmorrianineC)无对应靶点,故舍弃。
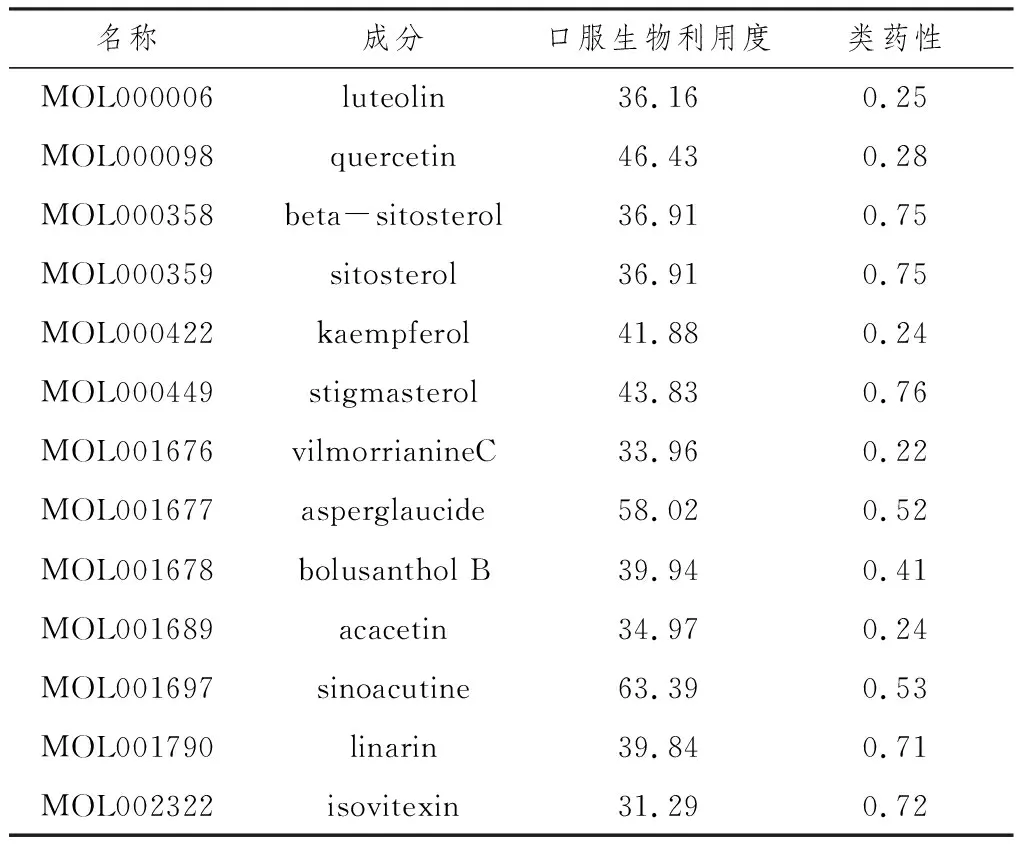
表1 败酱草关键成分筛选结果
2.2 败酱草治疗大肠癌的基因汇集运用Uniprot数据库将与败酱草靶点进行基因名匹配,去除无法匹配的基因后,共406个基因,去除重复基因后,共209个。在GeneCards、Drugbank、OMIM与TTD数据库中以“colorectal cancer”为关键词查询大肠癌基因,分别查询到25、200、87个基因名。对以上基因去重复,得到295个相关基因合集,与败酱草209个靶点基因进行交集后,得到33个共同基因,见图1。
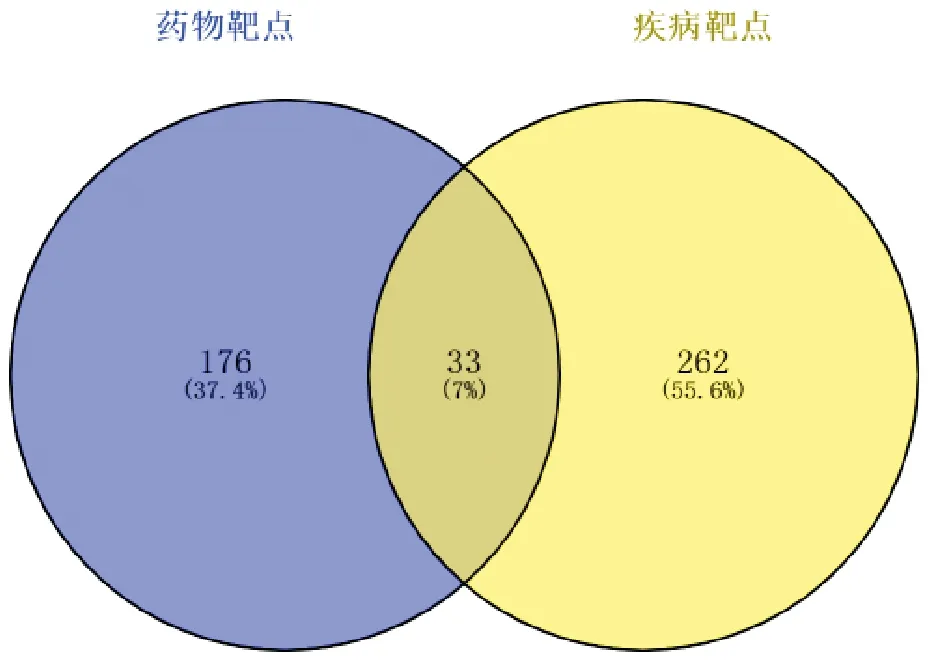
图1 药物-疾病靶点交集
2.3 败酱草成分-靶点网络构建运用Cytoscape 3.8.0软件构建药物活性成分-靶点网络。以败酱草12个主要活性成分及其去重后靶点共计209个,在该成分-靶点网络中,共有222个节点,418条边,以度值大小作为败酱草活性成分与靶点、靶点与靶点间相互联系的程度,度值越大,说明该成分或靶点在败酱草作用机制中有重要作用。如图2所示,黄色为药物,绿色为败酱草活性成分,橘色为药物靶点,成分中MOL000098(槲皮素)度值为150,MOL000422(山柰酚)度值为61、MOL000006(木犀草素)度值为57、MOL000358(β谷甾醇)度值为37、MOL000449(豆甾醇)度值为31,说明败酱草在治疗大肠癌时,槲皮素、山柰酚等成分起关键作用。同时,PTGS 2(前列腺素内过氧化物合成酶2)度值为10、NCOA2(核受体共激活剂2)度值为8,TOP2A(DNA拓扑异构酶2A)度值为7,AR(雄激素受体)度值为7,说明败酱草一个成分对应多个靶点,一个靶点对应多个成分,体现了败酱草多组分、多靶点治疗大肠癌的特点。
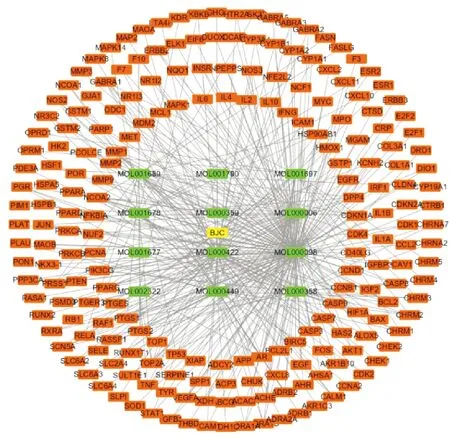
图2 败酱草成分-靶点网络
2.4 构建蛋白互作网络STRING数据库构建的蛋白互作网络中,含有33个蛋白质节点,其中F7为游离节点不参与蛋白互作,共140条边,平均节点度值8.48。将网络导入Cytoscape3.8.0软件进行可视化分析,红色圆圈代表蛋白质节点,圆圈越大说明度值越大,也就是与其相互作用的蛋白质越多。根据网络拓扑学参数,共筛选出14个蛋白,败酱草靶点中TP53(肿瘤P53蛋白,度值25)、AKT1(丝氨酸/苏氨酸蛋白激酶,度值19)、CASP3(半胱氨酸蛋白酶,度值16)、CCND1(G1/S特异性细胞周期蛋白D1,度值16)、VEGFA(血管内皮生长因子,度值15)、PTEN(磷脂酰肌醇-3,4,5-三磷酸3-磷酸酶和双特异性蛋白磷酸酶PTEN,度值15)、MYC(MYC原癌基因蛋白度,值15)等蛋白质间连线密集,说明败酱草在治疗大肠癌,这些蛋白相互作用较为密切,是关键蛋白,见图3。
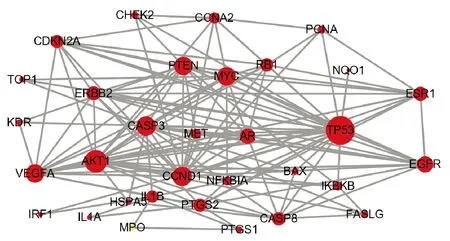
图3 蛋白互作网络
2.5 败酱草GO功能分析根据lgP值筛选的得到的前20条生物过程,显示败酱草的生物过程主要有对雌二醇应答、细胞对药物应答、上皮细胞增殖、凋亡信号通路、细胞增殖的负调控、蛋白质丝氨酸/苏氨酸激酶活性的调节、DNA结合转录因子活性的调节、细胞分化的负调控、凋亡过程中半胱氨酸型内肽酶活性的调节等,见图4。其细胞组分表示其作用部位可能在细胞内细胞器腔、膜筏、核染色体、细胞质等。
2.6 KEGG富集分析结果KEGG的分析结果中,经lgP值筛选后,富集信号主要集中在癌症通路、乙肝、癌症中的p53信号通路、流体剪切应力与动脉粥样硬化、TNF信号通路、FoxO信号通路等,见图5。涉及基因数目最多的前10条通路为Pathways in cancer癌症的途径、Hepatitis B(乙型肝炎)、MicroRNAs in cancer(癌症中的微小RNA)、Proteoglycans in cancer(癌症中的蛋白聚糖)、HTLV-I infection(HTLV-I感染)、PI3K-Akt signaling pathway(PI3K-Akt信号传导途径)、Prostate cancer(前列腺癌)、Pancreatic cancer(胰腺癌)、Endocrine resistance(内分泌抵抗力)、Breast cancer(乳腺癌),与各种恶性肿瘤通路相关密切,见表2。
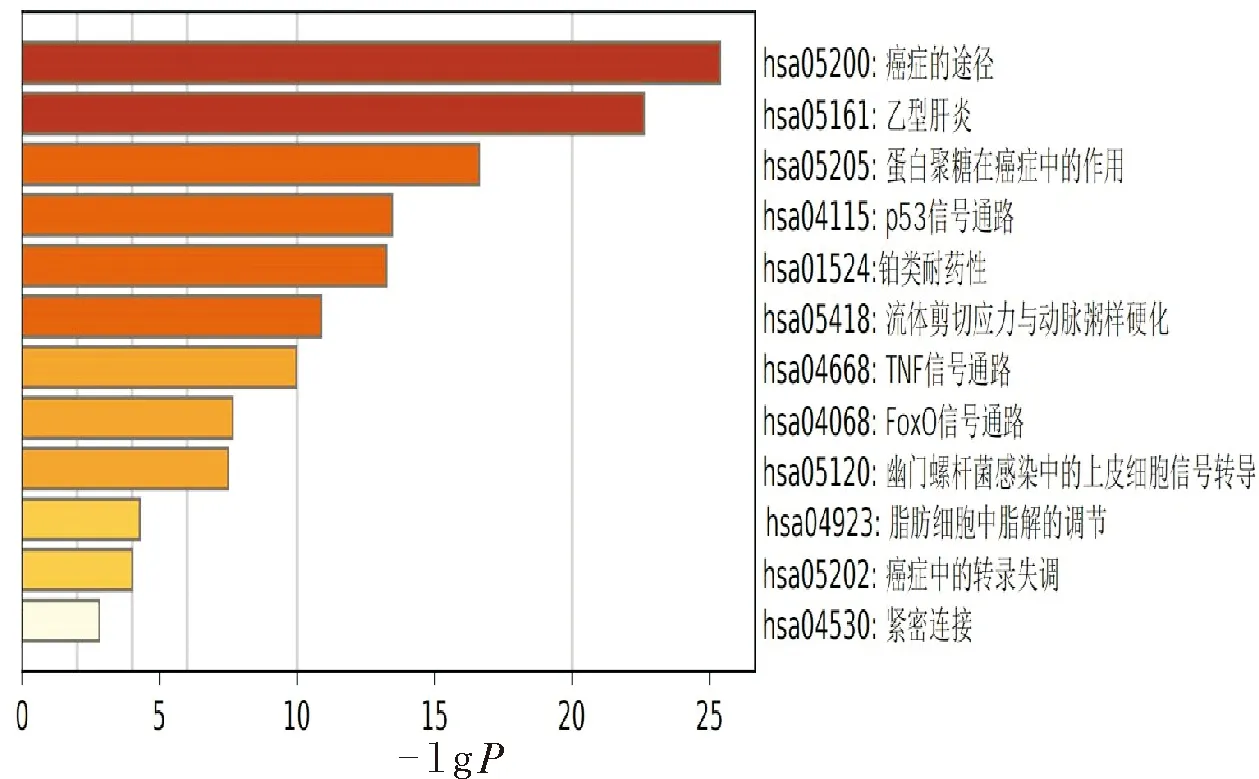
图5 败酱草KEGG富集分析

表2 靶点富集较多的通路
3 讨论
结直肠癌是常见的恶性肿瘤之一,据数据统计显示[9],低收入国家和中等收入的国家发病率较发达国家增长趋势更明显,城市发病率比农村高,东部地区比西部地区高,男性比女性高。研究显示[10],结直肠癌发病率的上升速度与社会经济的发展密切相关,人类发展指数升高,疾病的发病率也随之升高。研究表明,败酱草含有氨基酸、蛋白质、酚类、黄酮类、香豆素、皂苷等等多种活性成分[11],其对多种肿瘤细胞有抑制增殖、诱导凋亡的作用,如人肝癌细胞(HepG2)、人乳腺癌(MCF7)、宫颈癌细胞(U14)、人宫颈癌Hela细胞[12-14]。刘洋成[15]发现,白花败酱草可促进HepG2、A549细胞凋亡,与浓度成正比,且能损伤人非小细胞肺癌细胞(A549)的DNA染色体、诱导其停滞于细胞周期的G2/M期。沈德凤等[16]发现,黄花败酱草总苷水提取物可抑制荷瘤小鼠的肿瘤生长。郑昌杰[17]发现,黄花败酱提取物能促进大鼠肠道蠕动,且其对减轻小鼠疼痛有良好的效果,还可减轻肠道的炎症环境[18]。腾阳等[19]用败酱草合剂联合电针治疗溃疡性结肠炎有改善作用。毛俊琴等[20]发现,败酱草中的环烯醚萜苷元可抑制小鼠的肿瘤细胞株增殖。孙燕[21]发现,败酱草能抑制HEPAL-6细胞的增殖。钱彩云等[22]发现,败酱草联合救必应可缓解DNA甲基化导致的结肠炎症相关性肠癌。根据“成分-靶点”网络图显示,槲皮素、山柰酚、木犀草素、β谷甾醇、豆甾醇等成分可作用多个药物靶点。药理研究已证明[23],黄酮、黄酮醇类化合物能通过调控自噬相关基因达到杀伤癌细胞的作用,如槲皮素主要通过抑制 COX-2的表达、抑制C(PKC)的活性、诱导癌细胞分化来发挥抗癌作用[24-25];山柰酚则通过影响癌细胞周期、抑制癌细胞增殖、激活细胞表面凋亡受体诱导细胞凋亡[26-27];木犀草素主要能抑制结直肠癌细胞的增殖[28]。化合物靶点中的TP53是人体的抑癌基因之一,在DNA损伤或癌基因表达时被激活,通过诱导细胞周期的阻滞、损伤的修复及细胞凋亡的过程,从而维持基因组的稳定与机体的稳态[29]。AKT1是ATK家族一个重要的亚型,能抑制上皮癌的侵袭和转移。CCND1是一种调节细胞周期的蛋白,基因此沉默可以阻滞G1-S的细胞周期进程,削弱癌细胞增殖,并促进癌细胞凋亡[30]。PTEN的抑癌主要通过去磷酸化细胞质膜上的脂质分子PIP3,从而拮抗P13K-AKT通路,抑制细胞生长、増殖,促进细胞调亡,达到抑癌[31]。MYC是人体中可将成纤维细胞诱导为干细胞的转录因子之一,与VEGFA启动子结合,促进VEGFA产生并随后萌发血管生成,与肿瘤干细胞有密切关系[32]。
本研究发现,败酱草对大肠癌的活性成分主要是黄酮类,如槲皮素、木犀草素、山柰酚等,且这些成分能作用于多个疾病靶点,但此文只对符合药动学参数的成分进行了分析,对某些败酱草中有确切治疗意义,却不符合筛选条件的成分可能有遗漏,需要进一步的研究。
