不同病态窦房结综合征造模方法对SAN结构、功能的影响
2021-05-18毕路甲,付升旗
毕路甲,付升旗
摘要:目的:不同病态窦房结综合征造模方法对窦房结(SAN) 解剖位置、组织细胞形态学及起搏相关离子通道功能的影响。方法:将36只兔随机分成假手术组、甲醛湿敷组和甲醛滴注组,每组12只。甲醛湿敷组兔采用甲醛湿敷法进行建模;甲醛滴注组兔采用甲醛滴注法进行建模;假手术组仅打开胸腔,剪开心包膜,不进行甲醛湿敷或甲醛滴注。HE染色观察SAN组织形态变化。采用心房调搏法测量造模前及造模后1 h的窦房传导时间(SACT) 、窦房结恢复时间(SNRT) 、校正窦房结恢复时间(SNRTc) 。采用心房调搏法测量造模前及造模后1 h的窦房传导时间(SACT) 、窦房结恢复时间(SNRT) 、校正窦房结恢复时间(SNRTc) 。Western blot检测SAN组织超极化激活环核苷酸门控非选择性阳离子通道(HCN4) 蛋白。结果:甲醛湿敷组和甲醛滴注组组织细胞形态学差异不明显(P > 0.05) 。甲醛滴注组SNRT、SNRTc和SACT高于甲醛湿敷组(P < 0.05) 。甲醛滴注组HCN4 mRNA和蛋白表达低于甲醛湿敷组(P < 0.05)。结论:甲醛湿敷法建立兔SAN损伤模型优于甲醛滴注法。
关键词:病态窦房综合征;窦房结;组织细胞形态学;离子通道
窦房结(SAN) 是各种哺乳动物心脏右心房上的一个特殊的小结节,能启动和调控心脏节律。病态窦房结综合征简称病窦综合征或病窦,又称窦房结功能障碍,是由窦房结病变而引起的一组由症状组成的心血管疾病[1~2]。对于明确诊断为病态窦房结综合征患者,无论是内科保守治疗还是外科手术介入治疗,临床患者都会受到一系列并发症的威胁,严重者可发生阿斯综合征导致晕厥,甚至猝死[3]。在探讨病态窦房结综合征治疗方法过程中,一个重要的研究手段是在动物身上复制SAN功能损伤模型。目前多采用手术方法或者药物方法建立窦房结功能损伤模型,然而对某一个体动物模型不同方式的建立对SAN以及起搏相关离子通道功能的影响尚无研究报道。本文采用甲醛湿敷法和甲醛滴注法对兔进行SAN损伤建模,比较两种不同建模方式对SAN组织细胞形态学及起搏相关离子通道功能的影响。现报道如下:
1 材料与方法
1.1 实验主要仪器和试剂
甲醛购自国药集团化学试剂有限公司;超级化激活的环核苷酸阳离子通道(HCN1) 、HCN2、HCN3、HCN4抗體以及相应的二抗购于Santa Cruz公司;RNA提取试剂TRIzol及转染试剂Lipofectamine 2000均购自武汉极捷生物科技有限公司;RIPA蛋白裂解液及BCA法蛋白浓度测定试剂盒购自金克隆(北京) 生物技术有限公司;ECL发光液购自北京伊塔生物科技有限公司;光学显微镜购于北京安麦格贸易有限公司;乌拉坦购自国药集团化学试剂有限公司;B203LED 型生物显微镜(重庆奥特光学仪器有限公司) ;DF-5A 型心脏电生理刺激仪(苏州市东方电子仪器厂) ;BL420S 生物机能实验系统(成都泰盟科技有限公司) 。
1.2 实验动物
普通级兔36只,雌雄各半,体重2.02~3.58 kg,购于吉林和元生物工程股份有限公司;许可证号:SYXK(吉) 2021-0004。将普通级兔随机分成甲醛湿敷组、甲醛滴注组和假手术组,每组12只。所有家兔适应性喂养1周后进行造模。甲醛湿敷组兔采用甲醛湿敷法进行建模,甲醛滴注组兔采用甲醛滴注法进行建模。假手术组所有兔仅打开胸腔,剪开心包膜,不进行甲醛湿敷或甲醛滴注。在整个实验过程中对动物的处置均符合医学伦理学标准。
1.3 实验方法
1.3.1 病态窦房综合征模型建立
所有兔经耳缘静脉注射 20 % 乌拉坦 4 ~5 mL/ kg 麻醉后固定,连接体表心脏Ⅱ导。第三肋骨水平为中心备皮、消毒后沿胸骨正中偏右 2 ~3 mm 纵行切开胸腔,暴露右心房,用注射器连接套管,深入心包膜腔内侧,轻轻吸取心包液。
湿敷法:用干棉签轻放于右心耳处,轻轻将心脏拨向左侧,暴露右心房与上腔静脉交界(SAN区) ,用40 %甲醛将棉签底部充分浸润,轻轻送至SAN区,湿敷3~5 min。当心率较湿敷前下降 30 %以上或出现窦性停搏、窦房阻滞或结性逸搏时取出棉签,观察心律变化情况。对未出现上述心律失常者则持续湿敷,并继续观察心律情况。
滴注法:将自制标测电极一端连接于心脏V1导联,另一端放置于窦房结区,标测窦房结电图,并固定位置,然后将自制标测电极末端接上装有40 %甲醛的微量注射器,弹丸样缓慢推注。当心率下降30 %以上或出现窦性停搏、窦房阻滞或结性逸搏时暂停推注,观察心律变化情况。对未出现上述心律失常者则持续推注,最大量至0. 03 mL。
1.3.2 SAN组织形态观察
按在建模1周后对兔进行麻醉、开胸、暴露心脏,去SAN组织制备标本。将切取的窦房结组织经生理盐水冲洗干净后立即置入4 %多聚甲醛固定,常规脱水、透明、石蜡包埋及HE染色,在光镜下观察窦房结细胞形态结构的改变。
1.3.3 检测SAN功能指标
采用心房调搏法测量造模前及造模后1 h的窦房传导时间(SACT) 、窦房结恢复时间(SNRT) 、校正窦房结恢复时间(SNRTc) 。比较各组模型兔造模前后SACT、SNRT和SNRTc。
(1) 实时荧光定量检测(RT-PCR) 检测HCN1、HCN2、HCN3、HCN4 mRNA表达:采用Trizol法提取SAN组织中的总RNA,采用紫外分光光度计法测定RNA的浓度。以RNA为模板进行逆转录获得cDNA并置于4℃保存,进行荧光定量PCR扩增,置于RT-PCR仪(CFX96型,美国bio-radBiorad公司) 中进行测定。设置反应条件:95 ℃,5 min预变性;95 ℃变性10 s,60 ℃ 退火35 s,65 ℃延伸 30 s,扩增35个循环。以β-action为内参,引物序列如下:HCN1:上游序列:5′-TGGTGGCTACAATGCCTTTA-3′,下游序列:5′-TTCCTCCGGGACCTCGTT-3′ ;HCN2:上游序列:5′-CGTTACCAGGGCAAGATGTTT-3′,下游序列:5′-GTTGTCCACGATCAGCGAAT-3′;HCN3:上游序列:5′-TCTCCGACACCTTCT。TTCTGC-3′,下游序列:5′-CCCACTGGTGTATGTAGCGG-3′;HCN4:上游序列:5′-GTACTCCTACGCGCTCTTCA-3′,下游序列:5′-GCTCTCCTCGTCGAACATCT-3′;β-action:上游序列: 5′-GGAGCGAGATCCCTCCAAAAT-3′,下游序列:5′-GGCTGTTGTCATACTTCTCATGG-3′。采用 2-ΔΔCT 法对统计HCN1、HCN2、HCN3、HCN4 mRNA相对表达量。
(2) Western blot检测起搏相关蛋白:取左心室SAN区心肌组织,裂解以3000 r/min转速离心10 min,取上清液,提取心肌组织蛋白,经BCA法检测蛋白浓度;凝胶电泳后转膜;5 %脱脂奶粉封闭孵育2 h,添加相应的一抗和二抗,选择GAPDH作为内参,使用ECL法显示蛋白。
1.4 统计学处理
应用 SPSS 22.0 软件进行统计分析。所有实验数据均符合正态分布,计量资料用(均数±标准差)表示,t检验;计数资料采用[n(%) ]表示,χ2检验。检验水准为α = 0.05,以双侧P < 0.05时,说明该数据具有显著性统计学差异。
2 结果
2.1 SAN损伤模型兔SAN变化
与假手术组相比,甲醛湿敷组和甲醛滴注组可见SAN细胞出现明显肿胀,部分粒细胞浸润和胶原纤维组织增生。甲醛湿敷组和甲醛滴注组组织细胞形态学差异不明显(P > 0.05) 。
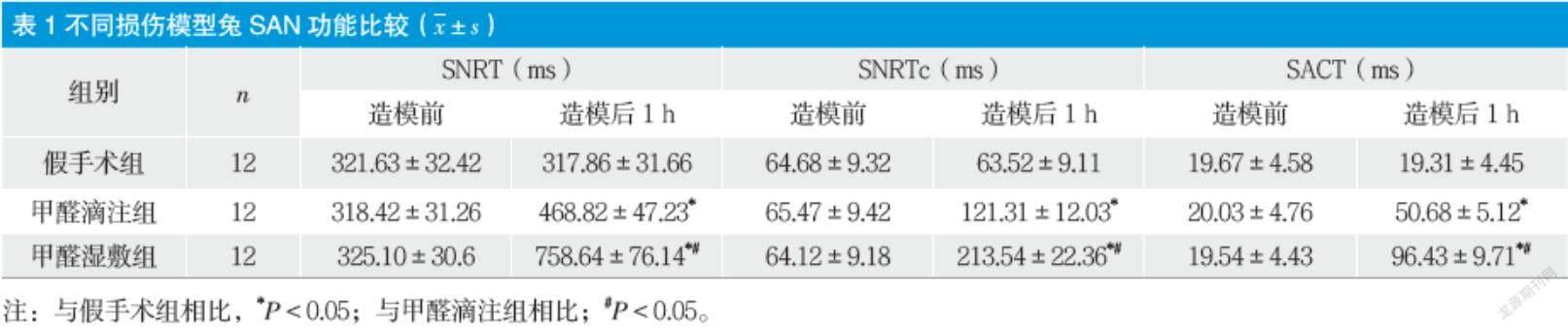
2.2 不同損伤模型兔SAN功能比较
三组兔造模前SNRT、SNRTc和SACT比较无明显差异。造模后,与假手术组相比,甲醛湿敷组和甲醛滴注组SNRT、SNRTc和SACT明显上升(P < 0.05) ,且甲醛湿敷组SNRT、SNRTc和SACT明显高于甲醛滴注组(P < 0.05) 。见表1。
2.3 不同损伤模型兔SAN区HCN1、HCN2、HCN3和HCN4mRNA表达
研究结果发现,甲醛湿敷组和甲醛滴注组主要以HCN4 mRNA表达为主,少量HCN1、HCN2表达,未检出HCN3 mRNA 表达。甲醛湿敷组和甲醛滴注组HCN4 mRNA分别为(0.86±0.09) 、(0.63±0.07) 明显低于假手术组HCN4 mRNA表达(1.02±0.01) ,且甲醛湿敷组HCN4 mRNA表达低于甲醛滴注组HCN4 mRNA表达(P < 0.05) 。
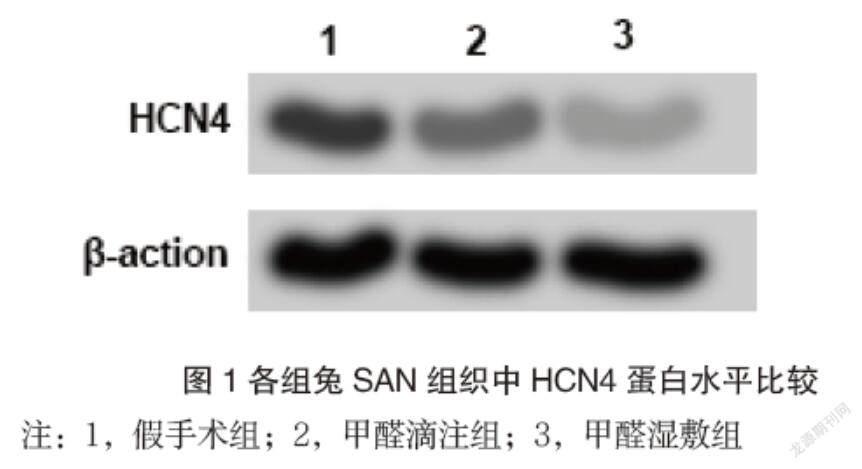
2.4 不同损伤模型兔SAN区HCN4蛋白表达
甲醛湿敷组和甲醛滴注组HCN4蛋白相对表达水平明显低于假手术组,且甲醛湿敷组HCN4蛋白相对表达水平低于甲醛滴注组HCN4蛋白相对表达水平(P < 0.05) 。见图1。
3 讨论
SAN呈非特异性退行性纤维变性,是导致病态窦房结综合征的重要因素[4]。在该病变过程中起搏细胞逐渐被纤维组取代,从而导致SAN起搏细胞的直接减少,其正常起搏功能逐渐减退[5]。这些起搏细胞拥有特殊的离子通道流的组合,当SAN受到损伤时,这些起搏细胞原有的功能会出现异常,导致严重的心动过缓、高度房室传导阻滞等心律失常的发生。
本研究结果显示,甲醛湿敷组和甲醛滴注组可见SAN细胞出现明显肿胀,可见部分粒细胞浸润和胶原纤维组织增生,但甲醛湿敷组和甲醛滴注组组织细胞形态学差异不明显,说明甲醛湿敷和甲醛滴注均可对兔SAN区造成一定的损伤。本研究结果还发现,与假手术组相比,甲醛湿敷组和甲醛滴注组SNRT、SNRTc和SACT明显上升,且甲醛湿敷组SNRT、SNRTc和SACT上升幅度明显大于甲醛滴注组。甲醛滴注法利用SAN损伤电图的特异性,角度新颖,同时对兔产生的创伤较小,但SAN电图测量困难,容易受到自身或外界其他因素影响,使得造模损伤程度无法控制。甲醛湿敷法虽然对兔创伤大,但便于控制模型的损伤程度。本研究结果显示,甲醛湿敷组SNRT、SNRTc和SACT下降幅度明显大于甲醛滴注法,分析其原因可能是因为心脏表面光滑,不易于甲醛吸附在心脏表面,导致SAN损伤程度不足造成,其具体原因需进一步研究分析。本研究分析不同建模方式对起搏相关离子通道功能的影响发现,甲醛湿敷组和甲醛滴注组均以HCN4表达为主,少见HCN1、HCN2表达,且甲醛湿敷组HCN4 mRNA和蛋白表达水平明显低于甲醛滴注组。HCN是一种环总超家族阳离子通道,主要存在于细胞膜上,其异常表达可能导致严重的SAN功能障碍[6]。既往研究显示[7],SAN免疫组化染色显示HCN4表达位于结中央区,向周边逐渐减少,甲醛加压注射渗透法建立兔SAN组织损伤模型后,兔SAN组织HCN4蛋白表达有不同程度的下降。本研究结果说明,两种SAN损伤建模方式对HCN4通道均有影响,但甲醛湿敷组影响较大,可能与其对SAN造成的损伤程度有关。
综上所述,甲醛湿敷法建立兔SAN损伤模型优于甲醛滴注法。一个理想的制造病态窦房综合征模型试剂,首先必须能对作用区域的心肌细胞造成一定程度的损伤。其次,其作用范围及程度可控,不致使药液作用范围过大而损伤正常心肌组织。
参考文献
[1]De Ponti R, Marazzato J, Bagliani G, et al. Sick Sinus Syndrom[J]e. Card Electrophysiol Clin, 2018, 10(2):183-195.
[2]Canpolat U, Yorgun H, Aytemir K. Treatment of Sinus Node Artery Occlusion During Anterior Left Atrial Tachycardia Ablation Using Intracoronary Tirofiban[J]. JACC Clin Electrophysiol, 2019, 5(7):870-871.
[3]Khanna S, Sreedharan R, Trombetta C, et al. Sick Sinus Syndrome: Sinus Node Dysfunction in the Elderly[J]. Anesthesiology, 2020, 132(2):377-378.
[4]王威,张世林,刘芳芳,等.窦房结病理性纤维化的研究进展[J].法医学杂志,2021,37(2):225-232.
[5]De Ponti R, Marazzato J, Bagliani G, et al. Sick Sinus Syndrome[J]. Card Electrophysiol Clin, 2018, 10(2):183-195.
[6]Kharouf Q, Phillips AM, Bleakley LE, et al. The hyperpolarization-activated cyclic nucleotide-gated 4 channel as a potential anti-seizure drug target[J]. Br J Pharmacol, 2020, 177(16):3712-3729.
[7]刘如秀,暴美静,王妮娜,等.益阳活血方对损伤兔窦房结组织HCN4蛋白表达的影响[J].实用药物与临床,2012, (3):129-132,193.
