肠道分节丝状菌对宿主肠黏膜免疫系统的影响及其在模式动物中的研究进展
2021-05-17钟奇祺张海波黎力之廖晓鹏关玮琨郭冬生
钟奇祺,张海波,黎力之,廖晓鹏,关玮琨*,郭冬生*
(1.宜春学院生命科学与资源环境学院,江西省高等学校硒农业工程技术研究中心,宜春市功能农业与生态环境重点实验室,江西宜春 336000;2.宜春学院继续教育学院,江西宜春 336000)
肠道分节丝状菌(Segmented filamentous bacteria,SFB)自1849 年被发现并取名为“enteric flora”后,采用16S rRNA 基因序列分析法进行鉴定证实其为不同于梭菌亚属的一个新亚属,命名为“Segmented filamentous bacteria[1-2]。SFB 作为回肠末端优势菌,也是最早被报道对宿主先天性免疫和固有性免疫同时产生影响的肠道菌[3]。研究表明SFB 定植对动物肠黏膜免疫建立及肠道环境调控具有重要意义,一方面SFB通过向外伸出独特钩状结构与肠上皮细胞(Intestinal Epithelial Cells,IECs)紧密结合,使抗原借道IECs向CD4+T 细胞呈递,刺激其向辅助性T 17(T Helper 17,Th17)细胞分化,完善肠内免疫机制[4-5];另一方面,Th17 细胞所产生白细胞介素(Interleukin,IL)-17 与IL-22 协同促进β-防御素2 表达,保证肠道屏障结构与功能的完整性[6]。此外,SFB 促进IgA+B 细胞增殖,同时肠腔IgA 也高效作用于SFB 与IECs 结合位点,防止SFB 异常扩增,所以肠道SFB 与IgA 产生存在反馈调节[7-8]。目前关于SFB 与宿主肠黏膜免疫系统间相互作用的系统综述较为缺乏。因此,本文基于SFB 最新研究进展,重点阐述SFB 与Th17 细胞、IgA+B 细胞和固有淋巴细胞(Innate Lymphoid Cells,ILCs)的互作关系,并就SFB 在模式动物中的研究进行综述,为指导动物健康养殖提供理论参考依据。
1 SFB 简介
1.1 SFB 形态及生命周期 SFB 定植时形态发生改变,产生钩状突起作为细丝伸长点助力锚定,选择性黏附于宿主IECs[9]。SFB 附着IECs 后,细丝向远端生长分裂,随长度增长菌体内壁逐渐增厚至形成4 层细胞壁,同时中部开始内陷逐渐靠拢形成隔,将内膜包被小体分成不对称两小节,称为次级未分化细胞[10]。一旦次级未分化细胞分化为子细胞与母细胞,母细胞便将子细胞吞噬容纳,子细胞在其中又将分化为2 个细胞后代,随细丝扩散或形成孢子释放[11]。在适宜条件下,菌体内陷隔便降解形成管状结构,将细胞运送至宿主肠道内分散定植,开始新一轮黏附增殖;但非适宜条件时,后代细胞在母细胞内包裹肽聚糖后变为该宿主内缺乏定植能力的内生孢子,随粪便排出,直至外界适宜条件出现,水平传播给下一宿主,完成SFB 生命周期[12]。
1.2 SFB 代谢特征 对小鼠和大鼠SFB 分离物进行基因组测序后,发现皆为1.5~1.62 Mbp 的小基因组,含1 350~1 400 个蛋白质编码基因和低水平的G+C,序列内容与梭状芽胞杆菌属高度相似,二者最大区别在于糖利用途径不同[13]。SFB 基因组具有非氧化戊糖磷酸和葡萄糖转化为丙酮酸糖酵解途径的完整基因,但缺少有氧呼吸所必需的三羧酸循环途径的绝大多数基因[14]。当肠上皮表面SFB 定植位点上出现低氧时,SFB 将启动精氨酸酶与过氧化氢酶基因的表达,形成自我保护[10]。研究证实,SFB 存在极严重的营养缺陷,丧失几乎所有氨基酸(除赖氨酸)、维生素及辅酶因子的合成能力,完全依赖生存环境的供给维持自身[15]。此外,SFB 对铁的需要量异常强烈,其自身无法合成铁载体,但SFB可编码3 种铁摄取调节剂驱动周围细菌的铁载体,控制其他细菌中铁含量[16]。因此,SFB 代谢对肠内环境存在高度依赖性,印证其对IECs 紧密黏附的必要性,而这样的黏附作用又在SFB 抗原呈递刺激肠道免疫建立时发挥重要作用。
2 SFB 与动物肠黏膜免疫细胞的互作
2.1 SFB 与肠内Th17 细胞的互作 在抗原刺激下固有层CD4+T 细胞特异性增殖分化为Treg 细胞、滤泡辅助性T 细胞和Th17 细胞等不同亚群[17]。转录因子维甲酸受体的相关孤立受体γt 分泌IL-17A、IL-17F 和IL-22为Th17 细胞出现的特征,Th17 细胞出现后可有效保护宿主免受细菌和真菌感染,维持肠黏膜免疫稳态[18-19]。研究证实,SFB 阳性小鼠肠内Th17 细胞数量及IL-17水平显著高于SFB 阴性小鼠,可知SFB 影响Th17 细胞增殖及IL-17 分泌量[20-22]。SFB 不仅能生成特异性产物,对抗原呈递方式也存在选择。Goto 等[23]为证明SFB 诱导Th17 细胞增殖对主要组织相容性复合体 II(Major Histocompatibility Complex-II,MHC-II)的 依赖性,选用H2-Ab-/-小鼠(存在MHC-II 缺陷)移植野生型小鼠的CD4+T 细胞和SFB 菌株,结果显示小鼠体内存在高水平CD4+T 细胞,SFB 成功定植肠道,Th17细胞数量却明显低于野生型小鼠。探究MHC-II 各类表达细胞后,发现除CD11c+细胞外小鼠肠内树突状细胞(Dendritic Cells,DCs)不同亚群(CD11b+CD103+、CD11b-CD103+等)的耗竭对固有层中Th17 细胞水平不造成影响[22,24]。由此可见,肠道DCs 的MHC-II基因表达对于SFB 介导的Th17 细胞增殖具有重要作用。Yi 等[25]分别将源于大鼠和小鼠的SFB 定植于无菌小鼠体内,发现大鼠来源的SFB 促进Th17 细胞分化能力远低于小鼠,后续试验表明,其定植结果与缺乏黏附能力的SFB 变异株一致,说明SFB 的黏附能力是触发宿主CD4+T 细胞信号转导的关键。SFB 伸出钩状结构与IECs 产生紧密连接,出现独特的微生物黏附引发的内吞作用(Microbial Adhesion Triggered Endocytosis,MATE),更利于抗原捕获进行抗原呈递[21]。MATE 形成特有囊泡结构以获取SFB 细胞壁上以蛋白P3340 为主的抗原物质进入IECs,通过IECs 内体-溶酶体网络运送至细胞基底层,诱使血清淀粉样A 蛋白(Serum Amyloid A,SAA)产生,其中SAA1 与SAA2 高度表达作用于固有层CD11c+细胞,提高IL-6 和IL-23 分泌量,刺激幼稚CD4+T 细胞向Th17 细胞方向分化[21,26]。综上所述,SFB 利用独特黏附作用定植于宿主IECs,特异选择抗原呈递方式,诱导机体Th17 细胞增殖,维持黏膜稳态(图1)。SFB 可促进动物Th17 细胞增殖,加强宿主对致病菌及SFB 本身的防御。研究表明,IL-17 受体(IL-17 Repoter,IL-17R)可直接调控α-防御素、Nox1(一种NADPH 氧化酶)和多聚免疫球蛋白(Polymeric Immunoglobulin Receptor,pIgR)受体基因表达水平,是限制SFB 及其他病原菌异常扩增的关键因子之一,其中IL-17A、IL-17F 与IL-17R 结合后抑菌作用最为显著[27-28]。研究证明,IL-17A 和CXCR2 依赖的中性粒细胞在SFB 及其他致病菌急速扩张时向回肠募集,致使SFB 及致病菌数量明显降低,黏膜屏障完整性得以维持[26,29]。因此,SFB 与Th17 细胞的相互作用利于机体肠黏膜免疫防御建立,保障肠道健康,但SFB 异常扩增触发IL-17R 作用后导致SFB 数量下降,是针对SFB 自身的反向调节,还是抑制其他病原菌增殖而引发的SFB 数量协同降低,需进一步求证。
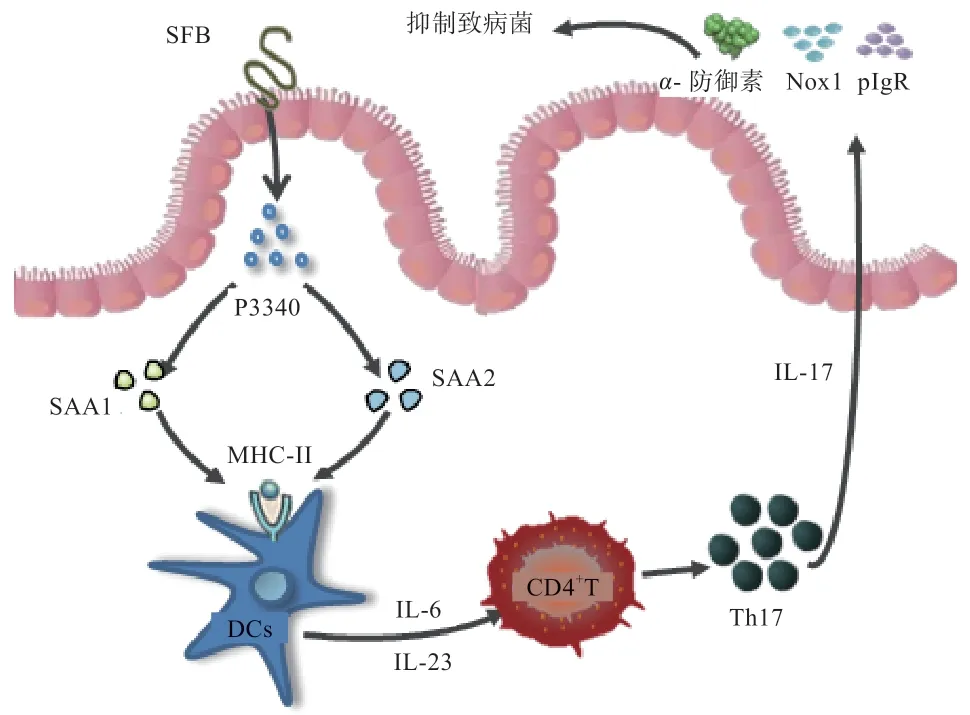
图1 SFB 与肠内Th17 细胞的互作
2.2 SFB 与IgA+B 细胞的互作 分泌型免疫球蛋白(Secretory Immunoglobulin A,sIgA)释放主要发生在派尔集合淋巴结(Peyer's Patches,PPs)。将单定植SFB 或大肠杆菌的小鼠进行对比,发现两类小鼠PPs 数量差别不大,但是SFB 定植小鼠出现明显较大的PPs 生发中心,产生高浓度诱导配体(Proliferation Inducing LIgAnd,APRLI)和B 细胞活化因子(B Cell Activating Factor,BAFF),B220+IgA+B 细胞水平在细菌定植20 d 后激增达到顶峰,刺激宿主淋巴滤泡和三级淋巴组织形成,粪便sIgA 浓度与活性均显著提高[30-31]。此外,除诱导IgA 产生外,SFB 还促使IECs 中pIgR 释放,利于IgA 通过上皮进入肠腔发挥作用[32]。
SFB 诱导产生IgA 存在负反馈调节,防止SFB 过度定植[15]。Macpherson 等[33]研究发现,肠道B 细胞缺乏IgA 类抗体转化开关——胞嘧啶核苷脱氨酶(Activationinduced Cytidine Deaminase,AID),且IgM合成不受影响时,小鼠肠道内SFB 异常迅速扩增,进行重组IgA 反应后B220+IgA+B 细胞数目回到正常水平,随后SFB 数量急剧下降,表明只有IgA 能够解开SFB与IECs 的附着,而IgM 并不可以。肠腔IgA 将SFB高度包被,抑制其直接接触肠壁,无法黏附IECs,失去定植能力,维持机体肠道屏障的完整性,抵御其他病原微生物入侵[32]。综上,SFB 诱导产生IgA 可协助肠道环境稳定,维护机体健康(图2),但其对SFB 的作用如何异于其他免疫球蛋白仍需进一步探究。
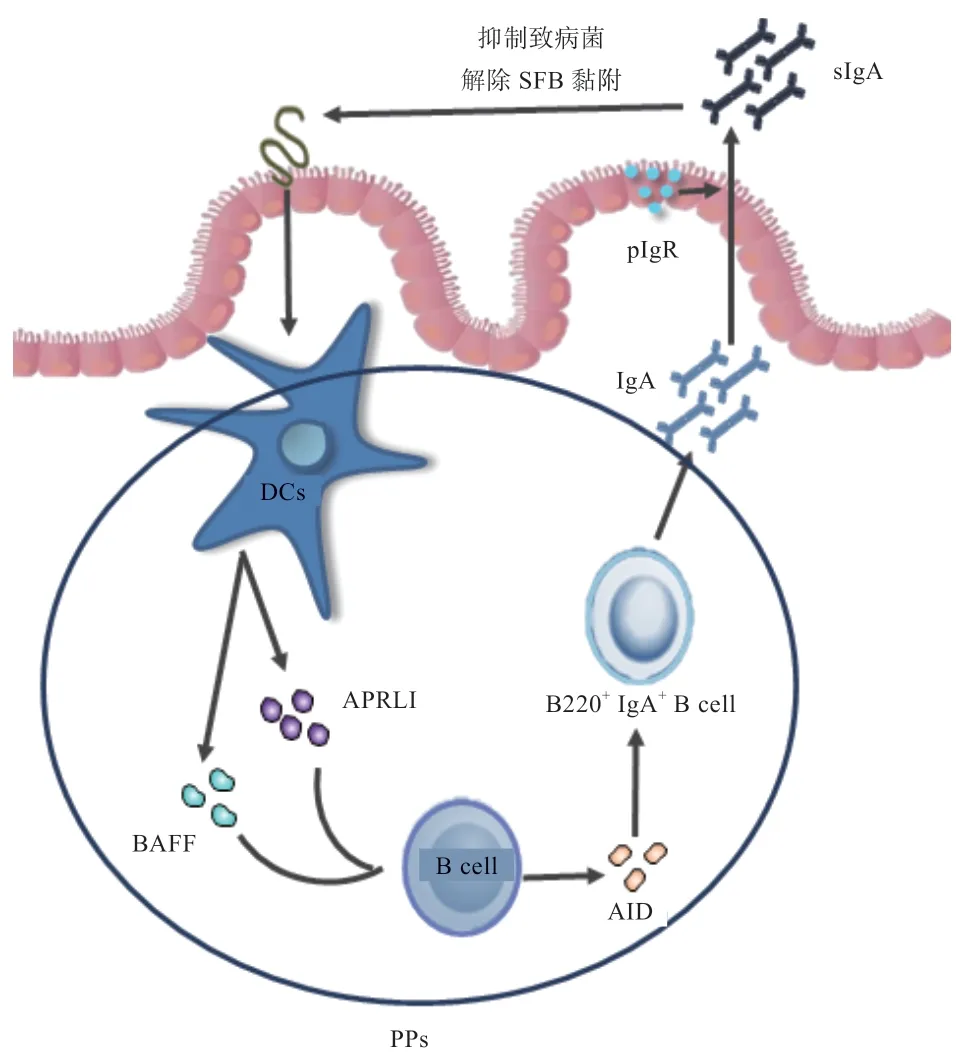
图2 SFB 与IgA+B 细胞的互作
2.3 SFB 与ILCs 的互作 ILCs 是参与宿主固有免疫反应的淋巴细胞,分为ILC2、ILC3 等,常见于黏膜屏障部位,局部微环境改变后,接收免疫应答信号分子(如IL-7、IL-23 等),促使细胞因子(如IL-22、INF-γ)及其他介质分泌,产生免疫监视和免疫调节作用,其中ILC3 被认为是肠道IL-22 的主要分泌者[32,34]。IL-22 能有效刺激岩藻糖基转移酶2 表达和上皮岩藻糖基化,诱导IECs 衍生抗微生物分子(如RegIIIγ、抗菌肽等),抵御病原菌入侵上皮系统,维持黏膜免疫稳态[35-37]。SFB 诱导IL-22 是通过其定植后产生IL-23 间接进行,IL-23R 在ILC3 上发出信号,释放IL-22,故IL-23R/IL-22 轴系出现缺陷导致SFB 异常增殖[38]。研究表明,将大鼠SFB 定植于缺乏SFB 的小鼠后,IL-22 恢复正常水平,揭示SFB 促进ILC3 释放IL-22。
ILC3 通过依赖STAT3 的IL-22 信号触发SAA 释放,增强Th17 细胞分化,对SFB 定植产生影响。研究显示,将SFB 定植于芳香烃受体缺陷小鼠,ILC3 基本生物学功能无法维持,导致IL-22 水平降低,SFB 数量异常增加,促使Th17 细胞增殖[42]。但Zhu[43]指出,ILC3 和IL-23R/IL-22 轴系抑制Th17 细胞反应,这与轴系限制共生细菌诱导特异性CD4+T 细胞反应的能力有关。因此,SFB 通过Th17、IECs 和IL-23R/IL-22 轴系等组成的动态网络对ILCs 产生作用,那么深入探究各细胞和因子间关系,可为进一步揭示SFB 影响ILCs 的分子机制提供理论依据。
3 SFB 在模式动物肠道免疫中的研究现状
SFB 定植后具有抵御鼠伤寒沙门氏菌和柠檬酸杆菌入侵宿主的能力[44-45]。Lai 等[46]对不同年龄的小鼠肠道进行监测发现,SFB 定植的肠段不再出现沙门氏菌,SFB 未定植的部位发现沙门氏菌,同时将SFB 移植至感染肠致病性大肠杆菌O103(enteropathogenic Escherichia coli 103,REPEC O103)的家兔模型发现,SFB 稳定存在后REPEC O103 无法引起相应病症。肠道SFB 不仅帮助动物抵抗病原菌侵袭,还增强动物防御肠道寄生虫的能力。Burgess 等[47]研究发现,痢疾变形虫感染SFB单定植小鼠模型后,其肠内中性粒细胞数量显著上升,使宿主免受侵害。Edelblum 等[45]研究发现,刚地弓形虫感染小鼠在SFB 定植后触发肠道通透性补偿增加,产生大量IL-17A 抑制病原体易位。SFB 异常扩增可介导产生剧烈的Th17 反应,诱使IL-17 过度产生触发炎性肠病[48]。Jia 等[49]试验显示,葡聚糖硫酸钠诱导结肠炎的小鼠体内IL-17A、SFB 含量激增,使用蛋壳膜粉治疗后,SFB 数量显著降低,菌群多样性恢复,抑制Th17 细胞过度表达,有效缓解结肠炎。此外,小鼠患重度联合免疫缺陷症移植CD4+T 细胞恢复后,将SFB+SPF 菌群混养定植肠内才能诱发小鼠结肠炎,并伴随SFB 数量增多;而SFB 单定植一段时间后数量下降,SPF 菌群定植却未出现病理变化,表明SFB 异常扩增导致结肠炎,且依赖肠内其他共生菌产生辅酶因子(乙酰辅酶A、核黄素等)维持自身需要[25]。综上所述,SFB 定植于模型动物肠道对提高肠道菌群丰富度、阻止病原体危害宿主、维持肠道免疫具有重要意义,但SFB的异常增殖也会导致机体发生肠道炎症,调控SFB 水平可为未来治疗肠道炎症提供新方向。
4 结 语
SFB 定植在模式动物试验中被证实与肠黏膜免疫具有积极的互作效应,主要与Th17 细胞、IgA+B 细胞及ILCs 发生作用。锚定于IECs 上的SFB,向Th17 细胞抗原呈递,促使IL-17 分泌,阻止病原菌入侵上皮,同时IL-17R 的调控作用使肠内SFB 水平保持稳定,维持良好的肠道环境。SFB 刺激IgA+B 细胞增殖,使肠内sIgA 维持较高水平,可特异解除过度增殖SFB 对IECs的黏附,反向控制SFB 定植,并靶向清除其他致病菌,进而预防疾病发生。此外,SFB 可间接促进ILC3 分泌IL-22,完善IL-23R/IL-22 轴系,加速肠黏膜免疫系统的建立。然而,肠道免疫为一复杂网络系统,在SFB与宿主交互作用下对免疫是否造成其他影响尚无定论,故利用更为全面的分析手段深入探讨SFB 对动物体作用的分子机制,更有助于确定其在维护肠道健康和疾病预防方面的有益作用,为指导动物健康养殖提供理论参考依据。现有的研究成果显示,SFB 独特的黏附方式是其与动物体发生积极互作效应的基础,但SFB 菌株具有多样性,不同动物间SFB 存在差异,且不同菌株定植能力有强弱之别,而目前多数研究仍集中进行于一类试验动物上,关于畜禽SFB 的研究鲜有报道,因此建立SFB 体外分离纯培养探究纯培SFB 在其他动物体是否发挥相同作用为今后的研究方向之一,同时也需要更多基础试验为后续发展提供理论依据。
