HSV 病毒示踪腰椎间盘突出症模型大鼠中枢敏化的实验研究*
2021-05-16梁永辉
徐 敏,周 壮,梁永辉
(1 海军军医大学附属长海医院创伤骨科,上海200433;2 苏州大学附属第二医院疼痛科)
腰椎间盘突出症(lumbar disc herniation,LDH)好发于30~50 岁人群,临床表现包括腰痛、坐骨神经痛和马尾神经痛等[1]。近年来大量研究表明,中枢脑区功能及结构的适应性改变与疼痛调控过程相关[2]。本实验以单纯疱疹病毒(HSV)作为顺行标记神经环路的工具病毒,定位绘制自体髓核移植大鼠痛觉神经传导通路图,并通过免疫荧光增强方法比较各核团标记细胞的差异,探索可能参与腰椎间盘突出症源性疼痛中枢敏化的相关核团。
1 材料与方法
1.1 主要材料 成年雄性Sprague-Dawley(SD)大鼠102 只,6~8 周,体重180~220 g,由苏州大学实验动物中心提供(苏SYXK2007-0035)。饲养于P2 实验室,2 只一笼,室温22 ℃,湿度50%~60%,通风良好,人工昼夜(12 h/12 h)。实验大鼠分组:行为学实验中LDH 组10 只,假手术组8 只;注射HSV 病毒实验中注射病毒后1~7 d 每天1 组,共7 组,LDH 组和假手术组各6 只。HSV-1 H129(107 pfu/mL)(武汉枢密),Triton×-100(Amresco 公司),荧光抗淬灭剂(碧云天),鼠抗GFP 多克隆抗体(Chemicon),驴抗鼠免疫荧光抗体(Chemicon),VFF(von Frey filaments,North Coast Medial Inc),热痛刺激仪,冰冻切片机(Leica),OCT 冷冻包埋剂(樱花公司),正置荧光显微镜(ZEISS)。
1.2 方法
1.2.1 腰椎间盘突出症模型建立:LDH 组大鼠用水合氯醛腹腔注射麻醉后,剃毛、消毒,铺设消毒巾。咬除L5、L6 左侧椎板及关节突,显露左侧L5 和L6 神经根及背根神经节。将大鼠尾腹侧近根部椎间盘髓核组织移植到L5 和L6 神经根表面。假手术组仅作暴露神经根及背根神经节处理,从自体尾椎椎间盘采集髓核但不进行髓核移植。造模结束后立即将10 μL HSV 病毒平均分为5 份,从5个不同注射点注射到左侧后掌足底。
1.2.2 压力-缩腿阈及缩足反射潜伏期的测定、疲劳转棒实验:压力-缩腿阈(paw withdrawal threshold,PWT)测定:用0.4~25 g 强度的von Frey 探针以升序测试刺激大鼠足垫中央位置,每次刺激≤4 s,每次间隔约10 s。大鼠被探针刺激后出现抬起后足或舔后足的行为为阳性反应,记录出现阳性反应所需刺激强度。缩足反射潜伏期(paw withdrawal latency,PWL)测定:按Hargreaves 法采用热痛刺激仪照射大鼠足底,大鼠出现抬腿回避时为阳性反应,记录出现阳性反应的时间。疲劳转棒实验(Rota rod 实验):在测试前给予大鼠3 d 适应,采用20 r/min 转速,记录大鼠从转棒跌落时间。
1.2.3 大鼠背根神经节(dorsal root ganglion,DRG)、脊髓及大脑冰冻切片制备:术后1~7 d 隔日进行取材,大鼠麻醉后,暴露心脏,迅速灌入300 mL 预冷生理盐水,待大鼠肝脏颜色发白、肠系膜血管血液消失后,采用多聚甲醛(pH 7.4)固定。依次钳断大鼠脊椎骨与颅骨,小心剥离DRG、脊髓及大脑,放入4%多聚甲醛溶液中固定过夜。将固定的组织置于15%、30%蔗糖溶液中梯度脱水。包埋剂包埋组织,冰冻切片机切片,厚度30 μm。将切片贴在载玻片上晾干,储存于-20 ℃冰箱中以备免疫荧光染色使用。
1.2.4 免疫荧光增强实验:取材后1 d,脑部及脊髓处连续切片,每隔5 张取1 张进行免疫荧光染色,选取DRG 横断面较完整的切片进行免疫荧光染色。切片置于PBS 中冲洗3 次,每次5 min。室温条件下用10%正常山羊血清(PBS 稀释)封闭2 h。一抗(鼠抗GFP 多克隆抗体)工作液孵育过夜,PBS 冲洗3 次,每次5 min。二抗(驴抗鼠免疫荧光抗体)工作液室温下避光孵育1 h,PBS 冲洗3 次,每次5 min。避光条件下贴片,荧光抗淬灭剂封片保存。
1.2.5 图像采集:使用正置荧光显微镜,参照大鼠脑立体定位图谱对大鼠脑区HSV 感染阳性细胞核团定位。每个核团取其中间位置切片,计数阳性细胞数,并计算每组平均值。
1.3 统计学处理 采用OriginPro 8 统计学软件(OriginLab,US)进行数据分析。计量资料以±s表示,组间比较行t 检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 自体尾椎髓核移植后大鼠同侧下肢痛觉阈值及运动功能变化 LDH 组大鼠自体髓核移植术后机械痛阈值及热痛阈值显著降低,术后第7 d 痛阈值最低,与假手术组相比,差异有统计学意义(P<0.05)(图1A、1B)。LDH 大鼠术前、术后在Rotarod 上的时间无显著改变,差异均无统计学意义(P>0.05)(图2),说明自体尾椎髓核移植对大鼠运动功能无明显影响。
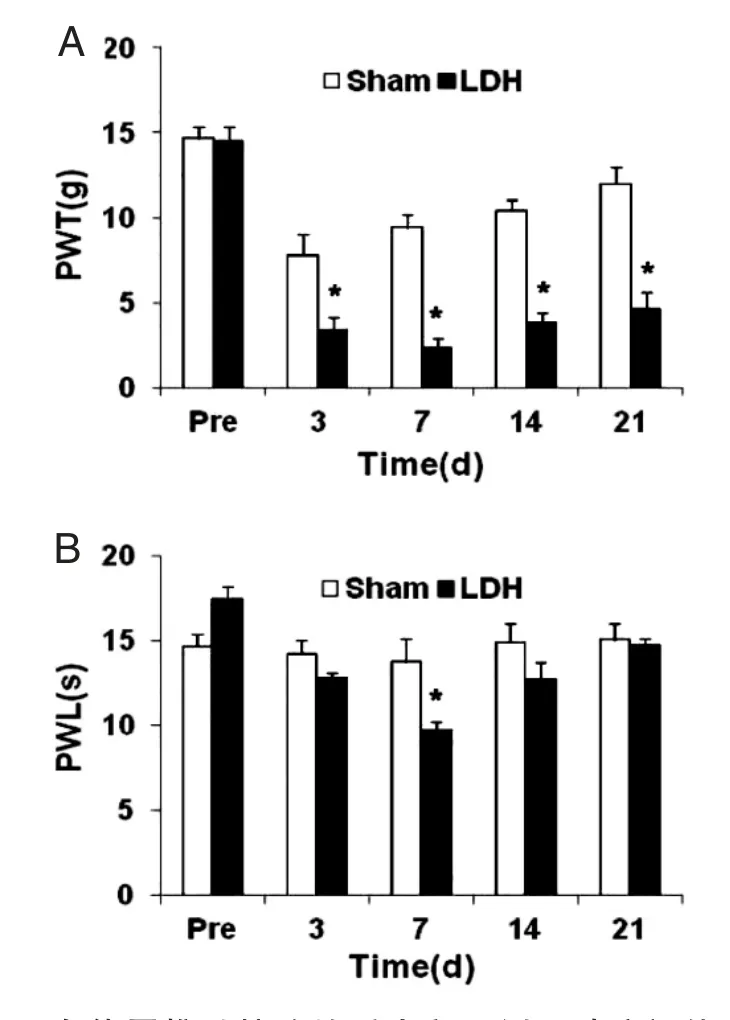
图1 自体尾椎髓核移植后大鼠同侧下肢痛阈值变化
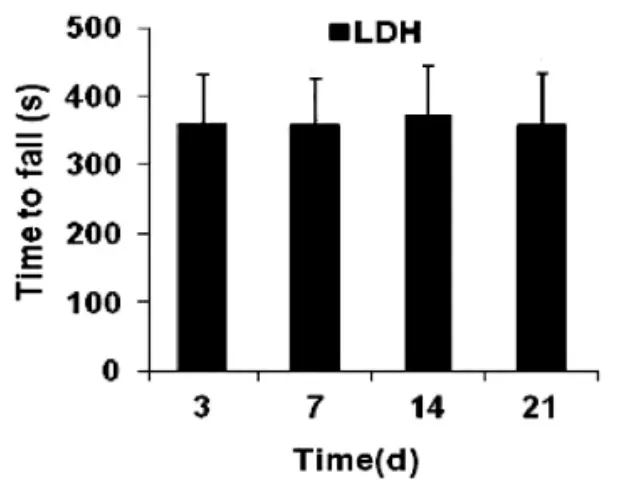
图2 Rotarod 实验测试自体尾椎髓核移植大鼠运动功能
2.2 HSV 病毒在LDH 组大鼠DRG 及脊髓的分布情况 少许L4~L5 DRG 神经元细胞被HSV 病毒(绿色)及DAPI(蓝色)共标,显示神经元细胞内感染了HSV 病毒(图3A-C,封二)。L4~L5 DRG 中HSV病毒标记的神经元细胞数量显著增多,部分神经纤维也被HSV 病毒标记(图3D,封二)。在注射病毒后3 d,L5~L6、L4~L5 同侧脊神经DRG 内均发现阳性细胞的标记,随着存活时间延长,阳性细胞数量显著增加,第7 d 阳性细胞数为最多。第3~4 d 脊髓开始出现阳性细胞标记,L5~L6、L4~L5 脊髓节段灰质区域同侧脊髓背角分布最为集中,与感染的DRG 相对应。颈段脊髓白质腹侧区也出现少许病毒标记的阳性神经元。见图4(封二)。
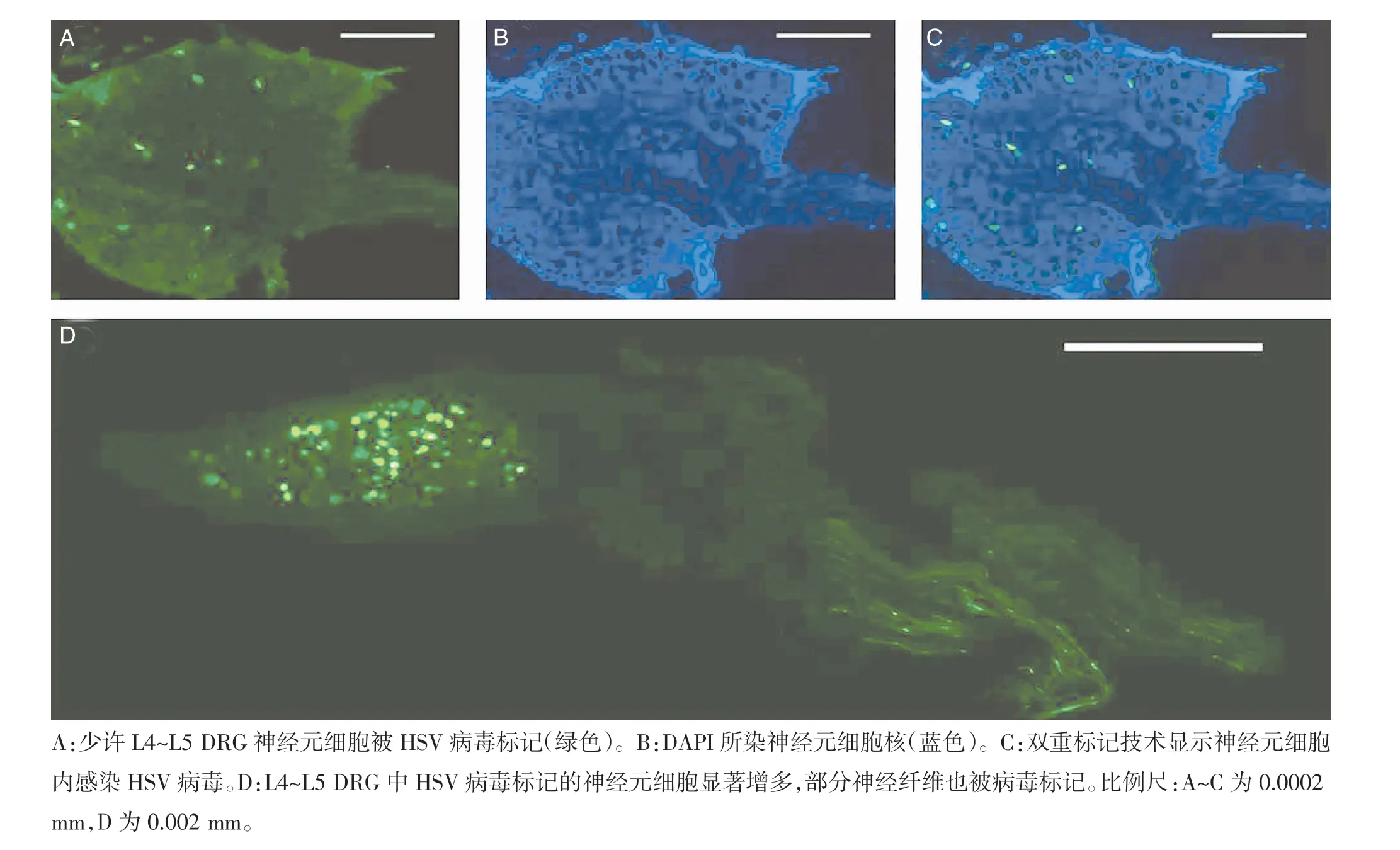
图3 HSV 病毒在DRG 中的分布图
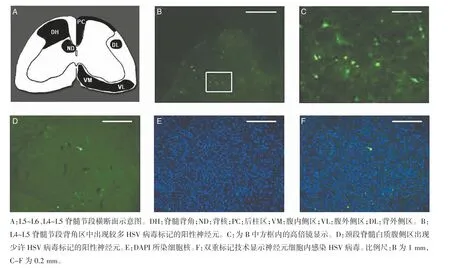
图4 HSV 病毒在脊髓中的分布
2.3 HSV 病毒在LDH 组大鼠延髓及脑桥的分布情况 大鼠注射HSV 病毒后第5 d 脑干延髓段矢状面显示,HSV 病毒标记的阳性细胞沿着尾端腹外侧核(CVL)、网状小细胞核(PCRt)到微孔背盖核(MiTg)呈轴状分布(图5A,封三)。同时双侧蓝斑区(LC)出现聚集的阳性细胞,LC 下侧的蓝斑下核背侧区(SubCD)、蓝斑下核腹侧区(SubCV)、面神经(7N)也出现较多阳性细胞(图5,封三)。HSV 注射4 d 后出现脑干阳性标记细胞,分布于双侧多个核团。延髓段以头端腹内侧区(RVM)最为集中,呈“个”字型分布,包括尾端腹外侧核(GiA)、网状小细胞核(Rmg)及旁巨细胞核(LPGi),背侧的背巨细胞核(DPGi)也有少许散在分布的阳性细胞(图6,封三)。其次是脑桥中蓝斑区域阳性细胞分布较为集中(图5D,封三)。大鼠注射HSV 病毒后第5 d 中缝核喙(Rli)横断面显示,HSV 病毒标记的阳性细胞聚集在Rli,其他区域未发现阳性细胞,提示紧接着RVM 后Rli 出现阳性神经元聚集(图7,封三)。

图5 HSV 病毒在延髓段的分布
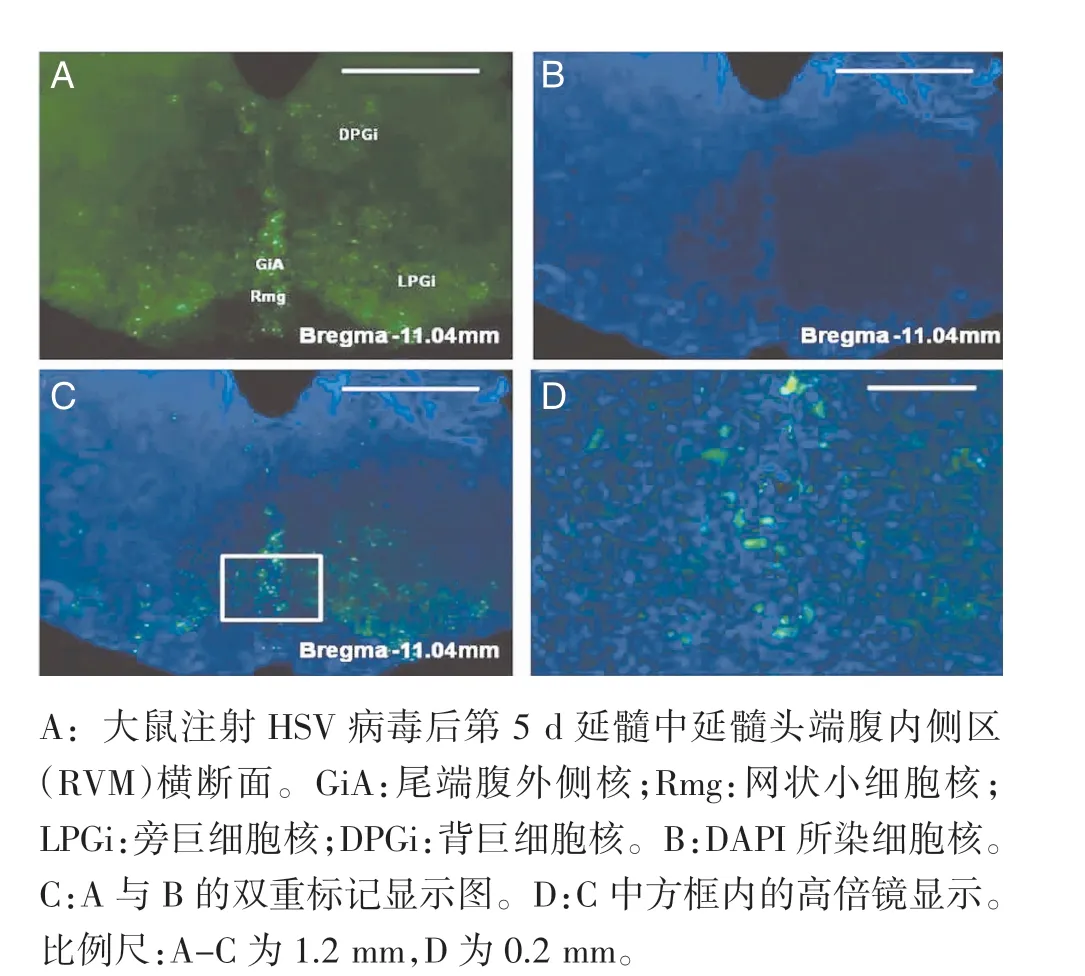
图6 HSV 病毒在延髓头端腹内侧区的分布
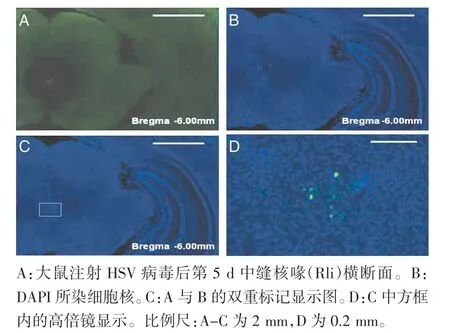
图7 HSV 病毒在中缝核喙的分布
2.4 HSV 病毒在LDH 组大鼠中脑区域的标记情况 中脑导水管周围灰质腹外侧区(vlPAG)出现标记的阳性细胞较LC 及Rli 延迟约1 d,这些双侧对称分布于导水管腹外侧的阳性神经元彼此间距较大,但有广泛的突触联系(图8,封三)。阳性细胞分布与导水管在纵轴上平行较长一段距离(Bregma-8.4 mm~Bregma -6.8 mm)。
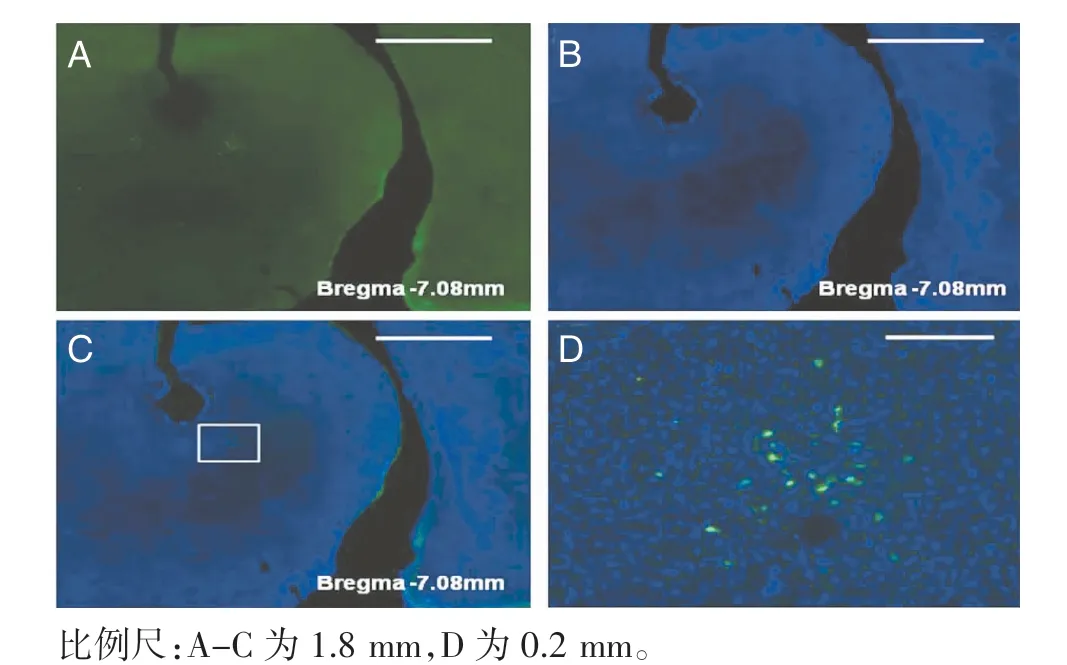
图8 HSV 病毒在中脑导水管腹外侧区的分布
2.5 HSV 病毒在LDH 组大鼠前脑区域中的标记情况 HSV 病毒注射后第6 d 前脑部分双侧室旁核(PVN)出现较多被标记的阳性细胞,细胞之间广泛联系,交织成网呈倒三角形分布(图9,封三)。病毒注射后第7 d 双侧初级感觉皮层后肢代表区(S1HL)出现较多被标记的阳性细胞,并呈放射状分布,神经元的胞体及树突的轮廓清晰可见(图10,封三)。
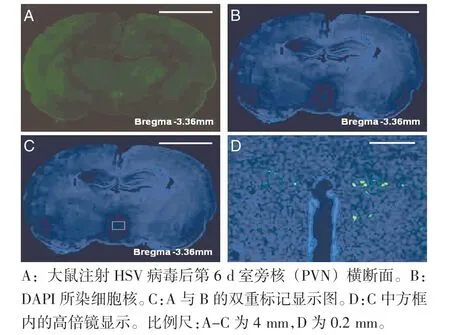
图9 HSV 病毒在室旁核的分布

图10 HSV 病毒在初级感觉皮层后肢代表区的分布
3 讨论
近年来腰椎间盘突出症的下腰痛和坐骨神经痛引起越来越多的关注,部分患者仅为轻微椎间盘退变,但仍存在慢性腰腿痛或疼痛复发,药物治疗效果不佳。功能磁共振成像技术(fMRI)证实,脑内存在多个疼痛相关区域[3]。HSV-1 H129 具有特异顺向跨多级突触的特性[4],本研究使用HSV 顺行跨多突触示踪技术和免疫荧光增强方法来确定LDH 大鼠中枢敏化路径及特异性核团。自体尾椎髓核移植大鼠作为LDH 疼痛模型,结果显示LDH 组大鼠机械痛阈值与热痛阈值下降,并都在术后第7 d 阈值最低。预实验结果显示,足底注射HSV 病毒1 周左右感染至整个脑区,因此在术后立即注射HSV 病毒。
HSV 注射3 d 后,DRG 中阳性神经元主要集中于同侧L4~L5 及L5~L6 节段。我们先前的研究已经证实DRG 参与LDH 源性疼痛的调控[5]。DRG 作为感觉传入的第一级神经元,汇集了躯体初级感觉神经元,在痛觉的感知、调控和传递过程中起着至关重要的作用。
脊髓内腰膨大处脊髓背角是标记细胞最早最集中的区域,HSV 注射后第4 d 该处神经元较为均一,但随着时间延长,标记细胞数量显著上升,其形态也出现明显差异,提示此区域可能存在不同类型的神经元。脊髓背角是感觉信息传入与整合的初级中枢。神经受损伤性刺激时, 初级传入神经元过度兴奋,进而引起脊髓背角神经元的兴奋,该层的突触联系发生功能性或器质性改变,从而产生中枢敏化[6]。
脑干内多个相关核团的标记出现在脊髓之后,LC 及A7 区神经元向脊髓的投射局限于脊髓后角和前角,而不朝IML,所以它们的标记可能主要来自脊髓后角。延髓段RVM 是脑干内标记最为显著的部位,相对于脑内其他区域,该处标记尤为集中。早期研究指出,RVM 介导的下行易化系统参与慢性痛的中枢敏化机制[7]。LC 是其次出现较多集中阳性神经元的区域,先前研究证实此区域存在肾上腺素能蓝斑-脊髓系统在下行疼痛调控中的突触机制[8]。RLi紧接RVM 之后出现阳性细胞集中,但数量较少。
中脑区vlPAG 标记出现在RVM 及LC 之后,这些神经元彼此间的突触交织分布成网,联系十分紧密,且标记阳性细胞在纵轴方向上分布较广泛。多位学者证实,vlPAG 参与神经病理性疼痛、偏头疼等多种痛觉感受的处理与调节[9],提示该区域是LDH 源性疼痛的重要调控中枢及传递枢纽。有研究证实存在Rli 与vlPAG 的解剖联系[10],本实验对此作了进一步验证。vlPAG-RVM 轴在中枢敏化中起着重要作用,周围神经损伤对初级传入纤维持续刺激,RVM神经元的表型发生变化,启动神经元(on-cell)活性增加,但停止神经元(off-cell)短暂性抑制[11]。另外,RVM 星形胶质细胞和小胶质细胞的活化和增殖,脑源性神经营养因子(BDNF)释放,p38 MAPK 磷酸化,胆囊收缩素(CCK)及N-甲基-D-天冬氨酸(NMDA)受体亚单位的表达上调,均对中枢敏化的发生发展起着重要作用[12]。
双侧室旁核(PVN)于注射病毒后第6 天出现大量阳性神经元,与vlPAG 一样彼此间突触交织分布成网,联系十分紧密。有研究表明,新生期母婴分离模型通过影响PVN 和前皮质扣带回中Fos 蛋白表达,造成幼鼠内脏的高敏状态[13]。另有实验证明,电极刺激大鼠PVN 可以影响大鼠痛觉阈值[14]。本研究LDH 组中对侧PVN 区域出现更多的阳性细胞,与同侧的差异有统计学意义(P<0.05),而假手术组中对侧PVN 阳性细胞数较同侧稍多,差异无统计学意义(P>0.05),说明PVN 区域特异性调控LDH 源性疼痛。由于患侧的慢性痛长期刺激导致高级中枢的痛觉信号汇集,致使次区域神经元免疫性下降,HSV更易集中。
HSV 注射后第7 天,双侧初级感觉皮层后肢代表区(S1HL)出现较多阳性神经元,呈扇形分散分布,单个神经元的轴突树突清晰可见。近年有研究证实,广泛的皮层区域参与痛觉的处理过程,并在痛觉生成和调节方面发挥重要作用[15]。基于体素的形态学分析(VBM)发现,慢性腰背痛患者在躯体感觉皮层和脑干中的灰质体积减少,而在左侧丘脑与双侧基底节中灰质体积增加[16]。S1HL 主要控制后肢感觉代表区域,此处出现较多阳性神经元进一步证实这条足底感觉至相关感觉皮层的通路。同样,LDH 组对侧S1HL 区域较同侧出现更多的阳性神经元,差异有统计学意义(P<0.05),而假手术组两侧的差异无统计学意义(P>0.05),进一步说明LDH 源性疼痛在此区域存在更高的特异性和相关性,S1HL 可能是调控腰椎间盘源性疼痛中枢敏化的终极中枢。
综上所述,本研究应用HSV 神经示踪技术可靠显示了腰椎间盘突出症中枢敏化的路径,即SCDRG-DH-(RVM—Rli)/LC-vlPAG-PVN-S1HL 路径,对侧PVN 与S1HL 在LDH 中枢敏化的发生发展中可能发挥特殊作用,为足底感觉传递提供了神经解剖学基础,从而为进一步研究高位中枢对腰椎间盘突出症中枢敏化的机制提供线索。
