硅藻土吸附固定化Bacillus sp.DL-2胞内蛋白酶拆分制备(S)-乙酸苏合香酯
2021-05-16王晓敏徐湘薇张继福胡云峰
王晓敏,董 璐*,徐湘薇,张继福,张 云,胡云峰*
(1.中国科学院南海海洋研究所∕中国科学院热带海洋生物资源与生态重点实验室∕广东省海洋药物重点实验室,广东广州 510301;2.中国科学院大学,北京 100049;3.广东省中医院,广东广州 510120;4.南方海洋科学与工程广东省实验室(广州),广东广州 511458)
【研究意义】手性香料是一类重要的化合物,不同对映体香料可显示出不同的香气特征、香气强度和生物活性[1-3]。在众多香料中,羧酸酯类是一类非常重要的香料。在食品香精中,酯类香料是用途最广、用量最大的一类香料产品,它们经合理配制可制成各种香型的香精,赋予白酒、无酒饮料、糕点、糖果以及其它食品所需香气;同时它还广泛用于配置各种香水、化妆品等日用品香精。(S)-乙酸苏合香酯香味与所含对映体比例有关,如对映体过量值(e.e.)为78.3%的(S)-乙酸苏合香酯带有鳄梨的青香味和草莓酱的香味;而e.e.为81.1%的(R)-乙酸苏合香酯带有杏香、苹果香和草莓酱香味[1,4]。【前人研究进展】通常,手性化合物的合成可以通过传统的化学方法合成,但是化学合成需要有毒有机溶剂及重金属的参与,对环境及人类具有严重的危害,同时还会破坏产品的品质,并且通过化学合成得到的手性化合物的光学纯度较低[5]。此外,手性化合物还可以通过生物催化剂的方法进行制备[6-10]。与传统的化学合成相比,酶法选择性拆分消旋体化合物,具有高立体专一性和区域选择性、副反应少、产率高、产物光学纯度好以及反应条件温和的优点,是一种被广泛认可的拆分方法[11-13]。微生物是许多有价值的酶、蛋白质、高附加值的多不饱和脂肪酸等的重要来源,而大部分的代谢产物存在于细胞内,酶法破碎细胞技术具备条件温和、设备简易和利于环保等优势。因此,国内外的专家学者在这一领域进行了一系列广泛而深入的研究[14]。刘红等[15]采用酶解和超声波相结合的方式进行了大肠杆菌的破碎实验研究,确定了此方法可获得纯度更高的包涵体。本实验室在前期工作中经过实验表明,利用溶菌酶破碎Bacillussp.DL-2以获取胞内蛋白酶拆分乙酸苏合香酯效果较好[16]。
【本研究切入点】游离酶由于在水溶液中不稳定、重复利用性差、不易回收和反应产物难以分离等缺点,限制了其在工业生产中的应用。而工业酶经过固定化后可以克服这些缺点,提高其稳定性和重复使用性,实现操作连续性使其经济高效[17-19]。工业酶的固定化方法主要有物理吸附法、离子结合法、共价结合法、交联法和包埋法[20]。吸附法是常用的酶固定化方法之一,以吸附法固定酶,酶的构象很少改变或基本不变,因此,酶的催化活力损失少;另外载体选择范围较广,价格低廉,固定化操作过程简单,因此吸附法在经济上是最具吸引力的固定化方法[21]。硅藻土由硅藻的细胞壁沉积而成,硅藻土表面的多孔性与负电性使其呈现明显表面吸附性,因而被常用做吸附载体。硅藻土表面还存在有大量的硅羟基及氢键,这些硅羟基及氢键同时存在于硅藻土众多的微孔之中,这些也是硅藻土具备吸附性能的重要原因[22]。【拟解决的关键问题】本工作利用溶菌酶破碎Bacillussp.DL-2获取胞内蛋白酶,采用硅藻土固定化胞内蛋白酶以拆分乙酸苏合香酯,通过优化吸附固定化条件以及拆分条件,制备了高光学纯的(S)-乙酸苏合香酯,为工业化生产(S)-乙酸苏合香酯提供了参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株 从西太平洋深海沉积物中筛选并鉴定出一株芽孢杆菌Bacillussp.DL-2。
1.1.2 主要仪器 MLS-3781L-PC型高压蒸汽灭菌锅购于日本SANYO公司,OJS-2012R型恒温摇床购于上海世平实验设备有限公司,Allegra X-30R型冷冻离心机购于美国贝克曼库尔特有限公司,FULI GC-9700II型气相色谱仪购于浙江福立分析仪器股份有限公司,ACB-4A1型垂直流超净工作台购于新加坡艺思高(ESCO)科技有限公司,MDF-U73V型-80 ℃低温冰箱购于日本SANYO公司,KB-5010型振荡器购于海门市其林贝尔仪器制造有限公司,SPL-250型生化培养箱购于天津市莱玻特瑞仪器设备有限公司。
1.1.3 主要试剂 高蛋白脱脂高钙奶粉(内蒙古伊利实业集团股份有限公司),乙酸苏合香酯(上海阿达玛斯试剂有限公司),酵母提取粉和胰蛋白胨(广州环凯微生物科技有限公司),溶菌酶(生工生物工程上海股份有限公司),硅藻土(天津大茂化学试剂公司),其他试剂皆为分析纯。
1.1.4 培养基(1)脱脂奶粉固体培养基:1%脱脂奶粉水溶液加1%琼脂后高压灭菌待冷却到50 ℃左右倒平板。(2)种子培养基(Luria-Bertani培养基):1%胰蛋白胨,0.5%酵母粉,1%NaCl。(3)基础发酵培养基:1%脱脂奶粉水溶液。
1.2 试验方法
1.2.1 胞内蛋白酶的制备 将保存于-80 ℃的Bacillussp.DL-2用脱脂奶粉固体培养基活化后,接种于种子培养基中培养24 h,再按1%的接种量接种于基础发酵培养基培养24 h(培养基变澄清),然后离心去掉上清液,磷酸(PB)缓冲液清洗2次细胞,取湿重细胞0.5 g,加入1 mg∕mL的溶菌酶溶液20 mL,35 ℃震荡破碎30 min,离心后去掉细胞残渣,其上清液即为该菌的胞内蛋白酶溶液。
1.2.2 硅藻土固定化Bacillussp.DL-2胞内蛋白酶的条件优化 温度的优化。每1 L胞内蛋白酶溶液加入50 g的硅藻土,分别在20,25,30,35,40,45,50,55 ℃下震荡固定化8 h,震荡器转速为200 r∕min,检测温度对固定化效果的影响。
pH的优化。将胞内蛋白酶液的pH分别调成5,5.5,6,6.5,7,7.5,8,8.5,9,每1 L胞内蛋白酶溶液加入50 g的硅藻土,在最优温度40 ℃下震荡固定化8 h,震荡器转速为200 r∕min,检测不同pH对固定化效果的影响。
时间的优化。在1 L胞内蛋白酶溶液中加入50 g的硅藻土,调节pH至7,40 ℃,200 r∕min震荡条件下分别固定化2,4,6,8,10,12,14 h,检测不同固定化时间对固定化效果的影响。
载体量的优化。每1 L pH为7的胞内蛋白酶溶液分别加入10,20,40,50,60,80,100 g硅藻土,40 ℃,200 r∕min震荡条件下固定化10 h,检测不同载体量对固定化效果的影响。
1.2.3 硅藻土固定化Bacillussp.DL-2胞内蛋白酶的制备 将胞内蛋白酶液pH调至7,每1 L蛋白酶液加入100 g硅藻土,40 ℃、200 r∕min振荡器中固定化10 h,抽滤后于30 ℃烘干箱中烘干,即得硅藻土固定化的胞内蛋白酶。
1.2.4 固定化的胞内蛋白酶制备(S)-乙酸苏合香酯 固定化酶浓度的影响。pH为7的PB缓冲液中分别加入120,160,200,240,280,320 mg∕mL固定化酶,5 mmol∕L的底物(±)-乙酸苏合香酯,于35 ℃震荡反应8 h,用气相检测拆分效果。
拆分时间的影响。pH为7的PB缓冲液中加入160 mg∕mL固定化酶,5 mmol∕L的底物(±)-乙酸苏合香酯,于35 ℃分别震荡反应2,3,4,5,6,7,8,9,10,11,12 h,用气相检测拆分效果。
拆分温度的影响。pH为7的PB缓冲液中加入160 mg∕mL的固定化酶,5 mmol∕L的底物(±)-乙酸苏合香酯,分别于20,25,30,35,40,45,50 ℃条件下震荡反应7 h,用气相检测拆分效果。
拆分pH的影响。配制不同pH(5-9)的缓冲液,加入160 mg∕mL的固定化酶,5 mmol∕L的底物(±)-乙酸苏合香酯,于30 ℃下震荡反应7 h,气相检测拆分效果。
金属离子的影响。用pH为7的PB缓冲液配制2 mmol∕L的金属离子溶液(Li+,Na+,K+,Ba2+,Ca2+,Co2+,Cu2+,Mg2+,Ni2+,Al3+,Fe2+,Mn2+),分别加入160 mg∕mL的固定化酶,5 mmol∕L的底物(±)-乙酸苏合香酯,于30 ℃下震荡反应7 h,气相检测拆分效果。
1.2.5 固定化酶储存稳定性 按照最佳固定化条件制备一批固定化酶保存于4 ℃冰箱内,在最优拆分条件下每周测试1次固定化酶拆分效果,连续检测一个月。
1.2.6 气相检测方法及分析方法 拆分反应完毕立即加入与拆分体系等量的乙酸乙酯,2 000 r∕min,震荡萃取2 min,离心后取上层有机相进气相检测。气相检测条件为:注射器温度210 ℃,检测器温度210 ℃,载气为N2,流速1.2 mL∕min,采用梯度升温进行分析:80 ℃保持1 min,10 ℃∕min升温到120 ℃,120 ℃保持1 min,15 ℃∕min升温到210 ℃,保持1 min。
(S)-乙酸苏合香酯的对映体过量值(e.e.)及转化率(C)按如下公式计算[23],各因素下重复3次实验,取平均值确定实验结果。

e.e.代表(S)-乙酸苏合香酯的对映体过量值,Sac和Rac分别表示反应后(S)-乙酸苏合香酯和(R)-乙酸苏合香酯的峰面积;C为转化率,R0、S0分别代表反应前对应构型的乙酸苏合香酯的浓度,R、S分别代表反应后对应构型的乙酸苏合香酯的浓度。
2 结果与分析
2.1 固定化Bacillus sp.DL-2胞内蛋白酶条件确定
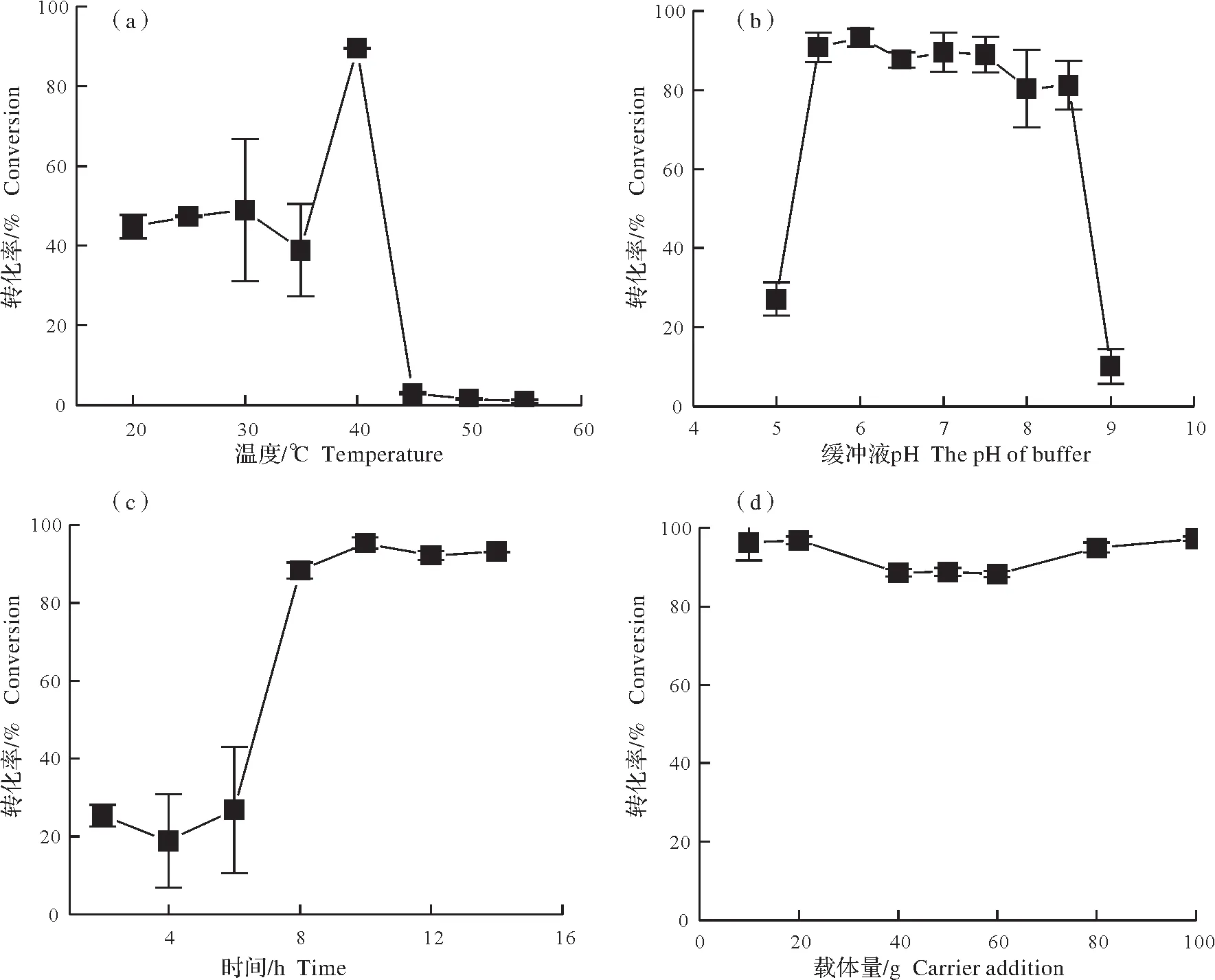
图1 固定化Bacillus sp.DL-2胞内蛋白酶条件优化Fig.1 The optimization of the conditions of immobilizing intracellular proteases of Bacillus sp.DL-2
2.1.1 温度的影响 在固定化阶段,以拆分转化率为检测指标。拆分转化率越高,说明固定化酶量越多;反之,则固定化酶越少。由图1(a)可知,固定化温度为20~35 ℃时,转化率在50%左右,当固定化温度升至40 ℃时,转化率达到最大值89.5%,说明此条件下固定化酶效果最好;随着温度的继续升高,转化率急剧下降至10%以下,温度过高会破坏胞内蛋白酶的空间结构,影响酶的催化活性。因此,选择40 ℃为最佳固定化温度。
2.1.2 pH的影响 由图1(b)可知,当pH为5和9时,固定化效果不佳,拆分乙酸苏合香酯的转化率都在30%以下,当pH升至5.5~8.5时,转化率在90%左右,均达到了一个较高的转化率水平,考虑破碎细胞时所用缓冲液pH即为7,为减少工业化操作复杂性,选择pH为7为最佳固定化pH。
2.1.3 时间的影响 由图1(c)可知,固定化时间小于6 h时,拆分转化率处于一个较低的水平,均低于30%,此时硅藻土孵育时间较短,硅藻土只吸附了少量的蛋白酶,当超过6 h后,固定化效果有了一个明显的提升,转化率均高于90%,并在10 h时达到最高值95.3%,此时吸附胞内酶量最大,但超过10 h后,吸附效果没有明显提升,从节省工业化制备固定化酶时间考虑,选择固定化10 h为最佳固定化时间。
2.1.4 载体量的影响 由图1(d)可知,载体量对固定化的效果影响不大,转化率基本都维持在90%左右,当载体添加量为100 g∕L时,转化率达到最佳值97.2%,同时考虑载体量添加量越大,固定化酶产量也越多,但高于100 g∕L时可能会造成胞内酶液与硅藻土接触面积减少,影响硅藻土吸附胞内蛋白酶效果,且载体量的增加也会要求更高频的震荡以使酶液与固定化载体接触充分,对工业生产而言需要加大投资得不偿失,因此选择100 g∕L为最佳载体添加量。
2.2 固定化酶制备(S)-乙酸苏合香酯

图2 固定化酶拆分制备(S)-乙酸苏合香酯的条件优化Fig.2 The optimization of the conditions of preparing(S)-phenylethyl acetate using immobilized enzyme
2.2.1 固定化酶量对拆分的影响 检测固定化酶拆分效果时,要综合考虑转化率及e.e.值。由图2(a)可知,当固定化酶添加量为120 mg∕mL时,转化率和(S)-乙酸苏合香酯的e.e.值均较低,添加酶量过少,不足以将(±)-乙酸苏合香酯拆分完全,转化率随固定化酶添加量的增加逐渐升高,在200 mg∕mL后基本保持不变,说明添加固定化酶量已基本饱和;(S)-乙酸苏合香酯e.e.值在160 mg∕mL时达到最大值89.1%,固定化酶量大于160 mg∕mL后,e.e.值呈波动下降趋势,因此,综合考虑,选择最佳固定化酶添加量为160 mg∕mL。
2.2.2 时间对拆分的影响 由图2(b)可知,随着时间的增加,拆分转化率及(S)-乙酸苏合香酯e.e.值逐渐升高并在7 h时均达到最高值,拆分时间超过7 h后转化率及(S)-乙酸苏合香酯e.e.值呈现波动下降趋势,长时间的反应并不能优化固定化酶的使用效果,综合考虑e.e.值及转化率,选择7 h为最佳拆分时间。
2.2.3 温度对拆分的影响 由图2(c)可知,温度在20~30 ℃时固定化酶拆分转化率随温度的升高逐渐增大,(S)-乙酸苏合香酯e.e.值基本保持不变,均在91%左右,且转化率在30 ℃时达到最佳值,超过30 ℃后,随温度上升,拆分转化率及(S)-乙酸苏合香酯e.e.值均逐渐降低,温度过低会影响固定化酶的活性作用的发挥,温度过高可能会使吸附于硅藻土上的固定化酶脱落,使固定化酶转变为游离酶,使胞内蛋白酶更易受高温的破坏,综合考虑e.e.值及转化率,选择30 ℃为最佳拆分温度。
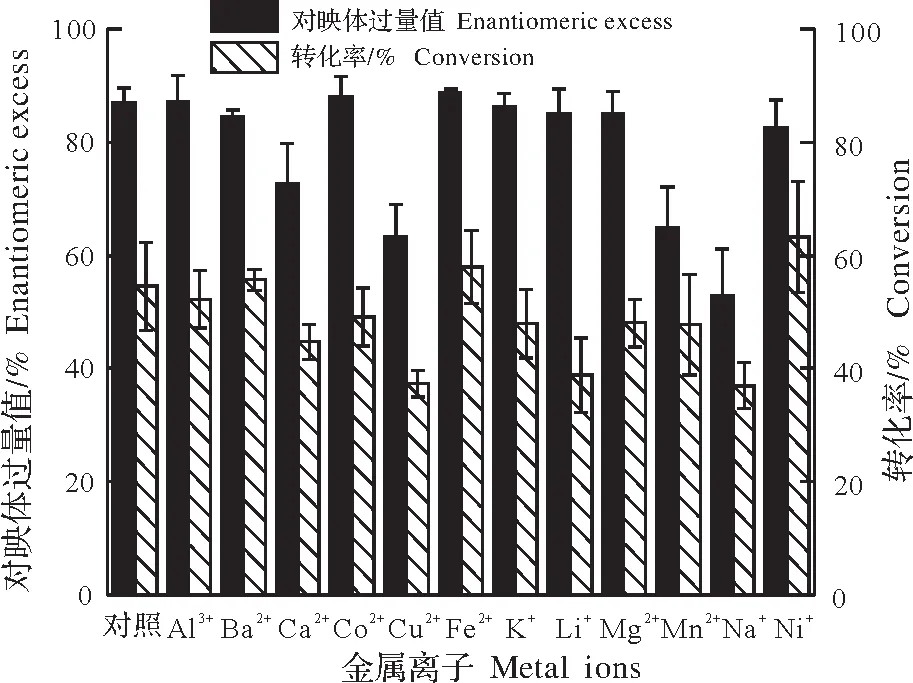
图3 金属离子对固定化酶拆分制备(S)-乙酸苏合香酯的影响Fig.3 The effect of metal ions on preparing(S)-phenylethyl acetate using immobilized enzyme
2.2.4 pH对拆分的影响 由图2(d)可知,拆分效果随pH的增加呈逐渐上升的趋势,并在pH为7时e.e.值达到最大值,超过7后,随pH增加拆分效果呈现波动下降的趋势,但下降趋势不明显,e.e.值保持在90%左右,转化率在60%左右,固定化酶在中性及碱性条件下仍能很好的发挥其拆分作用,用硅藻土固定化胞内蛋白酶增加了固定化酶对碱性环境的耐受程度,因此,选择pH为7为最佳拆分pH。
2.2.5 金属离子对拆分的影响 由图3可知,对照组e.e.值为87.0%,与对照组相比,Cu2+、Na+会稍微降低固定化酶拆分效果,分别使e.e.值降为63.3%及53.0%,其余金属离子对固定化酶的拆分效果影响不大,e.e.值均维持在80%左右,所检测的12种金属离子转化率均高于40%。硅藻土固定化酶降低了胞内蛋白酶对金属离子的敏感程度,对反应环境要求较低,在工业生产中具备一定的参考意义。
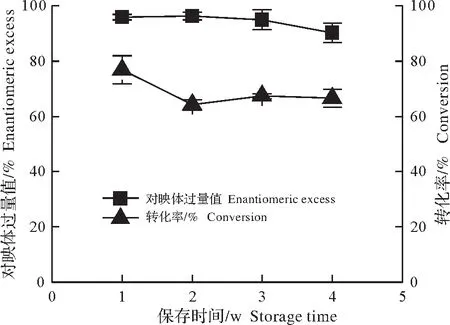
图4 固定化酶储存稳定性Fig.4 Storage stability of immobilized enzyme
2.3 固定化酶储存稳定性
由图4可知,4 ℃保存1周的固定化酶拆分转化率和(S)-乙酸苏合香酯的e.e.值最高,随保存周数的增加,e.e.值及转化率均逐渐降低,但在4周后e.e.值仍能达到90.1%,转化率保持在66.6%左右,后续实验进展中仍有进一步提升其储存稳定性的必要。
3 讨论
(S)-乙酸苏合香酯是重要的手性药物中间体和手性化工产品。传统的化学合成方法需要添加有机溶剂及重金属,对环境危害大,且制备的手性化合物光学纯度不高[5]。近年来,酶法选择性拆分制备手性化合物因其更加经济、高效、环保而备受关注[24-26]。公颜慧等[27]通过对pH、温度、有机溶剂等反应条件的优化提高酯酶手性拆分乙酸苏合香酯的光学纯度。曹莹莹等[28]利用来源南海深海的微生物酯酶EST12-7不对称水解反应拆分制备了高光学纯的(R)-2-氯丙酸乙酯。
本实验室在前期工作中筛选并鉴定出一株芽孢杆菌Bacillussp.DL-2,经实验表明,其胞外蛋白酶及全细胞均可手性拆分(±)-乙酸苏合香酯[29-31],进一步破碎细胞后,发现其胞内蛋白酶同样可以拆分(±)-乙酸苏合香酯,通过优化破碎细胞方法,确定了使用1 mg∕mL的溶菌酶在pH为7,35 ℃的条件下破碎30 min所得到胞内蛋白酶具备良好的拆分(±)-乙酸苏合香酯效果[16]。
但游离的胞内蛋白酶对环境高度敏感、不稳定且可变性大,而且酶催化剂的价格通常很高,难以在反应体系中分离回收,这些问题导致生产成本增加,成为酶工业化的技术瓶颈,并限制了游离酶的广泛应用。为了解决这个问题,酶的固定化技术被提出。酶在固定化后仍然具有较高的酶活力和回收率,而且固定化后酶的稳定性和耐受性等重要工业性能都有相应的提高[32-33]。因此,相对游离酶,固定化酶更具有经济价值,其应用更加广泛[34-37]。
吸附法是一种常见的固定化方法,属于物理法固定化酶的一种,其优点在于酶不参加化学反应,整体结构保持不变,酶的催化活性得到很好保留,采用吸附法固定酶,其操作简便、条件温和,不会引起酶变性或失活,且载体廉价易得,十分适合工业化生产。硅藻土作为一种价格低廉的吸附载体而备受关注[22],硅藻土是一种硅质岩石,它主要由古代硅藻的遗骸所组成,其化学成分以SiO2为主,显微镜下可观察到天然硅藻土的特殊多孔性构造,这种微孔结构是硅藻土具有特征理化性质的原因。固定化酶受固定化条件的影响较大,固定化温度、时间、pH均能影响酶和硅藻土之间的相互作用,因此,确定最佳固定化条件极为重要。固定化的Bacillussp.DL-2胞内蛋白酶可不对称拆分制备(S)-乙酸苏合香酯,为获得最佳转化率及e.e.值,本实验优化确定了制备(S)-乙酸苏合香酯的最佳拆分条件,为工业化制备(S)-乙酸苏合香酯提供了参考。
4 结论
本实验在前期工作的基础上进一步将Bacillussp.DL-2胞内蛋白酶固定化,利用硅藻土为吸附载体对Bacillussp.DL-2胞内蛋白酶进行固定化,因吸附法主要依靠蛋白质和载体之间的结合力联结,温度、pH、固定化时间等因素均可影响吸附效果,本工作经单因素实验优化确定了最佳固定化条件为:温度40 ℃,pH为7,固定化时间10 h,载体添加量100 g∕L。在最佳固定化条件下制备了固定化酶,优化确定了制备(S)-乙酸苏合香酯的最佳拆分条件为:固定化酶用量为160 mg∕mL,拆分时间7 h,拆分温度30 ℃,缓冲液pH为7。在最佳固定化及拆分条件下,制备的(S)-乙酸苏合香酯e.e.值可达到96.8%,转化率为73.9%(图5),优化后气相色谱图与标准品的气相色谱图如图6所示。固定化酶在4 ℃条件下储存4周后仍具备较高的酶拆分活性,且对低浓度的金属离子敏感度性较低,后续将继续筛选更优良的固定化载体,以期为工业化制备高光学纯度的(S)-乙酸苏合香酯做参考。
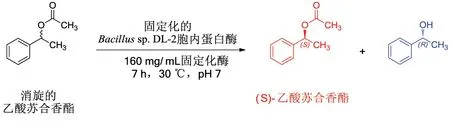
图5 使用硅藻土固定化的Bacillus sp.DL-2胞内蛋白酶拆分制备(S)-乙酸苏合香酯Fig.5 Preparation of(S)-phenylethyl acetate by immobilized intracellaluar proteases using diatomite of Bacillus sp.DL-2
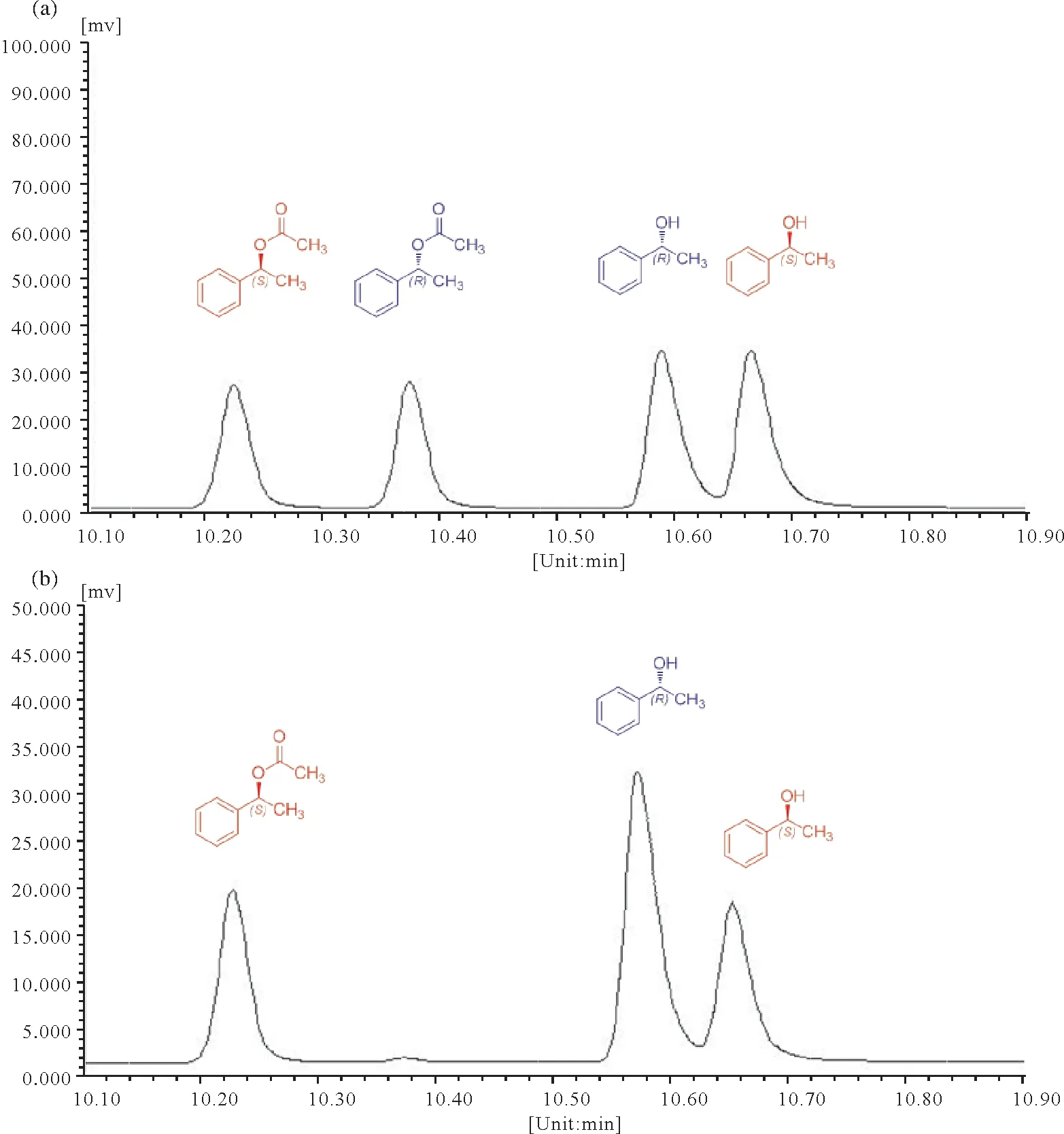
图6 硅藻土固定化的胞内蛋白酶制备(S)-乙酸苏合香酯的气相图谱Fig.6 The gas chromatogram of(S)-phenylethyl acetate prepared by immobilized enzyme
