乌梅总黄酮对MPP+诱导SH-SY5Y 细胞损伤的保护作用及机制
2021-05-15王春玲文晓东蒋媛静
王春玲,文晓东,罗 宁,蒋媛静,江 颖,曾 振
(1.广西中医药大学,广西 南宁530200;2.广西中医药大学附属瑞康医院,广西 南宁530011)
帕金森病(parkinson’s disease,PD)是目前仅次于阿尔茨海默病(alzheimer’s disease,AD)的全球第二大神经退行性疾病,严重影响广大中老年人身心健康。PD 的发病机制复杂,其中线粒体功能障碍是PD 重要的病理机制,大量研究表明,线粒体介导的细胞凋亡过程与PD 中黑质致密部多巴胺能神经元细胞的缺失密切相关[1]。因此,靶向线粒体,纠正线粒体功能障碍,抑制神经元细胞凋亡,促进神经细胞的修复和存活可能是预防和治疗PD 的有效策略,同时也是当前研究和开发防治PD 药物的热点之一[2]。
乌梅总黄酮(fructus mume total flavone,FMF)是传统中药乌梅的主要功效成分,具有抗炎、抗氧化、清除氧自由基、抗衰老、抗癌及调节凋亡等药理作用[3]。本项目组前期研究结果显示,FMF 可能通过修复线粒体呼吸链酶复合物Ⅰ~Ⅳ的活性水平,提高ND1、ND4 mRNA 及其蛋白的表达,改善线粒体功能,有效地抑制黑质多巴胺能神经元凋亡[4]。本研究排除体内因素干扰,进一步研究FMF 对PD模型细胞凋亡的影响,拟通过MPP+诱导SH-SY5Y细胞建立PD 细胞模型,探讨FMF 对MPP+诱导的SH-SY5Y 细胞损伤是否具有保护作用以及可能的机制,为FMF 防治PD 提供科学依据。
1 材料与方法
1.1 细胞与试剂
人神经母细胞瘤(SH-SY5Y)细胞购自中国科学院上海细胞库。经广西中医药大学科学实验中心细胞室传代培养、冻存。FMF 对照品,纯度>99%,购自中国药品生物制品鉴定所,批号:110820-200216;DMEM 培养基,购自美国Genmed 公司;二甲基亚砜(DMSO),购自美国Sigma 公司;DAPI 染色试剂盒购自武汉博士德生物工程有限公司,An‐nexin-APC/PI 双染细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒均购自南京凯基生物科技发展有限公司。BCA 蛋白定量试剂盒(BCA Protein As‐say Kit)购自美国CST 公司。兔抗Bcl-2 一抗、兔抗Bax 一抗、兔抗Caspase-3 一抗均购自美国Santa Cruz 公司。羊抗兔二抗购自美国Abcam 公司。
1.2 仪器与设备
CO2恒温培养箱(日本三洋公司)、超净工作台(苏州净化设备有限公司)、倒置相差显微镜(CKX31 型,Olympus,日 本)、倒 置 荧 光 显 微 镜(IX73 型,Olympus,日 本)、台 式 高 速 离 心 机(TG20M 型,上海安亭科学仪器厂)、流式细胞仪(Beckman,美国)、全自动荧光酶标仪(Thermofish‐er,美国)。
1.3 SH-SY5Y 细胞的复苏与培养[5]
配置含10%胎牛血清的DMEM 培养液,置于37 ℃的水浴锅中预热10 min。从液氮罐中取出SHSY5Y 细胞冻存管,迅速置于37 ℃水浴锅中至完全融解。在超净工作台中将冻存管内的液体移至离心管中,混匀,1 000 r/min 离心5 min,弃上清液,后加入1 mL DMEM 完全培养液重悬。将细胞悬液接种于无菌培养瓶内,放置于37 ℃、5% CO2细胞培养箱中培养。
1.4 SH-SY5Y 细胞模型的建立和分组给药
采用MPP+诱导SH-SY5Y 细胞发生凋亡,设置不同浓度MPP+分别作用24、48、72 h,CCK-8 法检测MPP+对细胞的毒性,确定MPP+浓度及作用时间,最终确定250 μmol/L MPP+作用72 h 为建模浓度和时间。细胞实验分为正常对照组(NC 组,DMSO)、模 型 组(250 μmol/L MPP+)、FMF 低(250 μmol/L MPP++ 10 μmol/L FMF)、中(250 μm ol/L M P P++ 50 μm ol/L F M F)和 高(250 μm ol/L MPP++100 μmol/L FMF)剂量组。
1.5 DAPI 染色法观察不同浓度的FMF 对MPP+诱导的SH-SY5Y 细胞凋亡的影响
DAPI(化学名4,6-联脒-2-苯基吲哚二盐酸盐),是一种荧光染料,通过与凋亡细胞核结合而发出蓝色荧光,用于鉴别凋亡细胞[6]。
取对数生长期的SH-SY5Y 细胞按7×104/mL的密度接种于24 孔培养板,以不同处理方式作用,PBS 洗3 次,4%多聚甲醛固定10 min,PBS 洗后加入DAPI 染液(浓度为10 μg/mL)37 ℃避光孵育15~20 min,弃染色液,PBS 冲洗后,荧光显微镜下观察细胞形态、拍照。
1.6 Annexin-FITC/PI 双染法检测不同浓度的FMF 对MPP+诱导的SH-SY5Y 细胞凋亡的影响
参照文献[7],按照Annexin-FITC/PI 凋亡检测试剂盒说明书,0.25% 胰蛋白酶消化细胞,1 000 r/m in 离心5 min,弃上清液,后用预冷的PBS洗2 次,加结合缓冲液300 μL 反复吹打使细胞混合均匀,调整细胞浓度为1×106个/mL,后加入5 μL Annexin-VFITC 和10 μL PI,混匀,2~8 ℃静置20 min,流式细胞仪检测不同处理组细胞凋亡率。
1.7 线粒体膜电位测定[8]
0.25%胰酶消化后收集所有细胞,再将细胞吹打均匀,制成单细胞悬液,PBS 调整细胞浓度至1×106个/mL,加入KBHB 缓冲液配制的罗丹明123 溶液,流式细胞仪检测细胞线粒体膜电位平均荧光强度值。
1.8 蛋白质印迹法(Western Blot)检测Bcl-2、Bax、Caspase-3 蛋白的表达
参照文献[9],按照BCA 试剂盒说明书测定蛋白浓度。每组取100 μg 蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后,将蛋白转移到聚偏二氟乙烯膜(PVDF 膜)后,将PVDF 膜浸于含5%脱脂奶粉的等渗缓冲盐溶液(TBST)中封闭1 h。分别加入Bcl-2(1∶400)或Bax(1∶500)或Caspase-3 抗体(1∶600),4 ℃孵育过夜后室温摇床孵育2 h;一抗孵育结束后用TBS-T 漂洗蛋白印迹膜3 次,每次5 min,加入辣根过氧化酶标记羊抗兔二抗(1∶2 000),室温孵育2 h,后以TBST漂洗3 次,每次5 min。最后以增强化学发光法(ECL)显影,β-actin 作为内参,用Image J 软件分析条带灰度值。
1.9 统计学处理
采用SPSS 22.0 软件进行统计分析,数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),P<0.05 为差异有统计学意义。
2 结果
2.1 FMF 对MPP+诱导SH-SY5Y 细胞凋亡形态的影响
DAPI 荧光染色结果表明:正常对照组细胞边缘清晰,染色均匀(图1A);MPP+诱导损伤的SHSY5Y 细胞可出现明显的凋亡细胞特征性改变,表现为大部分细胞胞体缩小,胞质浓缩,细胞核体积缩小,细胞碎裂,出现典型的凋亡小体(图1B);而10、50、100 μmol/L FMF 可显著抑制MPP+诱导的SH-SY5Y 细胞形态学改变,减少凋亡细胞数(图1C-E),且呈浓度依赖性。

图1 DAPI 染色观察FMF 对SH-SY5Y 细胞形态学的影响(×400)Fig 1 Effect of FMF on the morphology of SH-SY5Y cells detected by DAPI staining(×400)
2.2 FMF对MPP+诱导SH-SY5Y 细胞凋亡率的影响
各组SH-SY5Y 细胞凋亡率比较,差异有统计学意义(F=142.737,P<0.01)。与正常对照组相比,模型组细胞凋亡率显著增加,差异有统计学意义(P<0.01);与模型组相比,分别给予不同浓度的FMF(10、50、100 μmol/L)处理后,SH-SY5Y 细胞凋亡率显著降低,差异均有统计学意义(P 均<0.01),表明FMF 对MPP+诱导损伤的SH-SY5Y 细胞具有浓度依赖性保护作用。见表1。
表1 FMF 对SH-SY5Y 细胞凋亡率的影响(n=6,±s)Tab1 Effect of FMF on the apoptosis rate of SH-SY5Y cells(n=6,±s)

表1 FMF 对SH-SY5Y 细胞凋亡率的影响(n=6,±s)Tab1 Effect of FMF on the apoptosis rate of SH-SY5Y cells(n=6,±s)
组别正常对照组模型组FMF 低剂量组FMF 中剂量组FMF 高剂量组凋亡率(%)8.18±0.99 37.65±3.92*28.87±1.86Δ 21.23±2.16Δ 17.73±1.33Δ浓度(μmol/L)0 250 10 50 100
2.3 FMF 对MPP+诱导SH-SY5Y 细胞线粒体膜电位(ΔΨm)的影响
各组ΔΨm 比较,差异有统计学意义(F=132.384,P<0.01)。与正常对照组相比,模型组ΔΨm 显著升高,差异有统计学意义(P<0.01),提示MPP+处理细胞72 h 后线粒体膜电位发生了去极化。与模型组相比,分别给予不同浓度的FMF 预处理后ΔΨm 均有下降趋势,其中FMF 中、高剂量组和模型组比较,差异有统计学意义(P 均<0.01),FMF 低剂量组与模型组比较差异无统计学意义(P=0.312)。见表2。
表2 FMF 对SH-SY5Y 细胞ΔΨm 的影响(n=6,±s)Tab 2 Effect of FMF on the ΔΨm of SH-SY5Y cells(n=6,±s)

表2 FMF 对SH-SY5Y 细胞ΔΨm 的影响(n=6,±s)Tab 2 Effect of FMF on the ΔΨm of SH-SY5Y cells(n=6,±s)
注:与正常对照组相比,*P<0.01;与模型组相比,ΔP<0.01。
组别正常对照组模型组FMF 低剂量组FMF 中剂量组FMF 高剂量组浓度(μmol/L)0 250 10 50 100 ΔΨm(%)1.89±0.51 11.58±1.28*10.37±1.26 8.25±0.86Δ 5.96±0.69Δ
2.4 FMF 对MPP+ 诱 导SH-SY5Y 细 胞Bcl-2、Bax、Caspase-3 蛋白表达的影响
各组Bcl-2 蛋白表达水平结果显示:多组间比较,差异有统计学意义(F=214.342,P<0.01)。与正常对照组相比,模型组B c l-2 蛋白表达水平明显降低(P<0.01),与模型组相比,FMF(10、50、100 μmol/L)Bcl-2 蛋白表达水平随药物浓度的增加逐渐升高,其中FMF 中、高剂量组升高明显,和模型组比较差异有统计学意义(P 均<0.01),低剂量组和模型组相比差异无统计学意义(P=0.080)。
各组Bax 蛋白表达水平比较结果显示,各组间差异有统计学意义(F=134.542,P<0.01)。与正常对照组相比,模型组Bax 蛋白表达水平均明显升高(P<0.01)。FMF(10、50、100 μmol/L)组蛋白Bax表达水平随药物浓度的增加逐渐减少,且与模型组相比,差异均有统计学意义(P 均<0.01)。
各组Bcl-2/Bax 比值比较结果显示,表明各组间差异有统计学意义(F=1 944.449,P<0.01)。与正常对照组相比,模型组Bcl-2/Bax 比值明显降低(P<0.01),与模型组相比,FMF(10、50、100 μmol/L)3个浓度实验组的Bcl-2/Bax 比值与模型组相比显著升高,差异均有统计学意义(P 均<0.01)。
各组Caspase-3 蛋白表达水平比较结果显示,各组间差异显著(F=268.902,P<0.01)。与正常对照组相比,模型组Caspase-3 蛋白表达水平明显升高(P<0.01)。FMF(10、50、100 μmol/L)Caspase-3表达水平随药物浓度的增加逐渐减少,且与模型组相比,差异均有统计学意义(P 均<0.01)。见图2 、表3。

图2 FMF 对SH-SY5Y 细胞Bcl-2、Bax、Caspase-3 蛋白表达的影响Fig 2 Effect of FMF on the protein expression of Bcl-2/Bax/Caspase-3 in SH-SY5Y cells
表3 FMF 对SH-SY5Y 细胞Bcl-2、Bax、Caspase-3 蛋白表达的影响(n=6,±s)Tab 3 Effect of FMF on the protein expression of Bcl-2/Bax/Caspase-3 in SH-SY5Y cells(n=6,±s)
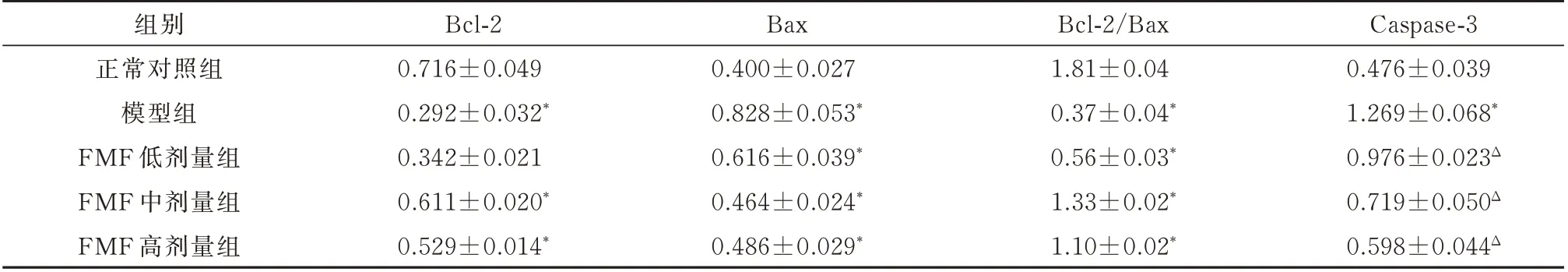
表3 FMF 对SH-SY5Y 细胞Bcl-2、Bax、Caspase-3 蛋白表达的影响(n=6,±s)Tab 3 Effect of FMF on the protein expression of Bcl-2/Bax/Caspase-3 in SH-SY5Y cells(n=6,±s)
Caspase-3 0.476±0.039 1.269±0.068*0.976±0.023Δ 0.719±0.050Δ 0.598±0.044Δ组别正常对照组模型组FMF 低剂量组FMF 中剂量组FMF 高剂量组Bcl-2 0.716±0.049 0.292±0.032*0.342±0.021 0.611±0.020*0.529±0.014*Bax 0.400±0.027 0.828±0.053*0.616±0.039*0.464±0.024*0.486±0.029*Bcl-2/Bax 1.81±0.04 0.37±0.04*0.56±0.03*1.33±0.02*1.10±0.02*
3 讨论
PD 的病因主要与老龄化、遗传和环境等综合因素有关,其发病机制仍未十分清楚。近年来研究认为氧化应激损伤、线粒体功能障碍、细胞凋亡、神经炎症等是造成PD 多巴胺能神经元变性坏死的发病机制,尤其是线粒体功能障碍被认为与PD 发病密切相关[10]。线粒体被誉为细胞的“能量代谢工厂”,通过氧化磷酸化途径产生能量以供给细胞代谢。近年来研究表明,线粒体对于细胞凋亡过程的调节起到关键作用,其结构和功能的改变与细胞凋亡密切相关[11,12]。线粒体功能障碍不仅会损害细胞的能量代谢,而且可导致线粒体氧化呼吸链断裂,活性氧自由基(reactive oxygen species,ROS)大量生成,进一步导致线粒体膜发生脂质过氧化,通透性增高,线粒体膜电位(∆Ψ)降低,线粒体膜通透性转 换 孔(mitochondrial permeability transition pore,MPTP)开放,最终触发细胞凋亡[11]。
细胞凋亡(apoptosis)是一种由基因控制的细胞自主的程序性细胞死亡。线粒体凋亡途径是细胞凋亡主要途径之一,是由线粒体释放细胞色素C(cytochrome C)继而激活Caspases 级联反应的内源性 凋 亡 信 号 通 路[13,14]。Bcl-2 家 族 蛋 白 在 线 粒 体 凋亡途径中发挥着重要的调控作用。Bcl-2 基因是抑制凋亡因子,定位于线粒体外膜上,具有抑制细胞凋亡的作用[15]。Bax(Bcl-as-sociated X protein)是与Bcl-2 同源的凋亡相关基因,定位于细胞浆,与Bcl-2抑制细胞凋亡的作用正好相反,Bax 是促凋亡因子,促进细胞凋亡[16]。Bcl-2/Bax 比值的变化与线粒体凋亡密切相关。凋亡抑制蛋白Bcl-2 可以通过拮抗促凋亡蛋白Bax 的活性,抑制线粒体释放Cyto‐chrome C,阻止Cytochrome C 激活Caspase 级联反应,从而抑制细胞凋亡[17]。含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)在凋亡执行过程中起到关键的作用。其中Caspase 3 被认为是细胞凋亡过程中最关键的凋亡执行蛋白,它的激活被认为是凋亡进入不可逆阶段的标志[18]。一般情况下,Caspase-3 在细胞中处于无活性状态,当多种刺激因素启动凋亡程序,激活Caspase-3,最终导致细胞凋亡[19,20]。
本实验结果显示,经MPP+诱导损伤后,SHSY5Y 细胞可出现明显的凋亡细胞特征性改变,细胞凋亡率增加,线粒体膜电位升高,Bcl-2/Bax 比值下降,Caspase-3 表达增加,提示细胞发生凋亡,这与文献报道基本一致[21]。FMF 处理后,MPP+对SHSY5Y 细胞的形态损伤有一定的改善,凋亡细胞数下降,线粒体膜电位下降,Bcl-2 表达上调,Bax 和Caspase-3 表达下调,Bcl-2/Bax 比值上升。以上研究结果表明FMF 对MPP+诱导的SH-SY5Y 细胞损伤具有明显的修复作用,其保护机制与有效地调控SH-SY5Y 细胞凋亡相关的蛋白表达,抑制细胞凋亡有关。本研究仅表明FMF 的作用机制与细胞凋亡相关,但有关FMF 通过具体的信号通路调控细胞凋亡,有待后续实验进一步深入的研究,为FMF治疗帕金森病提供实验依据。
