红球菌利用小龙虾壳粉产几丁质脱乙酰酶的培养条件优化
2021-05-15张建旭王璐颖郑晓卫孙纪录桑亚新
张建旭,王璐颖,郑晓卫,李 宁,孙纪录*,桑亚新
(1 河北农业大学食品科技学院 河北保定071001 2 中粮营养健康研究院有限公司 营养健康与食品安全北京市重点实验室 北京102209)
壳聚糖在农业、食品工业、生物医药等多个领域应用广泛[1-2]。几丁质脱乙酰酶(Chitin deacetylase,CDA)是催化水解几丁质中的乙酰基,使几丁质转化壳聚糖的一组酶[3]。酶法生产壳聚糖绿色环保,是该行业未来的一个重要发展方向[4]。由CDA处理几丁质得到的壳聚糖脱乙酰度高,产品质量稳定[5]。然而,CDA 直接作用于几丁质效率低,酶活力不高等,限制其在实际生产中的使用[6]。近期的研究表明,CDA 对经处理破坏晶体型态后形成的无定形、胶体或超细几丁质能发挥出较大的酶活性[7-8]。目前,国内外对CDA 的研究大都集中在高产菌株选育,产酶工艺条件优化,酶学特性,酶的结构以及CDA 对底物的催化机理等方面[4],尚未有利用小龙虾壳作为培养基优化产酶的报道。
我国小龙虾产量丰富,消费量大,副产物小龙虾壳数量巨大。将小龙虾壳回收利用,有利于资源利用和环境保护[9]。小龙虾壳中含有丰富的蛋白质[10-11],可为红球菌生长提供营养,然而,其与几丁质和碳酸钙紧密结合[12],不利于微生物的利用。理论上,通过一定的预处理,可使虾壳中的蛋白质脱落分散,从而有利于红球菌的利用[11]。目前报道的红球菌产CDA 发酵培养基往往成本较高[13]。本研究拟利用小龙虾壳粉作为主要原料,通过预处理和适量补加成分,研发红球菌高产CDA 的新型培养基,并优化其它培养条件,以期降低CDA 的生产成本,从而降低酶法生产壳聚糖的成本。
1 材料与方法
1.1 菌种
红球菌(Rhodococcus sp.)菌株11-3[14],山东省食品发酵工业研究设计院食品发酵工程重点实验室惠赠。
1.2 主要原料、试剂和培养基
小龙虾壳粉:小龙虾,保定市农产品批发市场。清洗虾壳,然后于电热鼓风干燥器中60 ℃干燥至恒重。将烘干的虾壳粉碎,过120 目筛,制得虾壳粉。
主要试剂:碱性蛋白酶,北京索莱宝科技有限公司;蔗糖、硫酸铵,国药集团化学试剂有限公司;玉米浆,华北制药康欣有限公司;对硝基苯胺,天津市华东试剂厂;对硝基乙酰苯胺,上海源叶生物有限公司;除玉米浆为生化试剂外,其它均为分析纯级试剂。
培养基:NB 培养基,用于红球菌的活化。
1.3 主要仪器与设备
721G 可见分光光度计,上海仪电分析仪器有限公司;PHS-3DW 型pH 计,安徽合肥桥斯仪器设备有限公司;ZWY-2102C 恒温培养振荡器,上海智城分析仪器制造有限公司;TG16-WS 台式高速离心机,湖南湘仪实验室仪器开发有限公司;HH-4 数显恒温水浴锅,金坛市良友仪器有限公司;SCIENTZ-48 高通量组织研磨仪,宁波新芝生物科技股份有限公司。
1.4 试验方法
1.4.1 菌种的活化 将冷藏的红球菌11-3 接种于NB 培养基中,30 ℃,180 r/min,摇床振荡培养12 h。
1.4.2 几丁质脱乙酰酶的酶活力测定 CDA 酶活力的测定方法参照文献[15],标准曲线见图1。
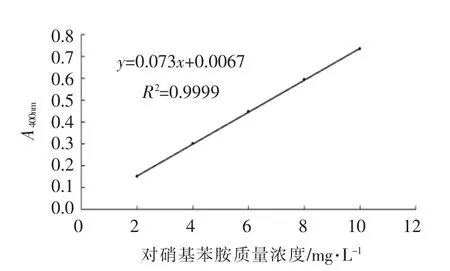
图1 对硝基苯胺标准曲线Fig.1 P-nitroaniline standard curve
1.4.3 虾壳粉培养基的配制 经预试验,将10%的虾壳粉配制成培养基,调pH 值至7.5,分装至三角瓶中,灭菌后以1%接种量接入活化的红球菌11-3,于180 r/min,30 ℃振荡培养2 d,以发酵液为粗酶液测定酶活力,每组试验做3 组平行,结果取平均值。
1.4.4 碱性蛋白酶预处理对产酶的影响 根据前期的研究[16]结果,①固定碱性蛋白酶添加量4 U/mg,分别处理2,3,4,5,6 h;②固定处理时间4 h,选择添加量0,2,4,6,8 U/mg。用碱性蛋白酶在最适酶解温度(45 ℃)和pH 值(10)条件下对虾壳粉做预处理,对不同处理的培养基调pH 值至7.5,后续流程与1.4.3 节操作相同。
1.4.5 补充营养成分的单因素试验 在上述得到的培养基中分别补充不同量的蔗糖 (0.20%,0.45%,0.70%,0.95%,0.12%)、硫酸铵(0.15%,0.20%,0.25%,0.30%,0.35%)、玉米浆(0.00%,0.25%,0.50%,0.75%,1.00%),调pH 值为7.5,后续流程与1.4.3 节操作相同。
1.4.6 发酵条件对产酶的影响 在上述配制的最优培养基下,考察摇床转速的影响:固定1%接种量,2 d 发酵时间,选择140,160,180,200,220 r/min 的摇床转速;考察接种量的影响:固定180 r/min 摇床转速,2 d 发酵时间,选择1%,2%,3%,4%,5%的接种量;考察发酵时间的影响:固定1%接种量,180 r/min 摇床转速,选择发酵时间1,1.5,2,2.5,3 d。
1.4.7 Plackett-Burman 试验 经以上试验筛选出的因素,用Design Expert 8.1 进行Plackett-Burman 试验设计,筛选对产CDA 酶活力最具影响的因素,以减少后期优化试验组数[17]。根据各因素对产酶影响的显著性选定7 个因素,其编码水平见表1。
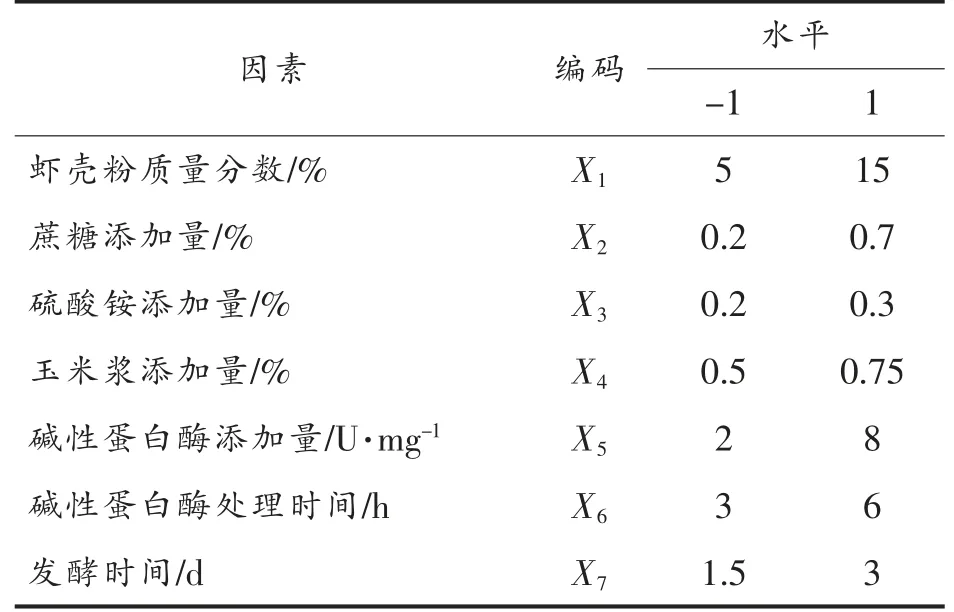
表1 Plackett-Burman 试验设计因素及编码水平Table 1 The factors and coding levels of Plackett-Burman test design
1.4.8 最陡爬坡试验 为确定最具影响因素的最佳中心水平,利用最陡爬坡试验逼近最佳试验范围,根据Plackett-Burman 试验设计获得的显著影响因子和各因素的效应值确定最陡爬坡试验的因素、爬坡方向和试验步长[18]。
1.4.9 Box-Behnken 试验 采用Design Expert 8.1 进行Box-Behnken 试验设计[19],以CDA 酶活力为响应值,各显著影响因子的水平为自变量,对最显著影响的因素水平进一步优化。其编码水平见表2。
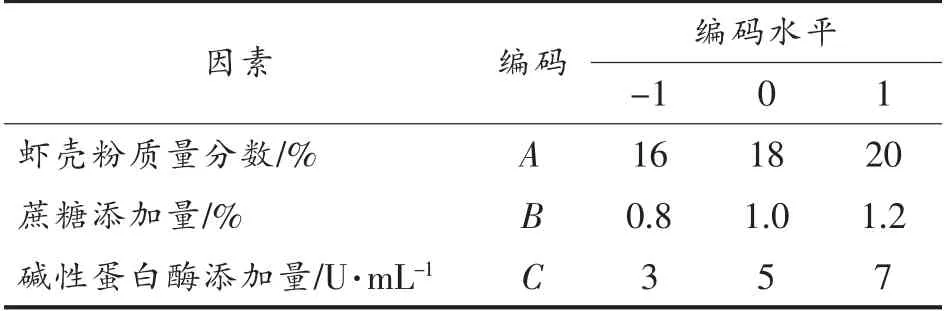
表2 Box-Behnken 试验因素及编码水平Table 2 The factors and coding levels of Box-Behnken test
1.4.10 数据处理 用Design Expert 8.1 进行Plackett-Burman 设计和Box-Behnken 试验设计,并对结果进行模型设计及方差分析。用SPSS Statistics 22.0 对单因素试验进行显著性分析,差异显著水平为P<0.05。
2 结果与分析
2.1 碱性蛋白酶预处理
碱性蛋白酶在蟹壳脱蛋白中的效果较好[16]。因小龙虾壳与蟹壳在化学组成和结构上具有相似性,故选择碱性蛋白酶进行预处理,结果如图2所示。
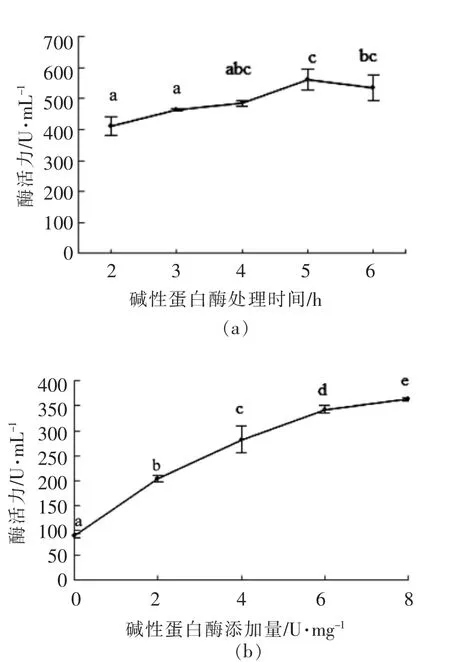
图2 碱性蛋白酶处理时间及添加量对产CDA 酶活力的影响Fig.2 Effect of treatment time and addition amount of alkaline protease on CDA production
由图2a 可见,随着蛋白酶处理时间的延长,CDA 酶活力增加,在处理时间5 h 时达到最大值,处理时间4,5,6 h 时酶活力在统计学上无显著差异。由图2b 可见,随着蛋白酶添加量的增加,CDA酶活力增加,当添加量为8 U/mg 时,增长趋于平缓,CDA 酶活力从未经酶处理组的89.73 U/mL 增加到362.88 U/mL。
2.2 虾壳粉培养基中补充营养成分对产酶的影响
为进一步提高酶活力,在上述培养基中补充碳源、氮源和生长因子。按照文献[13]中添加物及其添加量选择硫酸铵、玉米浆、蔗糖作为补充成分,并以最佳水平为中心水平进行单因素优化,结果如图3所示。

图3 补充营养物添加量对产CDA 酶活力的影响Fig.3 Effect of supplemental nutrient addition on CDA production
随着硫酸铵添加量的增加,CDA 酶活力先升高后降低,在硫酸铵添加量为0.25%时,达到最大值619 U/mL。随着玉米浆和蔗糖添加量的增加,CDA 酶活力均先增加,然后分别在添加量为0.75%和0.45%时趋于稳定,最大值分别为582 U/mL 和666 U/mL。
2.3 发酵条件对产酶的影响
选择摇床转速、接种量和发酵时间作为考察指标进行优化,结果如图4a、4b 和4c 所示。
在受试范围,由于接种量与摇床转速对产酶活力影响无显著性差异(图4a 和4b),因此它们不是影响产酶的主要因素。根据试验结果,接种量和摇床转速分别选择3%和200 r/min。发酵时间对酶活力影响较大 (图4c),随着发酵时间的延长,酶活力先较快增加,2.5 d 时趋于平缓。
2.4 确定显著影响因素的Plackett-Burman 试验
通过Plackett-Burman 试验设计,对虾壳粉浓度,蔗糖、硫酸铵和玉米浆添加量,碱性蛋白酶添加量和处理时间,以及发酵时间7 个因素进行筛选,结果见表3。

表3 Plackett-Burman 试验设计及其响应值Table 3 Plackett-Burman test design and its response value
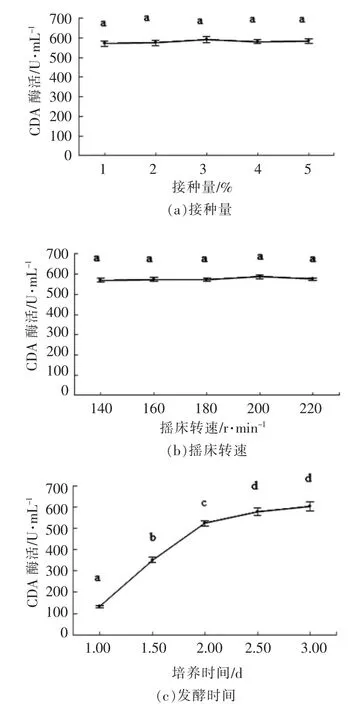
图4 发酵条件对产CDA 酶活力的影响Fig.4 Effects of fermentation conditions on CDA production
使用Design Expert 8.1 软件对所得试验结果进行方差分析和回归拟合,结果见表4。各因素对红球菌11-3 产CDA 酶活力影响的一次回归方程为:
酶活力 (U/mL)=1900.0+384.9X1+247.1X2+72.8X3-149.3X4-192.4X5-7.9X6+68.3X7
方差分析模型的F 值和P 值分别为12.01和0.015,说明一次回归方程模型显著(P<0.05)。经Design Expert 8.1 软件计算,本试验的精密度为10.492>4.0,说明该模型合理。7 个受试因素中,具有显著影响(P<0.05)的因素为虾壳粉(X1)、蔗糖(X2)、碱性蛋白酶添加量(X5),由软件得出其影响水平E 分别为769.82,494.11,-384.79,表明三者对红球菌产酶影响分别为正效应、正效应和负效应。
2.5 最陡爬坡试验
用Plackett-Burman 试验筛选出的对产CDA酶活力影响显著的3 个因素设计最陡爬坡试验,根据因素的正、负效应确定最陡爬坡试验的变化方向,参照因素效应比例,结合实际各因素对产酶影响水平,确定登高步长,快速逼近最大响应区域,结果见表5。
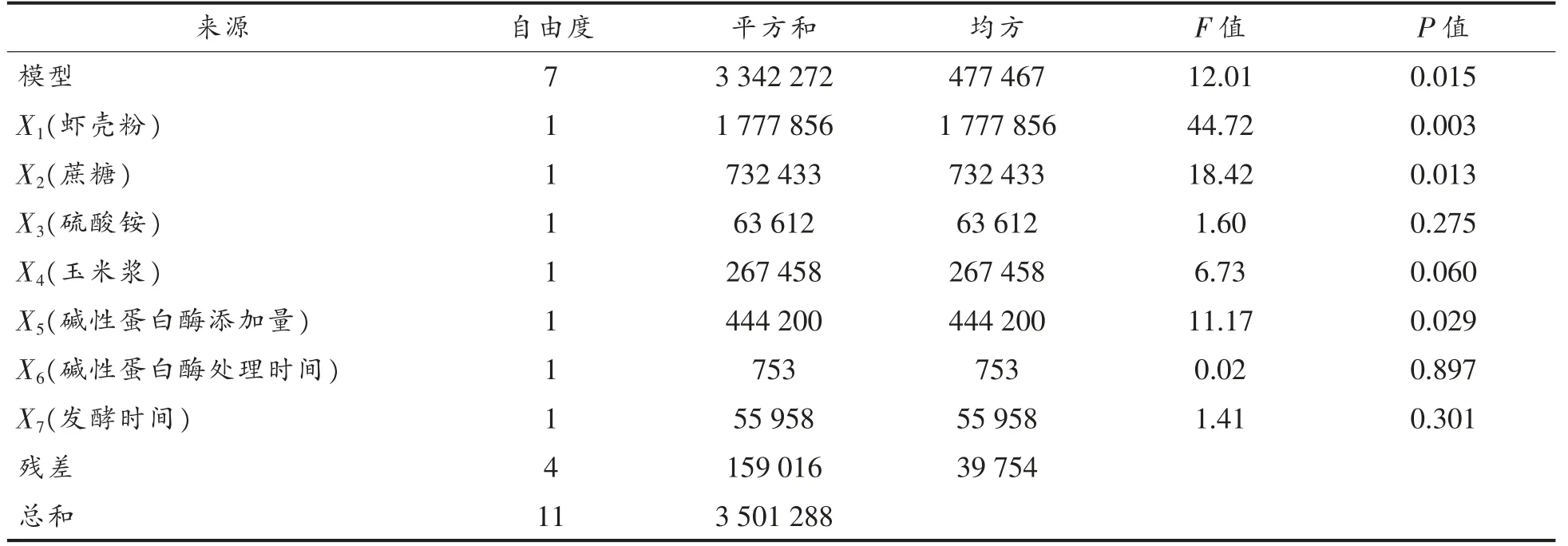
表4 Plackett-Burman 试验设计方差分析Table 4 Variance analysis of Plackett-Burman test design
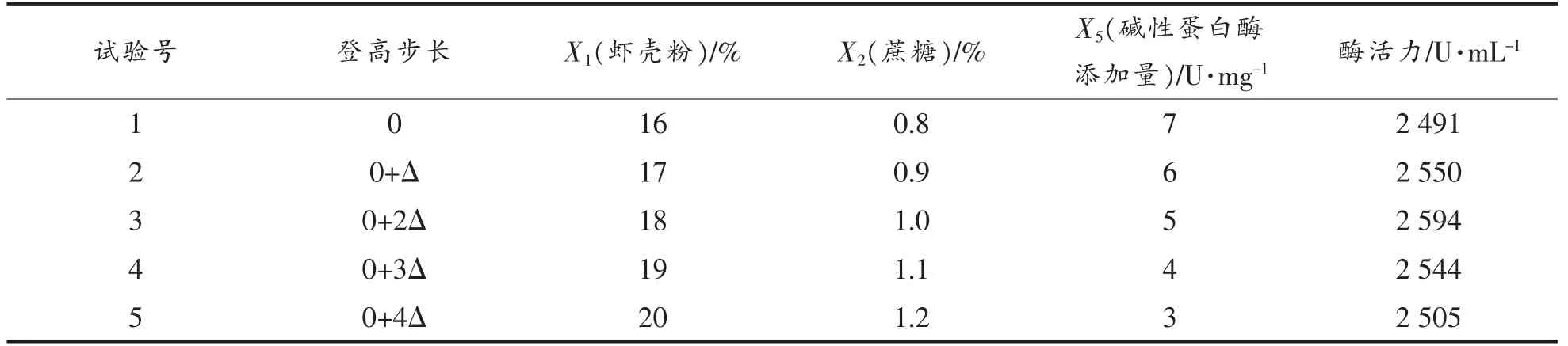
表5 最陡爬坡试验设计及结果Table 5 The steepest climbing test design and results
由表5可知,CDA 酶活力随着登高步长的增长呈先增高后降低的趋势。因试验3 酶活力最高,故以试验3 的3 个因子的水平作为响应面试验的中心点,做Box-Behnken 试验。
2.6 Box-Behnken 试验
Box-Behnken 试验设计及结果见表6,其方差分析结果见表7。

表6 Box-Behnken 试验设计及其响应值Table 6 Box-Behnken test design and its response value
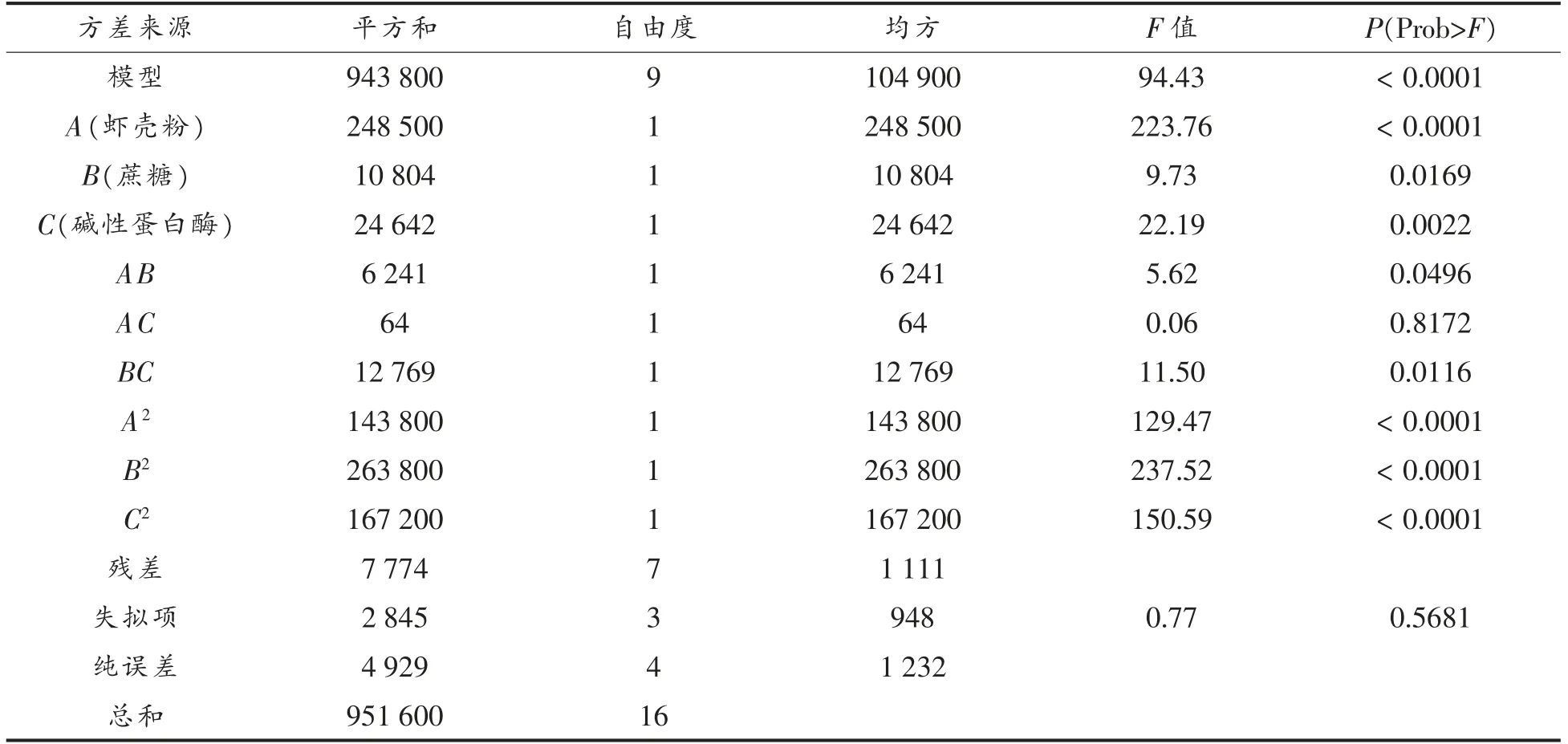
表7 Box-Behnken 试验设计方差分析表Table 7 Variance analysis of Box-Behnken test design
用Design Expert 7.1.6 对表6中的数据进行二次多元回归拟合,得到二次多元回归模型为:
酶活力=2663.60+176.25A-36.75B-55.50C+39.50AB-4.00AC+56.50BC-184.80A2-250.30B2-199.30C2
方差分析显示,模型显著(P<0.01),失拟项不显著(P=0.5681>0.05),表明该模型可应用于虾壳粉浓度、蔗糖添加量、碱性蛋白酶添加量对产CDA酶活力的影响。R2=99.18%,表明模型的相关性较好;R2Adj=98.13%,表明响应面98.13%的结果可由该模型表示。本试验的变异系数为1.41%,说明模型拟合较好。本模型精密度为26.902>4.0,说明虾壳粉含量、蔗糖浓度、碱性蛋白酶添加量对产CDA酶活力影响的试验数据可靠,可用此回归方程对红球菌在虾壳粉培养基中产酶状况的试验结果进行分析和预测。
利用Design Expert 8.1 软件对回归模型进行响应面分析,得到各响应面的二维等高线和三维立体图,如图5所示。
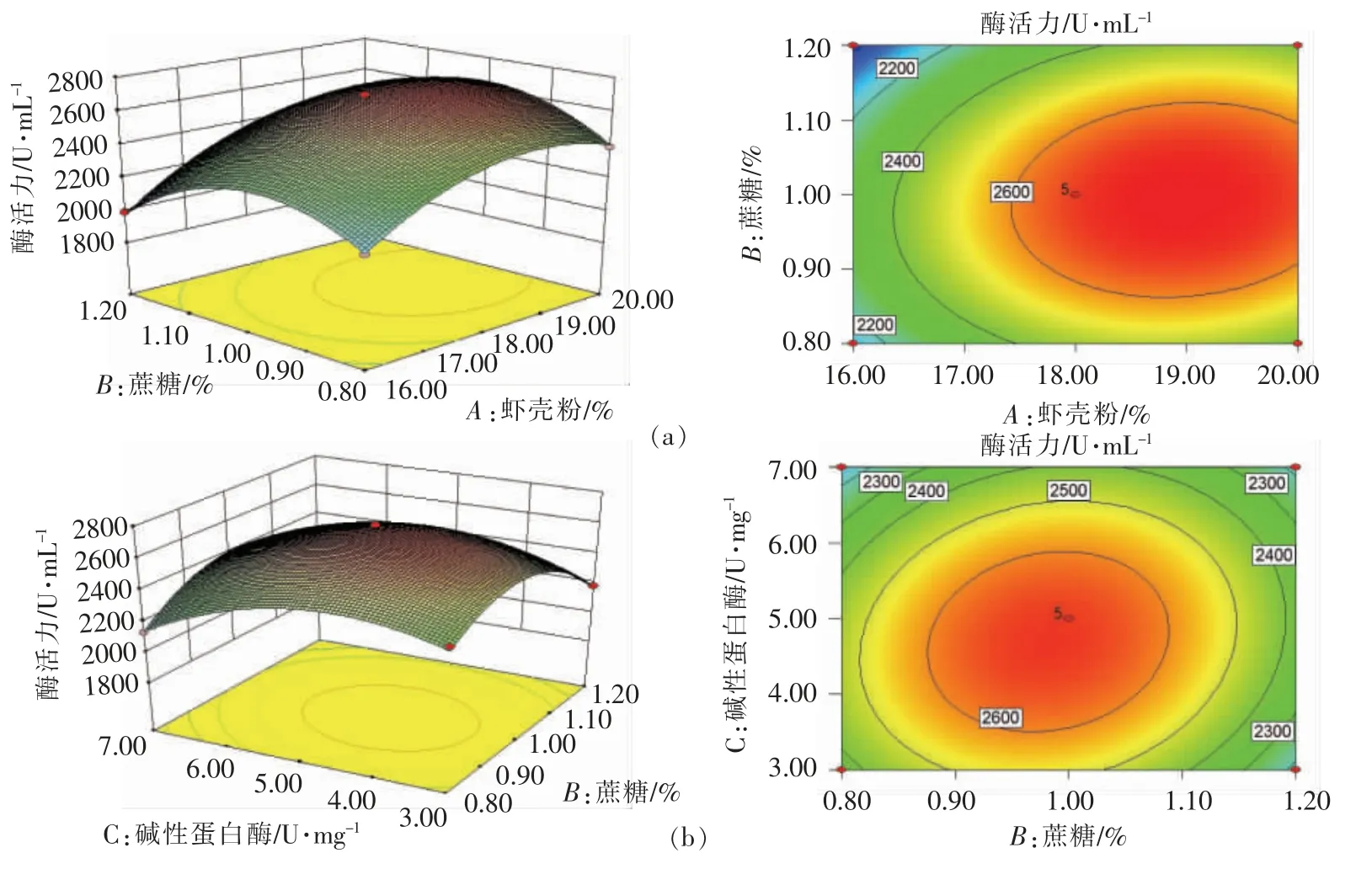

图5 虾壳粉、蔗糖和碱性蛋白酶交互作用对红球菌产CDA 酶活力的响应面及等高线图Fig.5 Response surface and contour map of the effects of the interactions of crayfish shell powder,sucrose and alkaline protease on the activity of CDA produced by Rhodococcus
由图5可知,虾壳粉、蔗糖以及碱性蛋白酶对CDA 酶活力的影响存在交互作用。由Design Expert 8.1 软件分析得到:虾壳粉与蔗糖、蔗糖与碱性蛋白酶交互显著,虾壳粉与碱性蛋白酶交互不显著。虾壳粉质量分数、蔗糖添加量及碱性蛋白酶添加量分别为18.94%,0.99%和4.70 U/mg 时,产CDA 酶活力最大值为2 710 U/mL。为方便试验操作,将虾壳粉浓度、蔗糖添加量及碱性蛋白酶添加量分别按照19%,1%和5 U/mg 对试验预测值进行验证,最终酶活力为2 723 U/mL,与预测值接近,说明该模型能较好地预测实际红球菌在虾壳粉培养基中的产CDA 酶活力。
经以上优化,红球菌11-3 产CDA 酶活力高达2 723 U/mL。与起始的虾壳粉培养基产酶活力(50 U/mL)相比,增高了约53 倍,与文献[13]中的产酶发酵培养基产酶活力较为接近。
3 结论
对19%虾壳粉培养基,用碱性蛋白酶以5 U/mg 添加量处理4 h,释放虾壳粉中的蛋白质。在其中添加1%蔗糖、0.25%硫酸铵和0.75%玉米浆。以3%的接种量接入红球菌11-3,200 r/min 振荡培养2.5 d,产CDA 酶活力高达2723 U/mL,相比起始的虾壳粉培养基(酶活力50 U/mL),产酶活力提高了约53 倍,与文献[13]中的产酶发酵培养基产酶活力相当。以虾壳粉为主要成分的培养基可产生较高酶活力的CDA,这将有利于降低生产成本,也为将来使用生物法从虾壳中直接提取壳聚糖提供了研究基础。
