短乳杆菌鸟氨酸氨甲酰基转移酶对黄酒发酵中氨基甲酸乙酯的调控作用
2021-05-15方若思陈唐超梁淑敏金诚豫黄温迪龚金炎肖功年
方若思,陈唐超,梁淑敏,金诚豫,黄温迪,龚金炎,肖功年
(浙江科技学院 杭州310023)
氨基甲酸乙酯(Ethyl carbamate,EC)是一种在动物乃至人体内具有潜在致癌性的2A 类致癌物,存在于多种发酵食品及酒精饮料中,如酱油、奶酪、葡萄酒、黄酒等[1-3]。研究表明,尿素、瓜氨酸、氨甲酰磷酸、氰酸和焦碳酸二乙酸是EC 形成的前体物,其中酵母菌和部分乳酸菌通过精氨酸代谢途径产生的尿素和瓜氨酸是最重要的2 种前体物[4]。
酒类的瓜氨酸主要自精氨酸脱亚胺酶途径代谢产生,在这一途径中包括3 种关键酶,分别为精氨酸脱亚胺酶 (Arginine deimidase,ADI,EC3.5.3.6)、鸟氨酸氨甲酰基转移酶 (Ornithine transcarbamoylase,OTC,EC2.1.3.3)和氨基甲酸激酶(Carbamate kinase,CK,EC2.7.2.2)[5-7]。该途径将精氨酸水解,最终转化为鸟氨酸、氨和二氧化碳。
目前关于鸟氨酸氨甲酰转移酶的研究较少,主要集中在人体内,由于是肝脏尿素循环的必需酶,因此OTC 酶的缺失常导致嗜睡、呕吐、精神发育迟缓等症状,同时OTC 的缺失与否也可作为肝细胞癌的早期诊断指标之一[8-9]。根据之前的研究发现,OTC 与氨基甲酸乙酯的形成呈负相关性[10-11],即OTC 的表达对EC 的形成有抑制作用,然而OTC 与EC 的直接关联性未见研究报道。
短乳杆菌是一类革兰氏阳性兼性厌氧菌,在含碳水化合物的动物、植物发酵产品以及温血类动物的消化系统中十分常见,作为一般认为安全(Generally recognized as safe,GRAS) 的食品级微生物,在食品、工业、农牧业及医药等领域中亦拥有重要的应用价值[12]。挖掘益生性乳酸菌源的酶类是目前人们的关注点之一。
本研究以短乳杆菌中的鸟氨酸氨甲酰基转移酶为对象,通过基因克隆表达手段和Ni-NTA 纯化方法,获得大量高纯度的OTC 酶,在黄酒发酵的不同阶段直接添加到酒体中,研究其与EC 之间的相互作用,为挖掘其潜在的工业应用价值奠定基础。
1 材料与方法
1.1 材料与试剂
短乳杆菌(Lactobacillus brevis)和质粒pET-28a 由本实验室保存,大肠杆菌(Escherichia coli)BL21(DE3),全试金公司。
细菌基因组提取试剂盒、质粒DNA 提取试剂盒、PCR 产物回收试剂盒、琼脂糖凝胶回收试剂盒、Ni-NTA 琼脂糖树脂、L-精氨酸、L-瓜氨酸、DL-鸟氨酸、茚三酮、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、硫酸卡那霉素(Kan),生工生物工程(上海)股份有限公司;T4 DNA 连接酶、限制性内切酶BamHI、SalI,TaKaRa 公司;麦曲、酒药,浙江塔牌黄酒公司。
1.2 方法
1.2.1 鸟氨酸氨甲酰基转移酶的克隆 短乳杆菌OTC 酶的正向引物序列为:5’-cgcggatccATGAC TAAGGATTTTCGGGAAAATGTA-3’(下划线为BamHI 识别序列),反向引物序列为:5’-acgcgtc gacTTAAGCTCGTGGAATGAATAAGTTACCT-3’(下划线为SalI 识别序列)。以短乳杆菌的基因组DNA 为模板进行基因扩增,PCR 产物经1%琼脂糖凝胶电泳验证后进行纯化。
1.2.2 重组表达质粒的构建 采用限制性内切酶BamHI 和SalI 分别对短乳杆菌OTC 基因片段和载体pET-28a 进行双酶切。酶切产物经试剂盒回收后,连接并转化大肠杆菌BL21(DE3)感受态细胞,涂布在含卡那霉素的LB 平板上,经菌落PCR验证后,筛选得到阳性克隆,并测序鉴定目的基因序列。
1.2.3 重组鸟氨酸氨甲酰基转移酶的诱导表达与分离纯化 挑取阳性单菌落接种于5 mL 含卡那霉素的LB 培养基中,于37 ℃,200 r/min 振荡培养过夜。按1%(体积分数)接种量转接于200 mL 的LB 培养基中,继续于37 ℃,200 r/min 振荡培养,至OD600nm达到0.6~0.8 时,加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG),于25 ℃,180 r/min 诱导培养过夜。离心收集菌体后,加入30 mL 缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L Imidazole,pH 8.0)重悬菌体,随后冰水浴超声破碎细胞,于4 ℃,12 000 r/min 离心20 min,获得上清液。参照Ni-NTA 琼脂糖树脂的使用说明方法,采用亲和层析纯化重组蛋白,随后利用SDSPAGE 检测蛋白纯度及分子质量。
1.2.4 黄酒酿造过程及试验处理方法 以0.8 kg糯米为原料,30 ℃下浸米2 d,高温蒸煮后冷却,加入160 g 麦曲和1.6 g 酒药及0.96 L 水,搅拌均匀后于28 ℃发酵。以不作任何处理的自然发酵黄酒作为对照组(CK),在发酵第5 天加入纯化后的鸟氨酸氨甲酰基转移酶(5D),在发酵第12 天加入相同浓度的鸟氨酸氨甲酰基转移酶(12D),分析比较发酵过程中EC 及其相关代谢物的差异。
1.2.5 氨基甲酸乙酯的HPLC-FLD 测定 测定方法参照Fu 等[3]的报道,样品与0.1 mL,1.5 mol/L盐酸和0.2 mL,0.01 mol/L 占吨醇正丙醇溶液衍生后,通过高效液相色谱法检测。以甲醇和水作为流动相,荧光检测器激发波长233 nm,发射波长600 nm,梯度洗脱进样。
1.2.6 尿素、瓜氨酸和鸟氨酸氨甲酰基转移酶活的测定 尿素和瓜氨酸的检测方法分别参照陈宜宜等[13]和Boyde 等[14]的文献所述,通过与显色剂的显色反应来检测发酵液中的含量。
取发酵液超声15 min 破碎细胞,于4 ℃,12 000 r/min 离心20 min,取上清为原蛋白提取物。根据茚三酮显色反应来测定OTC 酶活[15],蛋白含量则采用Bradford 法进行测定。本试验中OTC酶活定义为每分钟水解1 mg 蛋白质产生1 μmol鸟氨酸所需要的酶量为1 个酶活单位。
1.2.7 黄酒基础理化品质的检测分析
1.2.7.1 黄酒中游离氨基酸的含量测定 采用日本日立L-8900 氨基酸分析仪进行测定。检测原理为采用茚三酮作为衍生剂与氨基酸衍生后检测分析。前处理方法为:取50 mL 黄酒样品,加0.1 mol/L 盐酸溶液超声振荡5 min,加5%磺酸水杨酸去除蛋白,离心后采用氮吹仪浓缩,加0.02 mol/L盐酸2 mL,振荡后过膜,上机检测。
1.2.7.2 挥发性风味物质的检测 将8 mL 酒样和0.2 g NaCl 加入顶空瓶中,50 ℃下磁力搅拌加热15 min 后,将萃取头插入顶空瓶中,继续于50℃下加热30 min 后进样。GC 色谱条件:载气为氮气,流速为1 mL/min,无分流进样;程序升温:初始柱温40 ℃,保持5 min,以5 ℃/mL 的速率升温至230 ℃,保持10 min。进样口温度250 ℃,GC 解析时间2.5 min。质谱条件:电子轰击离子源(EI)电子能量为70 eV,离子源温度250 ℃,接口温度250 ℃,检测口电压为350 V。扫描方式为全扫描,质量范围为35~350[16]。
1.2.7.3 电子舌味觉分析 相对于感官鉴评方法,电子舌实现了酸、苦、涩、咸、鲜和甜味等基本味及回味的数字化评价,具有结果稳定且受外界影响小的优点。
取适量待测样品置于电子舌测试杯中,对其酸、甜、苦、涩、咸、鲜等基本味及回味进行测定,不同味觉与传感器一一对应,所有传感器分别在参比溶液和黄酒样品中浸泡、洗涤,测得电势值Vr和Vs,通过对Vs-Vr 值的计算,即可对黄酒的酸、甜、苦、涩、咸和鲜味等基本味和回味进行分析。每个样品重复测试4~5 次,为减少系统误差,选后3次纳入数据分析[17]。
1.2.8 数据统计分析 每个试验重复3 次,采用SPSS 软件对数值进行差异显著性分析。
2 结果与分析
2.1 黄酒发酵中不同处理组氨基甲酸乙酯的变化规律研究
前期研究发现,OTC 与EC 的形成呈负相关性[10-11],即OTC 的表达对EC 的形成有抑制作用,而OTC 与EC 的直接关联性并未见任何报道。因此,本试验分别在黄酒发酵的前期(发酵第5 天)和中期(发酵第12 天),添加相同浓度纯化后的OTC 酶,以验证其与EC 形成的直接相关性。如图1所示,在发酵开始直至第12 天,试验组EC 含量均显著高于对照组,而在12 d 之后,试验组12D的EC 含量表现出明显的下降趋势,直至发酵结束。而在发酵前期添加OTC 酶的试验组5D 则显著提高了EC 含量,出现这一变化趋势的原因还有待进一步研究。总体而言,在恰当的发酵阶段,如发酵的中期,OTC 酶的添加对EC 形成确有抑制作用,然而若添加时间不合适,则有可能促进EC 的形成代谢。

图1 黄酒发酵中不同处理组氨基甲酸乙酯的变化规律Fig.1 Changes of EC in different treatment groups during rice wine fermentation
2.2 黄酒发酵中不同处理组尿素和瓜氨酸的变化规律研究
有文献表明,尿素和瓜氨酸是EC 形成最主要的2 种前体物。因此本试验全程监测了尿素和瓜氨酸的变化规律,如图2所示。对照组发酵液中的尿素低于所有试验组,这意味着胞内被利用形成氨基甲酸乙酯的尿素含量较高,从而刺激了EC的产生。这一变化规律与图1相符,也与前人报道一致[18]。

图2 黄酒发酵中不同处理组尿素和瓜氨酸的变化规律Fig.2 Changes of urea and citrulline in different treatment groups during rice wine fermentation
OTC 酶的添加显著影响了瓜氨酸的含量,故瓜氨酸的变化规律与尿素不同,在乳酸菌精氨酸脱亚胺酶的代谢途径中,OTC 酶可以降解底物瓜氨酸转化为鸟氨酸,因此试验组瓜氨酸明显低于对照组,尤以12D 组效果最佳。综上,试验组12D的尿素和瓜氨酸含量均低于对照组,前体物含量低,产生的EC 含量也随之降低,这与本研究中EC的变化趋势相符。
2.3 不同处理组OTC 酶活的变化趋势分析
由于试验组均人为添加了OTC 酶,虽偶有波动,但从整体趋势来看,试验组的OTC 比酶活均高于对照组,从理论上讲,OTC 比酶活越高,则瓜氨酸的降解量就更高,这与图2瓜氨酸的变化规律一致。
2.4 不同处理组对黄酒基础理化品质的影响
2.4.1 黄酒中游离氨基酸的含量分析 黄酒中富含多种氨基酸,被称为“液体蛋糕”。除了为人体提供各种必需氨基酸外,还是黄酒风味物质的重要组成部分,不同氨基酸口味不同,其含量差异会影响黄酒的口感及其风味[19]。本文共检测了17 种游离氨基酸含量,如图4所示。可以看出,黄酒中游离氨基酸脯氨酸和谷氨酸的含量较高,脯氨酸具有甘甜的口感,略带一丝苦味,而谷氨酸对黄酒鲜味的贡献较大。不同处理组样品的氨基酸含量差异不大,说明黄酒中氨游离基酸的组成及含量主要受发酵原料和麦曲中微生物的影响,而加入OTC 酶对整体影响并不显著。此外,相对而言,试验组12D 的氨基酸含量略高于5D,说明OTC 酶的添加时间中期优于早期。
2.4.2 黄酒中主要挥发性风味物质的含量差异分析 黄酒的风味成分非常丰富,包括醇类、酯类、酸类、醛类及羰基化合物等[20]。表1选取了几种具有代表性的醇酯类物质进行定性分析比较,以挥发性风味物质的总含量作为1,各成分含量为该成分与总含量的峰面积比值。当添加OTC 酶后,黄酒发酵产品中的主要风味物质组成如表1所示,其中苯乙醇和异戊醇的含量较高,苯乙醇具有清甜的玫瑰花香,是一种重要的风味物质。苯乙醇是由L-苯丙氨酸转化而来,主要通过酵母的氨基酸代谢或者糖类的合成[21]。从表中可以看出,对几种主要的醇类,试验组的相对含量均高于对照组,且试验组12D 具有更良好的风味特征。

图3 黄酒酿造中不同处理组OTC 酶活的变化规律Fig.3 Changes of OTC activity in different treatment groups during rice wine fermentation
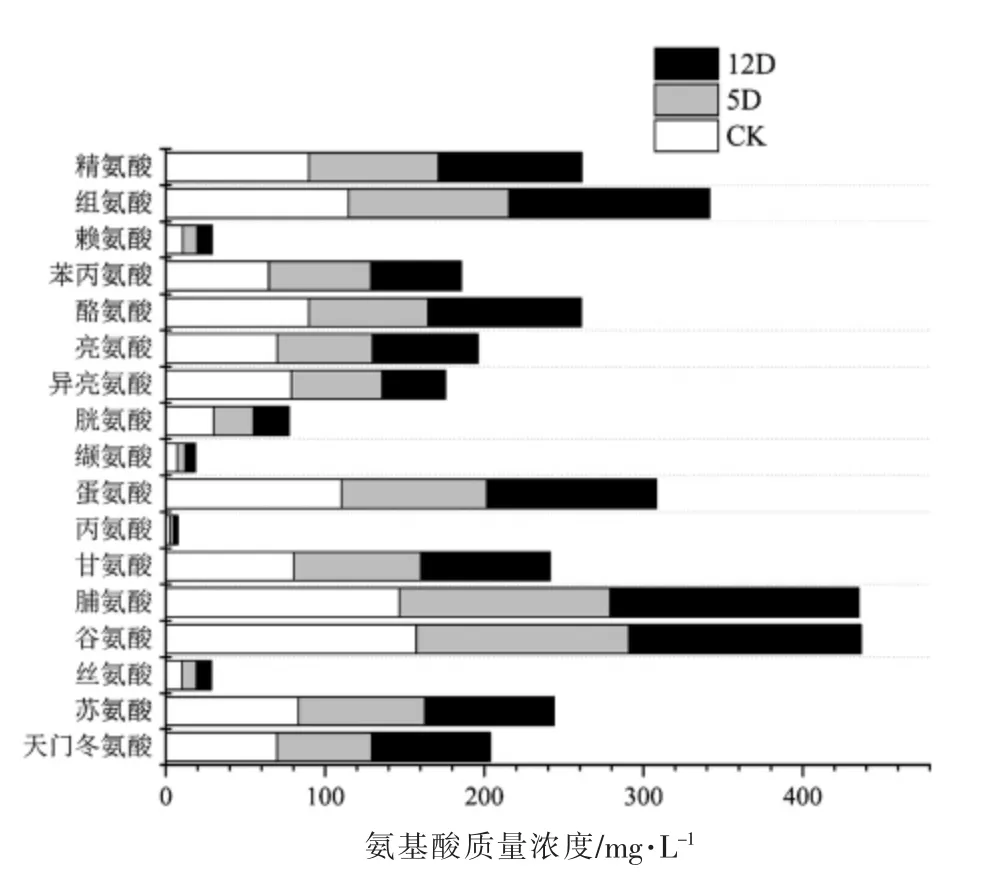
图4 黄酒酿造中不同处理组游离氨基酸的变化规律Fig.4 Changes of amino acids in different treatment groups during rice wine fermentation
乙酯类物质具有花香或果香,主要由酵母发酵产生,在黄酒发酵的风味物质中占据很大比例。试验组中酯类含量大体上均高于对照组,总体而言,试验组的挥发性风味物质无论是种类还是含量,相对于对照组均有所提高。可以推测,OTC 酶的加入对黄酒风味有一定的提升作用。
2.4.3 不同处理组的电子舌味觉分析 图5为电子舌传感器对3 个黄酒样品的原始数据雷达图,描述了酸、甜、苦、咸、鲜味和回味的相对测定值。可以看出,其中酸、甜、咸味略有差异,其它味觉差异并不明显。经过OTC 酶添加的试验组12D 的酸味及5D 的甜味均略高于对照组,且试验组咸味的口感均略高于对照,由此可见,OTC 酶的添加对黄酒的口感味觉有一定程度的提升,而总体差异并不显著。
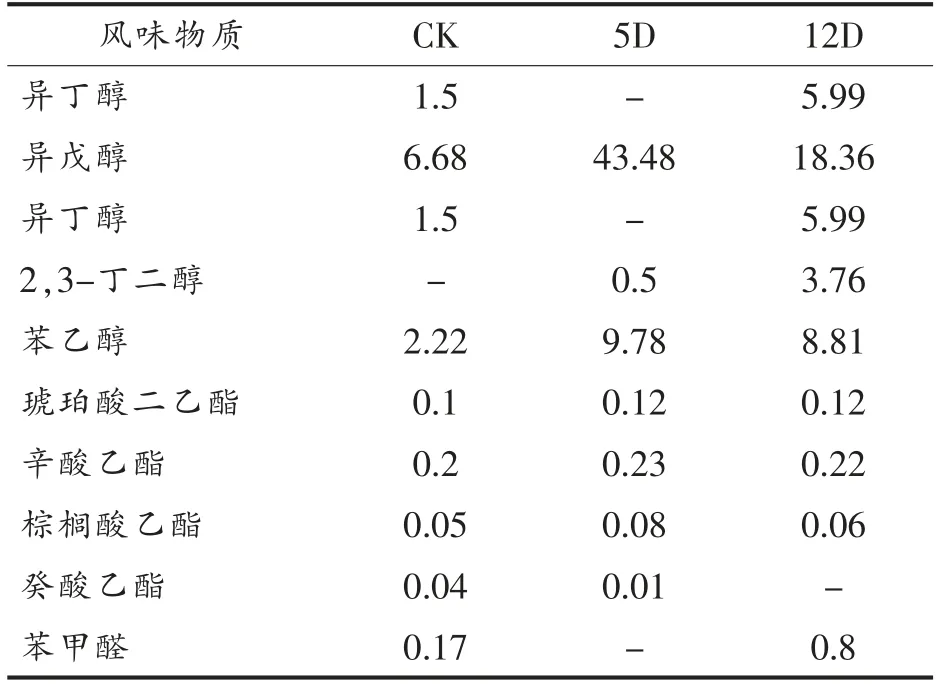
表1 不同处理组黄酒挥发性风味物质的变化规律Table 1 Changes of flavoring substances in different treatment groups during rice wine fermentation

图5 不同处理组味觉分析雷达图Fig.5 Radar taste analysis for different treatments
3 结论
黄酒作为我国传统的酿造饮品,因其风味独特且含有多种营养物质,具有广阔的市场。根据之前的研究发现,OTC 酶与EC 呈现负调控的相关性[11],本研究为验证这一结论,采用基因工程手段从短乳杆菌中克隆并大量表达OTC 酶,经Ni-NTA 纯化后添加到黄酒的不同发酵阶段。试验结果表明,在发酵中期添加OTC 酶能显著降低氨基甲酸乙酯的含量,且对主要前体物尿素和瓜氨酸均有影响,同时对黄酒样品的理化品质进行检测分析,发现氨基酸、挥发性风味物质及味觉差异不明显,说明鸟氨酸氨甲酰基转移酶的添加不影响产品质量,有可能应用于黄酒的实际酿造生产,降低致癌物质的含量,具有良好的潜在应用价值。
