肾胺酶基因多态性与血压钠钾反应性的相关性分析
2021-05-15胡桂霖张晓玉杜鸣飞周浩伟胡佳文廖月圆王科科牛泽家馨官永娟闫睿晨牟建军
汪 洋,孙 月,胡桂霖,邹 婷,张晓玉,杜鸣飞,周浩伟,贾 昊,王 丹,张 婕,陈 晨,胡佳文,马 琼,袁 悦,廖月圆,王科科,严 瑜,张 玺,牛泽家馨,官永娟,闫睿晨,高 可,李 敏,牟建军
(1. 西安交通大学第一附属医院心内科,陕西西安 710061;2. 西安市第四医院心内科,陕西西安 710004;3. 西安交通大学第一附属医院心外科,陕西西安 710061;4.西安交通大学第一附属医院风湿科,陕西西安 710061)
高血压因发病率高、伴发的血管疾病的风险日益增加,已成为全球主要的健康挑战[1-2]。高血压是由多种遗传因素和环境因素的相互作用的结果[3]。在环境因素中,高盐和低钾摄入是高血压重要的危险因素[4]。高盐和低钾摄入与血压升高有关[5-6]。然而,大量研究表明,高盐或钾摄入对血压的影响存在个体差异,这种血压对盐或钾敏感性的差异部分由于个体的遗传易感性所致[7-8]。因此,识别血压对钠钾反应性的基因变异可以加深人们对血压调节生理机制的理解,也有助于制定高血压的防治措施。
肾胺酶是一种主要由肾脏合成和分泌的黄素蛋白,能够代谢儿茶酚胺,调节机体血压[9]。近年来研究发现,肾胺酶基因的变异与高血压的发生关系密切。ZHAO等[10]研究发现,中国汉族人群中肾胺酶的编码基因是原发性高血压的一种新的易感基因,这种遗传变异可能影响血压水平。此外,也有研究报道,肾胺酶的基因多态性与血液透析患者、2型糖尿病患者的高血压有关[11-12]。然而,以上研究均未考虑基因和环境的相互作用,尤其是高盐或低钾对血压的影响,而这可能导致无法准确评估基因在血压变异中的作用。因此,本研究基于已建立的陕西“盐敏感高血压研究队列”,通过对研究人群进行钠钾饮食干预,探讨肾胺酶基因的遗传变异与血压钠钾反应性之间的相关性。
1 对象与方法
1.1 研究对象2003年10月-2004年10月,参照盐敏感性遗传流行病学协作研究(GenSalt研究)方案,对陕西省眉县多个农村汉族人群进行系统筛查,最终招募了来自126个家系的514名受试者建立陕西“盐敏感性高血压研究队列”。具体筛选标准已在本课题组既往的相关文献中详细报道[7,13-14]。
1.2 基线调查和饮食干预受试者进行3天基线调查,包括问卷调查、人体测量、血压测量及血尿标本收集。随后对334名非父母者进行为期3周的钠钾饮食干预:1周低盐饮食,每天摄盐3 g(相当于每日51.3 mmol钠),早餐无盐,午餐及晚餐各1.5 g;1周高盐饮食,每天摄盐18 g(相当于每日307.8 mmol钠),早餐3 g,午餐及晚餐各7.5 g;1周高盐补钾饮食:在高盐饮食的基础上再摄入60 mmol(4.5 g)氯化钾。具体干预操作流程参照本课题组既往研究[7,13-14]。
1.3 血压测量基线期和饮食干预期的第5、6、7天采用随机零点血压计(Hawksley&Sons,英国)进行血压测量,具体测量方法参照本课题组既往研究[7,15-16]。每一阶段进行3天血压测量,将9次血压的平均值纳入最后的统计分析。在本研究中,将血压对钠钾的反应性看作连续性变量,具体分为低盐期血压反应性、高盐期血压反应性、补钾期血压反应性。低盐期血压反应性=低盐期血压-基线期血压;高盐期血压反应性=高盐期血压-低盐期血压;补钾期血压反应性=高盐补钾期血压-高盐期血压。
1.4 血液生化分析清晨空腹静脉采4mL非抗凝血,离心机半径16 cm,3 000 r/min 离心15 min,分离血清标本于-80 ℃冷冻保存待测。采用Hitachi 7060全自动生化分析仪(日立,日本)进行生化指标检测,具体内容包括空腹血糖、三酰甘油、总胆固醇、高密度脂蛋白等。
1.5 单核苷酸多态性(SNP)位点的选择选择美国国家生物技术信息中心数据库(http://www.ncbi.nlm.nih.gov/projects/SNP)和基因组变异服务器数据库(http://gvs.gs.washington.edu/GVS147/),采用HaploView 4.2软件在中国北京汉族(CHB)和亚洲人群数据库中按照以下标准筛选肾胺酶基因中的标签SNP位点:符合Hardy-Weinberg平衡定律(P≥0.05),次要等位基因频率(minor allele frequency, MAF)P≥0.05,且r2≥0.8。最终纳入10个肾胺酶基因相关的SNP位点进行后续分析:rs10509540、rs7922058、rs999951、rs10887800、rs796945, rs1935582、rs7076491、rs2296545、rs2576178及rs17109290。
1.6 基因分型采集每个受试者外周静脉血,应用GoldMag-Mini纯化试剂盒纯化外周血脱氧核糖核酸(deoxyribonucleic acid, DNA)。对2004年DNA标本通过MassARRAY检测平台对肾胺酶基因多态性位点进行基因分型。所有基因分型实验均由北京博奥晶典生物技术有限公司进行。
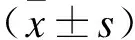
2结 果
2.1 受试者基线期的一般特征受试者平均年龄48.6岁,体质量指数22.2 kg/m2,收缩压115.2 mmHg,舒张压71.3 mmHg,平均动脉压86.0 mmHg。高血压患者共51人,占总人数的9.9%(表1)。

表1 受试者的一般特征
非正态分布计量资料:中位数(四分位数间距)。正态分布计量资料:均值±标准差。计数资料:个数(所占百分比)。高血压判定标准:收缩压≥140 mmHg和或舒张压≥90 mmHg,或目前正在使用降压药物治疗。
2.2 钠钾干预对受试者24 h尿钠和钾排泄的影响各阶段受试者尿钠钾排泄量如表2所示。24 h尿钠排泄量在低盐期较基线期明显降低,高盐负荷后明显升高,补钾能够明显升高24 h尿钾排泄量,这提示饮食干预依存性较好。
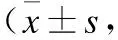
表2 各阶段受试者尿钠钾排泄量
2.3 受试者血压的钠钾反应性钠钾饮食干预时,各期血压均发生变化,其中低盐期血压较基线水平降低,高盐期血压水平回升,而高盐补钾饮食时,与高盐期相比,血压水平再次出现下降(表3)。
2.4 肾胺酶基因SNP位点基因型和等位基因频率的分布由于本研究以家系为基础,故选取181名父母亲受试者的基因型进行Hardy-Weinberg平衡检验。如表4所示,各SNP位点基因型分布频率均符合Hardy-Weinberg平衡定律,提示受试者所在群体是一个遗传平衡的群体。
2.5 肾胺酶基因多态性与血压钠钾反应性的关联分析
如表5所示,低盐期rs2576178位点与收缩压和平均动脉压反应性均呈相关性(收缩压:β=-2.730,P=0.005;平均动脉压:β=-1.718,P=0.028),rs17109290位点与舒张压反应性呈相关性(β=-1.608,P=0.031)。在高盐期及高盐补钾期,所有肾胺酶基因SNP位点与血压反应性均无相关性(P>0.05)。
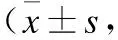
表3 各干预期血压反应性
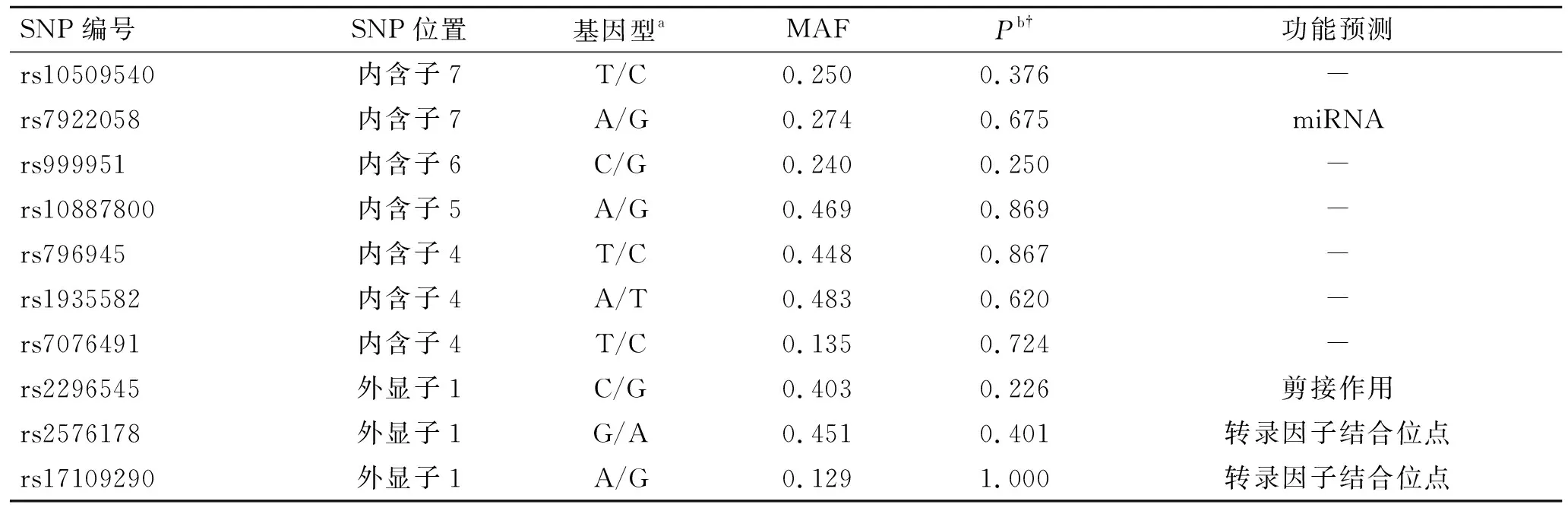
表4 肾胺酶基因各SNP位点的基本信息

表5 肾胺酶基因多态性与血压钠钾反应性的关联性
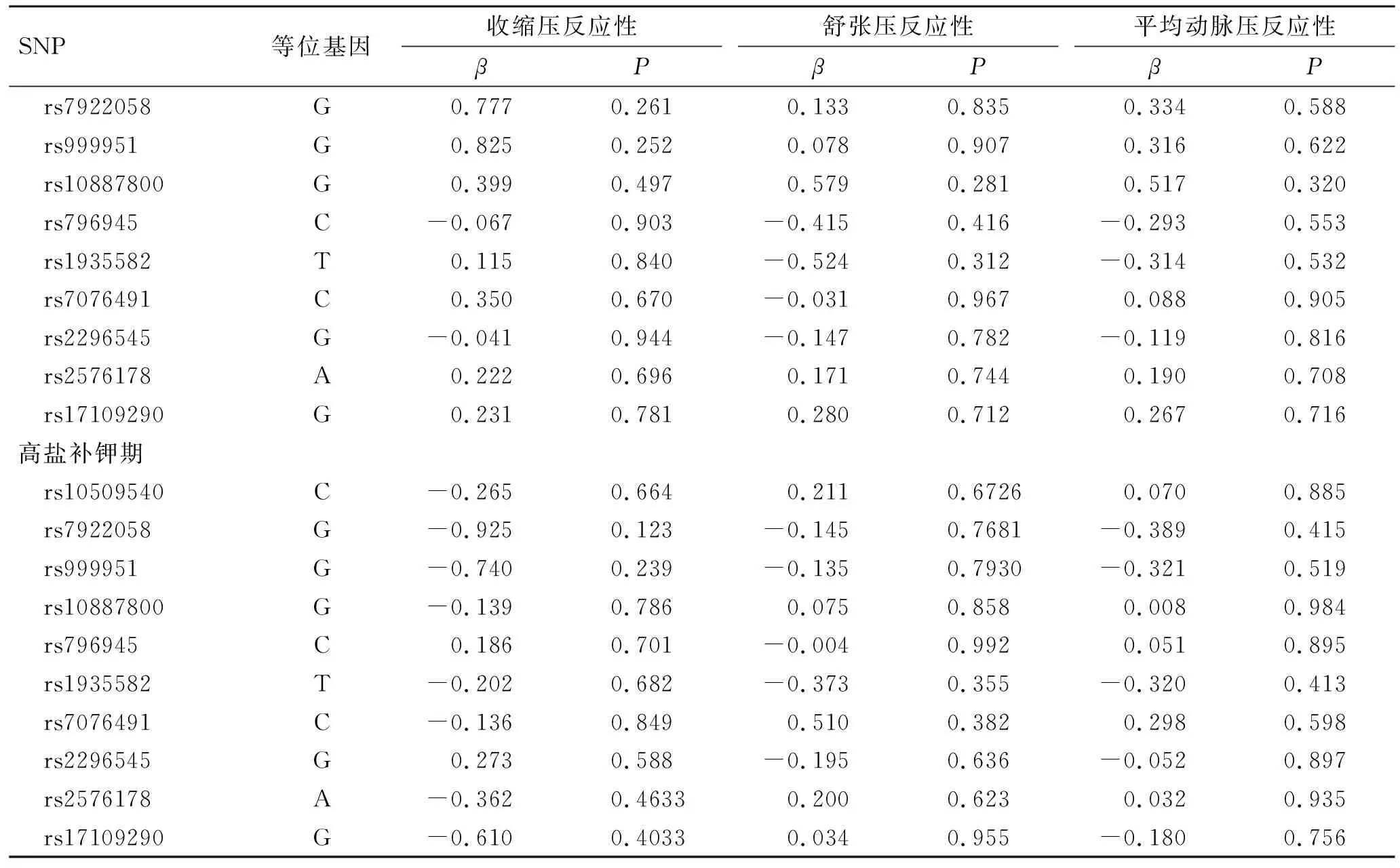
续表5
3 讨 论
肾胺酶基因位于10号染色体q23.33,由9个外显子共311 000对碱基构成,编码342个氨基酸,分子质量约为38 ku[17]。近期,有研究发现肾胺酶参与血压调节,并与高血压的发生关系密切,对肾脏5/6切除大鼠和脑卒中型高血压大鼠皮下注射重组肾胺酶可产生明显降压作用[18]。单纯皮下注射1.3 mg/kg肾胺酶与口服5 mg/kg依那普利24 h后产生同等降压作用[19]。一项纳入2 586名中国汉族人群的研究发现,肾胺酶基因的SNP位点rs2576178和rs2296545与原发性高血压密切相关。在调整多种混杂因素后,SNP位点与高血压的发生仍呈相关性(rs2576178 GG:OR=1.58;rs2296545 CC:OR=1.61)[10]。STEC等[12]报道,透析状态高血压患者肾胺酶基因SNP 位点rs2576178和rs10887800的G等位基因频率均与高血压相关(rs2576178:OR=1.55;rs10887800:OR=1.76)。然而,以上研究均未考虑基因和环境的相互作用,尤其是高盐或低钾对血压的影响,而这可能导致无法准确评估基因在血压变异中的作用。
血压具有遗传性,其中20%~50%的血压变异性可能由遗传因素所致[20]。既往研究表明,个体遗传背景可能与盐介导的血压反应性有关[7-8,21]。另外,GHOSH等[22]发现高盐摄入可调控肾胺酶表达,他们给予Dahl盐敏感(SS)大鼠8%高盐饮食干预3周,发现循环和肾脏组织肾胺酶水平明显降低,4周后几乎无法检测。DESIR等[23]也证实了上述结果。本课题组也发现,SS大鼠与SS-13BN大鼠肾脏肾胺酶的表达在高盐饮食4周时明显下降,且这一趋势在SS大鼠中更为明显[24]。上述研究表明,肾胺酶可能参与血压的盐敏感性的形成。本研究通过对陕西“盐敏感性高血压研究队列”进行慢性盐负荷及补钾干预,首次发现肾胺酶基因多态性位点rs2576178与收缩压反应性、平均动脉压低盐期反应性呈相关性。上述结果提示,肾胺酶基因可能参与血压盐敏感性的形成。
流行病学结果显示,钾摄入与血压呈负相关。临床实验报道,补钾可降低高血压和血压正常个体的血压水平,且补钾的降压效应可能存在个体差异性[25-26]。GenSalt研究表明,在遗传背景相似的中国汉族人群中,补钾的血压反应仍不同,提示人群存在血压的“钾敏感性”[8,25-26]。有研究发现,遗传变异与补钾的血压反应性相关。ZHAO等[25]报道汉族人群APLN和ACE2基因变异与补钾的血压反应有关;此外,也有研究发现,中国农村人群血管内皮通路包括内皮素1(EDN1)、一氧化氮合酶3(NOS3)、E选择素(SELE)等关键基因的多态性与补钾血压反应性有关[26]。本研究首次探讨肾胺酶基因多态性与补钾的血压反应性的关系,结果并未发现两者之间存在相关性。
综上所述,本研究通过对陕西“盐敏感性高血压研究队列”进行钠钾饮食干预,发现肾胺酶基因多态性与血压钠反应性相关,这有助于从遗传角度进一步理解盐敏感性高血压的形成机制并为其防治工作提供新思路。然而,本研究样本量相对偏少,且局限于中国北方汉族人群,因此,研究结论尚需在其他大样本人群中进一步加以验证。
