哺乳动物m6A与生长发育相关生物学功能研究进展
2021-05-14薛翔澜丁洋洋刘悦李晓波蒋琳何晓红马月辉赵倩君
薛翔澜 丁洋洋 刘悦 李晓波 蒋琳 何晓红 马月辉 赵倩君
(1. 中国农业科学院北京畜牧兽医研究所,北京 100193;2. 云南农业大学动物科学技术学院,昆明 650000)
RNA修饰方式众多,普遍存在于真核生物中,目前已发现100多种修饰方式,这些修饰对RNA功能和遗传信息多样性等方面起到重要作用。mRNA的主要修饰方式包括N1-甲基腺嘌呤(N1-methyladenosine,m1A)、5-甲基胞嘧啶(5-methylcytosine,m5C)、N6-甲基腺嘌呤(N6-methyladenosine,m6A)、N7-甲基鸟嘌呤(N7-methylguanosine,m7G)和假尿嘧啶(pseudouridine)等。其中m6A作为真核信使RNA(Messenger RNA,mRNAs)中最丰富的修饰,在许多生物过程中发挥重要作用。此外,m6A在转运RNA(transfer RNA,tRNA)、核糖体RNA(ribosome RNA、rRNA)中也具有一定的作用,具有多种生物调节功能。多项研究表明,m6A参与RNA的剪接、转录、加工、出核转运、翻译、降解,对胚胎发育、脂肪生成、肌肉发育和疾病等生物学过程具有重要作用[1-2]。
20世纪中期,在细菌DNA研究过程中首次发现m6A,20世纪60年代通过RNA大肠杆菌实验首次分离出m6A,并在细菌、小鼠、兔子、小麦、病毒等中相继检测出m6A[3-6]。20世纪70年代科研人员利用发现的真核生物Poly(A)结构研究RNA甲基化在癌细胞中的情况显示,碱基和核糖中均存在甲基化,且甲基化程度均较高[7]。20世纪90年代,研究发现m6A的碱基修饰参与调控细胞周期,后因缺乏对mRNA上单个m6A修饰位点的鉴定方法,m6A少有研究。近年,随着高通量测序技术的发展,使m6A修饰位点的鉴定得以实现[8],m6A重新进入科学家们的视野中,m6A甲基化修饰调控及生物学作用成为新的遗传学研究热点。多位研究人员通过高通量测序等技术鉴定人和小鼠等生物全基因组水平m6A甲基化调控位点,并联合其他组学数据及通过功能验证揭示m6A修饰对基因表达及生物学过程的调控机制(图 1)[9]。
1 m6A甲基化修饰酶及研究方法
1.1 m6A甲基化修饰酶
m6A 甲基化作为普遍存在于真核细胞生物的信使 RNA(messenger RNA,mRNA)转录后修饰[11],在多数真核生物中具有高度保守性。通常m6A 修饰包含在共有序列5′-RRACU-3′(R=A或G)中,并且主要结合位点在翻译终止密码子附近蛋白质编码区(sequence coding for aminoacids in protein,CDS)及 3′UTR 端[12]。m6A 作为碱基 A 第六位 N 原子上以活性腺苷胺酸为甲基供体发生的RNA 甲基化修饰,其mRNA 修饰的过程复杂多样,主要是通过甲基转移酶复合体(METTL14,METTL3 和WTAP组成)、去甲基酶(ALKBH5和FTO)和RNA结合蛋白(YTH家族)共同合作修饰[13-15]。
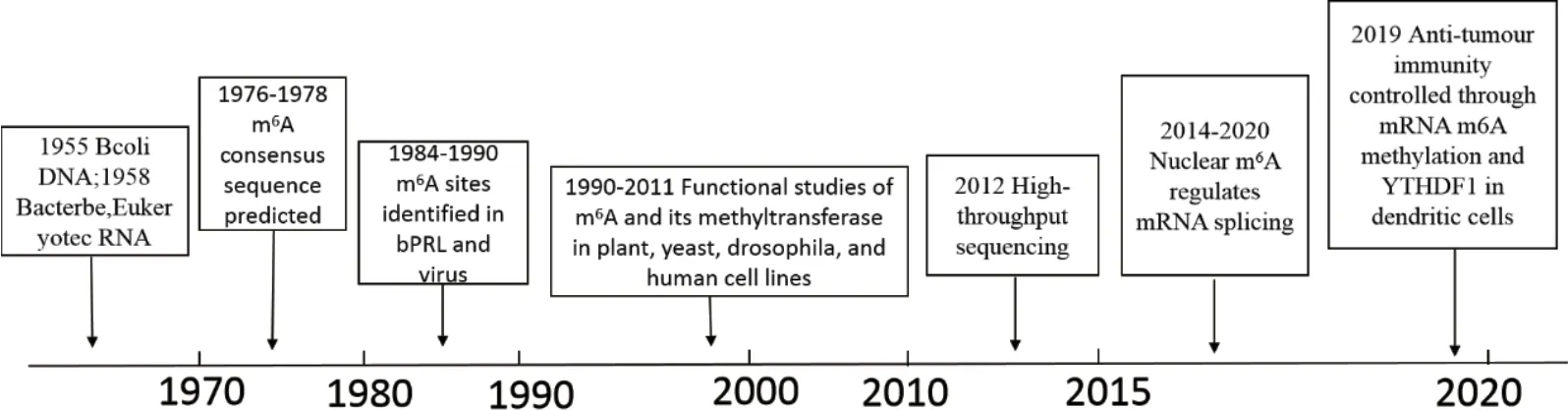
图1 mRNA m6A甲基化修饰主要研究进程[10]Fig.1 Main research process of m6A methylation modification across mRNA
Writers(书写器)作为m6A甲基转移酶,催化RNA中腺苷酸上m6A甲基化修饰,促使m6A甲基化基团写入RNA。甲基转移酶主要包括甲基转移酶样3(methyltransferase like 3,METTL3)、甲基转移酶样 14(methyltransferase like 14,METTL14)、Wilms肿瘤抑制因子-1-相关蛋白(wilms tumor 1-associating protein,WTAP)和 KIAA1492[16-17]。甲基化修饰蛋白间会形成复合物共同行使催化功能,METTL3 和METTL14之间形成复合物,其中METTL3具有催化活性的亚基,而METTL14在底物识别上具有重要作用,作为m6A甲基转移酶多蛋白复合物的主要催化成分,两者缺失可导致m6A几乎完全缺失。也有学者对METTL14作为甲基化酶提出不同的观点,研究发现METTL14没有结合S-腺苷甲硫氨酸(S adenosyl L methionine,SAM)的结构域,不能单独行使m6A甲基化酶的功能,其只能通过与METTL3结合影响m6A水平[18]。WTAP引导和定位METTL3-METTL14复合物进入核斑点,从而有效甲基化目标RNA[17],敲除 WTAP 导致 METTL3和 METTL14的降解并显著降低了m6A的水平[12]。小鼠胚胎成纤维细胞检测甲基化位点的结果显示多数甲基化位点依赖于WTAP 修饰,证明WTAP是mRNA m6A甲基化必不可少的甲基转移酶[19]。
Erasers(擦除器)又称m6A去甲基酶,主要对RNA中的m6A甲基化基团进行去甲基化修饰,包含肥胖相关蛋白(fat mass and obesity associated,FTO)、Alk B同 源 蛋 白 5(alk B homolog5,ALKBH5)以及其他同源基因[20]。FTO和ALKBH5均属于FeII/α-KG依赖性双加氧酶ALKB家族,2007年3个独立实验室分别证实当FTO基因产生突变时会增加肥胖风险[21-23]。FTO可在体外与单链DNA(single-stranded DNA,ssDNA)和单链 RNA(single-stranded RNA,ssRNA)中多个去甲基酶活生理底物结合氧化脱甲基[24]。
Readers(阅读器)编码基因被称为识别蛋白,识别蛋白会与 RNA上的m6A甲基化位点结合进而执行各种生物学功能[25]。主要包括YTH家族(YTHDF1、YTHDF2、YTHDF3、YTHDC1 和 YTHDC2)[26-27]、eIF3、hnRNPC 和 hnRNP A2/B1[28-29]以 及其 他 同源性基因。已有研究对YTH结构域家族蛋白进行定位发现,YTHDFs型蛋白主要存在于识细胞质中,而YTHDCs型蛋白则主要在细胞核内发挥作用[27,30-31]。研究发现 YTHDF1和 YTHDF3蛋白参与调控mRNA的翻译效率,同时YTHDC1蛋白对编码和非编码基因的转录均有调控作用。
甲基转移酶和去甲基化酶主要作用于基因表达修饰,去甲基化酶的存在进一步证实了m6A甲基化修饰RNA与DNA表观遗传修饰一样也具有动态可逆的修饰过程。该机制可由甲基转移酶复合物MTTL3-METTL14-WTAP建立且对腺苷酸进行修饰,同时又可被FTO、ALKBH5这类去除酶移除(图2)。
1.2 m6A检测方法
常见甲基化位点检测方法包括:比色法[32]、高通量测序法MeRIP-Seq(methylated RNA immunoprecipitation sequencing) 又 称 为 m6A-Seq(m6A-specific methylated RNA immunoprecipitation sequencing)[33-34]、三重四级杆质谱联用技术(HPLC-LC/MS/MS)[35]、紫外交联免疫共沉淀技术,具体包括光交联辅助m6A测序技术(photo-crosslinking-assisted m6A sequencing strategy,PA-m6A-Seq)、m6A碱基分辨率交联共沉淀技术(m6A individual-nucleotide-resolution cross-linking and immunoprecipitation,m6A-miCLIP,或 称 为 UV-CLIP) 和 m6A-LAIC-Seq[36]、m6A-REFSeq(表 1)。
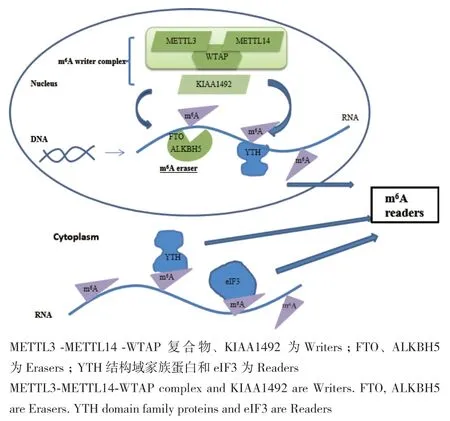
图2 m6A甲基化的调节过程Fig.2 The regulation process of the m6A
早期受实验规模的限制,针对N6-甲基腺苷的研究主要利用在mRNA中m6A出现在特定序列GAC(70%)或AAC(30%)[37-38]中这一特点,采用同位素标记法[39-41]、薄层色谱[42]对 m6A 进行定位检测。随着二代测序技术和质谱等技术的发展,研究发现高效液相色谱可提高定量m6A的精确性并监测其动态状态[13],抗体免疫印迹方法(dot-blot)同样可以精确检测m6A的含量。此外,基于免疫沉淀法识别N6-甲基腺苷位点的MeRIP-Seq高通量测序技术陆续被应用[43]。
2019年两个研究团队同年利用MazF酶对m6A修饰的特异性识别特点,分别开发新型m6A位点鉴定方法:m6A-REF-seq法和MAZTER-seq法。这两种方法原理基本一致,不仅可以从头检测m6A位点,对甲基化进行定量,还可以对亚细胞、不同类型细胞等的m6A进行定量。骆观正研究团队的m6A-REF-seq方法侧重研究m6A修饰位点定性的准确性,而Schwartz团队的MAZTER-seq推动m6A研究进入定量领域[44-45]。

表1 m6A甲基化检测手段Table 1 Detection method of m6A methylation
2 m6A与动物生长发育
2.1 胚胎发育
2014年Batista等[47]发现核心多能性转录因子的RNA在小鼠和人类胚胎干细胞(embryonic stem cells,ESCs)中具有m6A修饰,Xiao等[48]利用MeRIP-Seq测序方法首次绘制了人类胎儿组织的m6A图谱,同时发现m6A位点存在大量已知人类表达定量性状基因座(expression quantitative trait loci,eQTL)和单核苷酸多态性(single nucleotide polymorphisms,SNP),推测这些SNP参与调控m6A修饰。不同组织lincRNA的m6A修饰分析发现增强子RNA(enhancer RNAs,e-lincRNA)区域m6A显著富集,结果表明m6A可能与增强子RNA功能有关;并发现METTL3在高CpG基因的转录起始区富集,这暗示m6A可能通过共转录的方式,直接调控相应基因的表观状态和转录。该研究揭示m6A在人类组织发育和稳态调控中的潜在功能。m6A对胚胎干细胞的多能性和分化具有重要影响,在ESCs中m6A可影响mRNA代谢、维持细胞自我更新并调控胚胎细胞分化[49]。为探究m6A对小鼠胚胎发育的影响,研究敲除成骨细胞和原始态胚胎干细胞中的METTL3,结果显示胚胎整体m6A甲基化水平降低,缺乏METTL3的这些细胞能够存活,但无法完全终结原始态多能性[50]。在小鼠ESC中敲低METTL3和METTL14抑制多能性基因SOX2,NANOG和DPPA3的表达,并促进了小鼠ESC中发育调节因子FGF5,CDX2和 SOX17的表达[16]。多项研究表明小鼠ESCs中m6A 对干细胞分化节律具有调控作用,它保证了多能性因子下调的准确性和及时性,为细胞分化和ESCs谱系成熟提供保障。
小鼠体内识别蛋白YTHDF2的耗竭会导致胚胎发育后期死亡,结合体内和体外比对YTHDF2缺失的小鼠胚胎和正常小鼠胚胎,在YTHDF2缺失的小鼠胚胎中神经干细胞(NSPCs)的增殖和分化能力明显下降,且神经元不能产生正常功能的神经突,研究证明YTHDF2参与mRNA降解最终调节神经发育[51]。在小鼠睾丸中,使用Vasa -Cre系介导敲除小鼠早期生殖细胞中METTL3或METTL14基因,结果显示敲除小鼠随着年龄的增长,二倍体精原干细胞(spermatogonial stem cells,SSC)逐渐减少[52],Xu等[53]敲除雄性小鼠中METTL3,在生殖细胞中METTL3失活抑制精原细胞分化、阻碍减数分裂,m6A对哺乳动物精子发生与繁殖中具有调控作用。
2.2 m6A与脂肪生成
m6A作为RNA主要修饰方式,不同m6A甲基化修饰在脂肪生成中具有不同调控作用。m6A甲基化基因糖基磷脂酰肌醇高密度脂蛋白结合蛋白1(glycosylphosphatidylinositol anchored high density lipoprotein binding protein 1,GPIHBPI)基因作为脂蛋白脂酶(Lipoprotein Lipase,LPL)的载体及重要调控因子,GPIHPI在脂肪组织中转录水平较高,能够与LPL基因结合形成脂解平台并参与毛细血管内皮细胞中LPL 基因转运。高脂饮食试验中对正常饮食和高脂饮食(high-fat diet,HFD)诱导的小鼠肝脏进行MeRIP-seq分析,发现HFD肝脏中上调甲基化的编码基因主要富集于脂代谢相关的过程,从而调节肝脏脂质代谢[54]。Zhao等[55]对脂肪含量差异显著的长白猪和金华猪背部脂肪组织m6A 甲基化进行分析发现,长白猪脂肪组织中m6A含量显著高于金华猪,过表达YTHDF1增加PNPLA2表达并促进脂肪生成,其中PNPLA2(Patatin-like phospholipase domain containing 2)是促进脂肪生成特异性表达基因[56]。在脂肪细胞中进行同义突变(synonymous mutations,MUT)以降低差异解偶联蛋白 2(uncouplingprotein 2,UCP2)和PNPLA2 mRNA的m6A水平。成脂试验及m6A检测表明m6A负调控UCP2蛋白表达,正调控PNPLA2蛋白表达。通过过表达YTHDF1和YTHDF2检测相关基因变化,证实m6A修饰可通过YTHDF1影响PNPLA2的翻译,而m6A修饰UCP2途径尚未得知。研究显示YTHDF2也参与脂肪生成调控;在前体脂肪细胞中,YTHDF2通过靶向识别、捕获由m6A去甲基化酶沉默导致具有较高m6A修饰水平的Atg5和Atg7转录本并使其降解,进而抑制脂肪生成。同时发现在小鼠的脂肪组织中特异性敲除FTO导致白色脂肪沉积显著降低及靶向因子Atg5和Atg7表达下降,从而证实FTO抑制脂肪生成[57]。
m6A对骨骼间充质干细胞具有特异性调控功能,敲低骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)中METTL3会导致骨形成受损,成骨分化潜能不足以及骨髓脂肪增多[58]。高脂饮食孕鼠后代mRNA m6A水平显著上调,脂肪含量下调,METTL3表达量显著上调,这表明母体摄入高脂可以以组织特异性和发育依赖性的方式影响后代mRNA m6A修饰及其相关基因的表达,进而调控脂肪生成,并为m6A系统从母体营养向后代食物的传播提供可行性[59]。在敲低小鼠胰岛B细胞METTL14(βKO)研究中发现,HFD的βKO孕鼠新生胎儿脂肪生成减少,肝脏脂肪分解增加,敲低METTL14减少HFD喂养导致代偿性胰岛素B细胞增加,糖尿病风险上升[60]。
2.3 m6A参与肌肉发育
肌肉是动物机体重要的组成部分,其生长发育过程受多种转录因子调控和表观遗传调控等。近期多项研究表明m6A参与骨骼肌成肌分化、心肌重塑、再生等。METTL3在骨骼肌肌肉分化中具有正向调控作用,同时METTL3 能维持成肌细胞中MyoD mRNA稳定。在肌源干细胞中MyoD表达量受到m6A 修饰调节,敲低METTL3导致MyoD 特异性下调[61]。通过m6A 测序分析显示:在成肌细胞增殖过程中METTL3 通过位于MyoD的5′UTR的m6A修饰来调节MyoD的表达。过表达METTL3可提高m6A甲基化水平以促进成肌细胞成肌分化,通过外源甲基化抑制剂环亮氨酸(cycloleucine,Cyc)和甲基供体甜菜碱(betaine,Bet)研究m6A甲基化对小鼠成肌分化的调节作用发现,METTL3和Bet正向调控m6A甲基化水平,而Cyc负调控m6A甲基化水平,推测m6A甲基化正调控成肌分化[62]。受孕小鼠高脂摄入影响其雄性后代小鼠骨骼肌m6A修饰,进而调控肌肉生长,对不同周龄小鼠后代胫骨前肌中m6A表达水平检测,结果显示m6A表达量先升高后降低,同时检测不同时期肌肉中FTO表达量,进一步说明肌肉中m6A表达量干扰受孕小鼠肌肉生长[59]。Wang等[63]通过研究FTO对小鼠骨骼肌肌肉分化的影响,首次证明FTO参与调控肌源性干细胞分化。
Mathiyalagan等[64]研究了常氧和低氧状态下体外心肌细胞中FTO表达量与心肌收缩功能的关系,表明FTO在体外减缓缺氧诱导的心肌细胞功能障碍,且证实在小鼠体内过表达FTO导致RNA m6A下调可改善心衰诱导的心功能障碍,FTO在未来的心衰竭治疗中具有潜在的作用。多个研究通过构建不同小鼠心脏模型(功能完好和功能缺失)评估m6A METTL3途径在心脏稳态和功能方面的作用,结果显示过表达METTL3会诱发心肌肥大,同时METTL3介导的m6A 甲基化对心力衰竭等具有拮抗作用[65-66]。m6A修饰RNA同样存在于血管平滑肌细胞(vascular smooth muscle cell,VSMC)增殖分化过程中,m6A修饰蛋白通过调控相关基因表达进而影响VSMC 的增殖。对三七总皂苷(total panax notoginseng saponin,TPNS)抑制内膜增生并抑制肌肉损伤后VSMC的增殖研究发现,TPNS通过促进WTAP的表达,可负调控VSMC的活力从而影响其增殖能力[3,67]。脂肪干细胞(adipose-derived stem cell,ADSC)可分化为平滑肌细胞,在诱导ADSC诱导分化成血管平滑肌的过程中METTL3表达量上调,低氧应激介导METTL3的表达可促进ADSC分化为 VMSC[67]。
3 展望
目前,对m6A的研究在人和模式动物相关RNA表观遗传学调控功能探究水平上已取得了一定的进展,但对m6A修饰与哺乳动物生长发育调控机制的研究刚刚起步,未来仍然有许多科学问题亟待探究。除了目前已鉴定的哺乳动物m6A相关修饰酶外,是否还有其它m6A的甲基化酶、去甲基化酶和识别蛋白参与m6A修饰,其对于mRNA表达及蛋白翻译又有何调控作用。关于m6A功能的研究大多通过对甲基化酶和去甲基化酶修饰完成,但是参与m6A下游区域功能调控酶有哪些,且这些酶是仅仅作用于RNA上的m6A修饰,还是存在其它修饰底物,我们不得而知。此外,对m6A受何种调控知之甚少,非编码RNA、DNA甲基化等如何影响m6A修饰有待进一步研究。未来,随着研究的不断深入及m6A甲基化检测技术的不断完善,综合应用基因组学、蛋白组学、生物信息学、基因编辑等多层次技术手段,相信对m6A在胚胎发育、细胞分化、生长发育、疾病发生发展等方面的功能及调控机制会有更为系统深入的了解。
