果蝇肠道干细胞及肠道菌群的研究进展
2021-05-14金秋霞王思宏金丽华
金秋霞 王思宏 金丽华
(1. 东北林业大学生命科学学院,哈尔滨 150040;2. 延边大学分析测试中心,延吉 133002)
肠道上皮对内部和外部环境做出应答,通过免疫反应、肠道菌群和干细胞的增殖及分化来调节肠道稳态[1]。黑腹果蝇(Drosophila melanogaster)的肠道干细胞形态、功能及信号通路与哺乳动物类似。另外,果蝇肠道内聚集着一定数量的共生菌群[2],与人类的肠道菌群和结构具有较高的保守性。因此,果蝇可以作为研究宿主与菌群相互作用的重要模型[3]。果蝇基因组和共生菌群遗传模型已广泛应用于宿主与微生物之间复杂关系的研究[4]。本文将介绍和讨论果蝇肠道干细胞增殖与分化机制,以及共生菌群对肠道稳态的影响,旨为揭示人类肠道相关疾病的发生和治疗奠定理论基础。
1 果蝇肠道上皮细胞种类
动物肠道上皮不仅是消化和吸收的场所,也是机体防御外来入侵物的第一道屏障[5]。肠道干细胞通过增殖和分化维持肠道上皮细胞稳态,此过程失衡将导致肠道炎症或肠道肿瘤的发生。肠上皮暴露于动态且复杂的病原体中,宿主与微生物的相互作用能够影响宿主免疫系统的发育、消化和营养吸收等。模式生物果蝇肠道上皮细胞的更新机制与哺乳动物小肠细胞高度相似,信号传导途径也具有一定的保守性[6]。
果蝇中肠是一个由特殊细胞组成的动态器官,分为5个不同形态和功能区域(R1-R5)。每个区域均由多功能肠道干细胞(intestinal stem cells,ISCs)、成肠细胞(enteroblasts,EBs)、肠内分泌细胞(enteroendocrine cells,EEs)、肠上皮细胞(enterocytes,ECs)和内脏肌肉(visceral muscles,VMs)组成(图1)。ISCs主要位于中后肠,并在整个成虫阶段不断增殖从而完成自我更新,同时也能分化为EBs。另外,EBs继续可以分化为 ECs或 EEs[7-8];但研究发现,EEs也可以通过ISCs分化产生的EE祖细胞(EEP)形成[9-10]。
前体细胞(ISCs&EBs)特异性表达Snail/Slug家族的转录因子 escargot(esg)[11]。ISCs表达 Notch途径配体Delta,并能激活相邻EBs细胞Notch的胞内结构域,使Su(H)进核诱导下游靶基因的表达。ECs特异性表达Myosin1A和Pdm1[12],并感知外界信号刺激,在病原体感染时发挥主要的免疫防御作用。少量且零散的EEs细胞分泌转录因子prospero(pros)、神经肽TK及DH31等,EEs细胞主要介导器官和器官间的信号传递,通过分泌多种神经内分泌肽远距离调节代谢和肠蠕动等多种重要的生理过程[13]。研究表明,由EEs分泌的slit是ISCs中Robo2的配体,对EEs自身的分化具有重要的调节作用[14];转录因子esg也会通过抑制pros调控EEs细胞选择性地分化[15];另外,发现EBs表达的转录因子Klumpfuss同样抑制EEs细胞的形成[16]。内脏肌肉(VMs)通过胃肠系统协调营养物质和废物的运输,促进蠕动的同时可以分泌信号因子调节肠内稳态[17]。
2 果蝇肠道干细胞增殖与分化相关信号通路
肠道内含有大量的多能性干细胞,可修复肠道受损以保持其功能完整性。通过对果蝇肠道干细胞的增殖与分化信号转导途径的深入研究,发现Hippo、JNK、Notch等信号通路对肠道干细胞的增殖及分化起着重要的调控作用[18]。另外,研究表明,炎症与老化等应激胁迫条件会促进肠道干细胞增殖及分化[19-20]
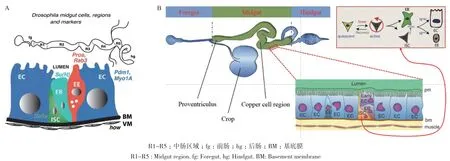
图1 成虫果蝇中肠细胞类型(A)及果蝇肠道干细胞增殖与分化(B)[9-10]Fig.1 Adult Drosophila midgut cell types (A) and proliferation and differentiation of Drosophila intestinal stem cells(B)
在果蝇中,经典Hippo信号传导途径的核心激 酶 包 括 Hippo、Warts(Wts)、Salvador(Sav) 和Mob肿瘤抑制因子(Mats),Wts与Mats相互作用可触发Yorkie(Yki)磷酸化,进而和下游转录因子Scalloped(Sd)形成的Yki-Sd复合物,不仅可以抑制下游信号转录,还会通过促进核内Unpaired表达,诱导免疫应答[21]。研究发现,Sd结合蛋白可以抑制由Hippo信号缺失引起ISCs过度增殖现象[22]。另外,非经典Hippo信号传导途径,其核心激酶Wts能够以一种独立于经典转录复合物Yki-Sd的方式与转录因子Lola相互作用,通过细胞自主性和非细胞自主性方式同时调控ISC增殖[23]。c-Jun氨基末端激酶(JNK)作为果蝇应激反应的主要调节途径,是丝裂原活化蛋白激酶(MAPK)家族之一。该通路在受到刺激后通过蛋白激酶的级联反应引起细胞应答,促进EGFR配体的表达[24],通过激酶磷酸化级联反应激活MAP kinase kinase 4和Hemipterous,引起basket活化,从而促进ISCs增殖和再生,补充受损细胞[25-26]。
Notch信号通路进化上高度保守,由受体、配体及胞内效应分子组成。果蝇中单通道跨膜受体蛋白Notch有膜蛋白Delta和Serrate两种配体[27],通过细胞间直接接触触发配体与受体的胞外结构域结合,酶切形成Notch的胞内域(NICD)进入细胞核,激活相关基因表达,从而调控细胞分化[28]。果蝇肠道中Notch通路的激活促使ISCs-EBs-ECs分化,从而降低了ISCs的数量;相反,抑制该通路会使ISCs和EEs增多,形成ISCs或EEs肿瘤。Wg/Wnt信号通路以蛋白分子扩散与受体结合的方式完成信号传递,在干细胞中的配体Wingless(Wg)与位于细胞表面的受体Frizzled结合,与下游基因Dishevelled和Armadillo控制自身增殖,但不参与后续分化[29];由VMs和EBs旁分泌的Wg也起着同样重要的作用。不同于Wg/Wnt信号,Jak/Stat信号参与ISCs分化调节过程。ECs在应激条件下会释放细胞因子(Upd、Upd2、Upd3), 激 活 ISCs中 Jak/Stat信 号, 促 进细胞分裂,从而维持ISCs的自我更新;高水平的Jak/Stat则会促进干细胞向ECs分化[30]。果蝇肠道稳态是多种信号通路共同调控的结果,其更加具体而复杂的调控网络仍需要进一步深入探究。
3 肠道菌群
肠道上皮细胞与肠道菌群之间存在相互作用以维持肠道稳态。肠道菌群是一种内分泌型器官,是与宿主共同进化形成的极为复杂的微生态系统。菌群对机体产生免疫刺激,使宿主形成免疫屏障,维持机体自身免疫系统的生长发育[31]。肠道菌群既可以介导宿主的营养信号网络,从而调节营养分配模式;又可以通过补充营养物质和消耗饮食成分改变机体营养输入[32]。肠道菌群通过糖、脂质以及氨基酸等物质的代谢来调节免疫系统的发育和复杂的行为,并且通过肠-脑轴、肠-肝脏轴等来影响人类的情绪、心理健康和行为等[33]。肠道菌群失调可导致肠道通透性增加,引起肠漏,进一步导致细菌移位产生炎症[34],促进肠道疾病甚至肠道肿瘤的发生[35]。但是,目前关于肠道微生物群如何影响宿主行为、肠道内稳态及内部所涉及的分子和细胞调节机制还不清楚。
果蝇作为共生微生物群遗传模型已被广泛应用于肠道菌群的研究中[4]。果蝇生活在富含微生物的环境,为了确保其存活,已经开发了一系列防御机制,尤其肠道免疫反应在响应和消除潜在病原体的同时耐受肠道微生物群和饮食微生物的存在。
果蝇肠道菌群可以通过改变肠道内环境,调节宿主基因表达,影响干细胞命运。无菌条件培养的果蝇中肠道干细胞有丝分裂指数较低,表明菌群刺激干细胞增殖更新[36]。肠道菌群通过诱导压力和耐受机制改变肠道生理环境(通过改变pH和消化酶含量)来保证果蝇肠道上皮更新及干细胞活性[37]。另外,通过菌群与肠道干细胞之间的相互作用,影响果蝇老化及寿命。成虫期的核心菌群组成相对稳定,但在老化过程中,许多与增殖分化相关的基因表达上调,菌群刺激上皮细胞的基础更新水平,使ISCs大量增殖,并激活EGFR等信号通路,进而引起肠道内细菌负荷急剧增加。因此,肠道菌群失衡将诱发肠道屏障功能紊乱[38-39]。研究发现,免疫缺陷(Imd)途径是应对肠道感染的关键组成部分,该过程产生的抗菌肽和NADPH氧化酶Duox产生的活性氧(ROS)形成了肠道中两种互补的防御机制[40]。Imd途径中肽聚糖识别蛋白PGRP-SD突变引起植物乳杆菌(Lactobacillus plantarum,Lp)过度生长,Lp分泌的乳酸也随之增加导致肠道酸化,刺激ROS产生,诱发机体早衰[41]。但果蝇在生命早期阶段接触低剂量的氧化剂可以重塑菌群,改善老化病征进而延长寿命[42]。菌群失衡也会刺激肿瘤生长,其中,JNK信号活性水平对维持上皮屏障功能和宿主-微生物平衡起重要调节作用[43]。另外,果蝇组蛋白去甲基化酶KDM5通过调控先天免疫通路影响肠道屏障和菌群组成,经肠-脑轴改变果蝇社会行为,并靶向干预肠道菌群可在一定能程度上改善果蝇的社会行为异常现象[44];果蝇肠道微生物中的短乳杆菌能够产生负调控章鱼胺(昆虫中的奖赏信号)信号途径的木糖异构酶,进而抑制果蝇的运动能力[45]。
细菌通过产生小分子代谢物向大脑发送信号影响动物的行为来调节饮食行为[46],同时进食也会直接影响肠道菌群的组成,长期则会改变菌群的定植[47]。高脂饮食能引起肠道菌群组成发生变化、肠道屏障功能受损,进而引起慢性炎症反应或肠道干细胞的异常增殖引发肿瘤性病变[48]。研究发现,连续喂食8周高脂食物的母鼠后代出现社交行为缺陷,幼鼠肠道的罗伊氏乳杆菌含量明显减少,表明肠道微生物群衍生的信号分子影响了肠道内稳态[49]。而果蝇中的高脂饮食通过JNK和Jak/Stat途径激活ECs中的细胞因子表达,完全依赖于细菌数量调控,间接诱导干细胞活性增加[50]。
肠上皮细胞与微生物及其代谢物的相互作用是肠上皮与其他细胞类型之间相互作用的关键介质。研究发现,在肠道内转运并促进脂肪吸收的胆汁酸[51]这类肠道菌群的代谢产物可以调控机体代谢及免疫反应。果蝇肠道中的细菌能够产生一种短链脂肪酸-醋酸盐,醋酸盐对果蝇自身的脂肪代谢和胰岛素信号传导至关重要。细菌来源的尿嘧啶会调节肠道内活性氧(ROS)水平[52],说明肠道微生物可以通过与先天性免疫协同作用影响体内代谢过程。EE细胞分泌与脂质代谢和能量稳态相关的肽,这些肽可以被微生物代谢物(如短链脂肪酸,SCFA)激活,完成微生物与宿主免疫系统之间的信号交流[53]。
4 总结与展望
肠道微生态系统是与机体健康息息相关的微生态系统,一方面,细菌本身依赖于宿主体内环境及摄入的食物养分;另一方面,细菌希望宿主具有群居性,这样有利于繁衍多样性的后代。果蝇肠道已然成为研究消化道疾病的重要模型[54-55],果蝇因其遗传和生理上操作的简便性及自身相对简单的微生物群为研究宿主-微生物提供了良好的系统。然而,肠道上皮细胞对微生物的响应复杂且多样,针对肠道干细胞与菌群之间的研究仍有许多问题有待解决。首先,果蝇肠道内的微生物群结构没有哺乳动物复杂,微生物对宿主的影响是否具有特异性,仍有必要深入研究。其次,操纵菌群的手段尚不明确,相关的信号传递通路尚不清晰,肠道菌群是如何建立和维持长期肠道定植尚不清楚。总而言之,免疫系统与菌群的研究仍旧处于探索阶段,利用果蝇研究共生菌与宿主的相互关系及作用机制可以为人类代谢性疾病以肠道菌群为靶点的治疗提供新思路。
