黄芩多糖的提取及其抗氧化和抗肿瘤活性研究
2021-05-14李平胡建燃史宝忠赵晶磊
李平 胡建燃 史宝忠 赵晶磊
(长治学院生物科学与技术系,长治 046011)
黄芩是我国传统的道地药材,在临床上已有2 000多年的应用历史,最早记载于《神农本草经》,又名山茶根、黄金茶,是唇形科草本植物黄芩(Scutellaria baicalensis Georgi)的干燥根。黄芩产于我国山西、内蒙古、河北、陕西、山东和黑龙江等地,以根入药,能够泻火解毒,清热燥湿,安胎止血[1],临床上主治胸闷呕吐,上呼吸道感染、湿热黄胆、肺热咳嗽、目赤等症[2]。《全国中成药产品目录》的统计结果显示,70%的中成药都含有黄芩成分。黄芩含有黄酮类化合物、萜类化合物、多糖、挥发油等化学成分[1-2],目前国内外对黄芩黄酮的相关研究报道很多,而对黄芩多糖(S. baicalensis polysaccharides,SBP)生物活性得研究报道比较少,其中对于SBP的抗肿瘤活性尚未见详细报道。
植物多糖是重要的生物大分子,参与多种生命活动,具有多种药理活性,如抗肿瘤、抗病毒、抗氧化、降血糖及抗衰老等,是近年来国内外的研究热点。对于SBP的研究起步较晚,主要是关于SBP提取的研究,而对其活性和功能研究较少。张文等[3]用 85%的乙醇加热回流提取SBP,苯酚-硫酸法测定多糖含量,测得SBP含量为 5.388%,平均回收率为98.8%。梁英等[4]用水作提取试剂,应用二次回归正交旋转组合设计对SBP提取进行工艺优化,得出在最优条件下,SBP提取率是 4.92%。张道广等[5]考察了SBP对猪生殖和呼吸系统综合征病毒在传代细胞系 MARC-145细胞中增殖的影响,研究结果显示SBP具有细胞水平抑制病毒增殖的作用。何雯娟等[6]研究发现,SBP对肉仔鸡法氏囊指数有显著影响,能够显著提高肉仔鸡免疫球蛋白水平。李国峰等[7]研究了SBP的体内抗氧化活性,发现SBP能使衰老模型小鼠脑、肝中的丙二醛(malondialdehyde,MDA)不同程度下降;超氧化物歧化酶(superoxide dismutase,SOD)和还原型谷胱甘肽(reduced glutathione,GSH)不同程度升高。但是,目前尚未有文献报道SBP对肿瘤的作用。
本研究利用水提醇沉法、微波提取法及超声波提取法对SBP进行了提取,比较3种方法的提取率。考察了SBP对超氧阴离子自由基和羟基自由基的清除能力,以及总抗氧化能力,系统地研究SBP的体外抗氧化能力。此外,还检测了SBP对胃癌细胞MGC80-3的抑制能力,并进一步探讨了潜在的分子机制,以期为SBP的综合开发利用提供理论依据,也为抗氧化保健品和抗肿瘤新药的开发提供参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 本实验所用中药黄芩购自长治市昂生大药房。胃癌细胞系 MGC80-3 购自武汉博士德生物工程有限公司。RPMI-1640细胞培养基和胎牛血清均购自美国Thermo Fisher Scientific公司。3-(4,5-二甲基 -2-噻唑基)-2,5-二苯基四氮唑溴化 物(3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)、Trolox试 剂、ECL显色试剂盒和BCA蛋白浓度测定试剂盒购自北京索来宝生物科技有限公司。二甲基亚砜(dimethyl sulfoxide,DMSO)和2,6-二叔丁基对甲酚(2,6-Ditert-butyl-4-methylphenol,BHT)购自美国 Sigma公司。兔抗IKK β抗体和兔抗caspase3抗体购自Abcam公司,鼠抗Akt抗体购自Santa Cruz公司,兔抗LC3 A/B抗体、兔抗IκB α抗体和兔抗p-IκB α抗体购自Cell signaling Technology公司,兔抗GAPDH抗体购自北京博奥森生物技术有限公司。羟自由基测试盒、超氧阴离子自由基测试盒和总抗氧化能力测试盒均购自南京建成生物工程研究所。其余所用试剂,如无水乙醇、无水甲醇、乙醚、3,5-二硝基水杨酸、苯酚和硫酸等均为国产分析纯。实验用水为双蒸水。
1.1.2 仪器与设备 RE-5ZAA旋转蒸发器(上海压荣生化仪器厂);FDV超细粉碎机(北京兴时利和科技发展有限公司);BSA 124S-CW 电子天平(赛多利斯科学仪器(北京)有限公司);P70F23P-G5(SO)微波炉(广东格兰仕微波生活电器制造有限公司);5805 台式高速离心机(北京博瑞祥腾科技有限公司);DFY-300 高速万能粉碎机(上海新诺仪器设备有限公司);CO2培养箱(美国热电公司);MAPADA P4紫外可见分光光度计(上海美谱达仪器有限公司);多功能酶标仪SpectraMax M2(美谷分子仪器(上海)有限公司);倒置显微镜CKX41-C31BF(日本Olympus公司);KQ-250 医用超声波清洗器(昆山市超声仪器有限公司);细胞计数仪Cellometer Auto1000(美国Nexcelom公司);蛋白电泳系统和ChemiDoc MP成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 黄芩粗多糖的提取
1.2.1.1 水提醇沉法 参照文献[8]的方法,并进行适当改良。称取粉碎的黄芩粉末 5 g,加入石油醚,加热回流提取2 h,除去脂溶性成分。滤渣挥干溶剂,加入100 mL的蒸馏水,煮沸 2.5 h 后,过滤并收集滤液。将滤渣重复煮沸 2 次,合并滤液,调节pH至6.5,然后4 000 r/min离心10 min,取上清液。在上清液中加3倍体积的无水乙醇,在 4℃冰箱静置过夜,离心收集沉淀,依次用80%乙醇和丙酮进行洗涤、干燥,即得黄芩粗多糖。
1.2.1.2 微波提取法 参照文献[8]的方法,并进行适当改良。称取粉碎的黄芩粉末 5 g,加入石油醚,加热回流提取2 h,除去脂溶性成分。滤渣挥干溶剂,加入100 mL的蒸馏水,将其置于微波炉700 W功率下,加热 20 min,冷却后,后续步骤同1.2.1.1,即得黄芩粗多糖。
1.2.1.3 超声波提取法 参照文献[8]的方法,并进行适当改良。称取粉碎的黄芩粉末 5 g,加入石油醚,加热回流提取2 h,除去脂溶性成分。滤渣挥干溶剂,加入100 mL的蒸馏水,超声提取2 h,后续步骤同1.2.1.1,即得黄芩粗多糖。
1.2.2 SBP的精制
1.2.2.1 除蛋白 参照文献[8],利用Sevag法进行蛋白脱除。取黄芩粗多糖,加水溶解后,加入多糖水溶液25%体积的 Sevag试剂(氯仿∶水饱和正丁醇=4∶1的混合液),充分混合,剧烈震荡 30 min,然后4 500 r/min 离心 10 min,收集水相,重复7-9次。
1.2.2.2 除去小分子和离子 参照文献[8],将上述除蛋白后的溶液放入透析袋(8 000-14 000)中,用蒸馏水流动透析24 h,加入3 倍体积的无水乙醇,4℃静置过夜,4 000 r/min离心10 min,收集沉淀,洗涤,干燥后即为精制SBP,于4℃冰箱中保存备用。
1.2.3 SBP含量的测定 用适量蒸馏水将精制的SBP溶解后,配制成0.2 mg/mL的多糖储备液。利用苯酚-硫酸法[9-10]测定其多糖的含量,并进而计算出多糖提取率。
1.2.4 SBP的体外抗氧化活性检测 参照文献[11]的方法,检测多糖样品的羟自由基清除能力、超氧阴离子自由基清除能力及总抗氧化能力,按照试剂盒说明书进行操作,每个样品设置3个重复。
1.2.4.1 多糖的羟自由基清除能力检测 将精制的SBP用蒸馏水稀释成0.125、0.25、0.5、1.0、2.0和5.0 mg/mL系列浓度,并配制同样浓度梯度的水溶性维生素E(Trolox)作为阳性对照,按试剂盒说明书的步骤进行检测。羟自由基清除率计算公式:
清除率%=(OD对照组-OD测定组)/OD对照组×100%
根据不同浓度的多糖溶液对羟自由基的清除率,通过拟合计算清除率为50%时的 样 品浓度,即为EC50值,样品的EC50值越小,其清除羟自由基能力就越强。
1.2.4.2 多糖的超氧阴离子清除能力检测 将精制的SBP用蒸馏水稀释成0.125、0.25、0.5、1.0、2.0和5.0 mg/mL系列浓度,并配制同样浓度梯度的水溶性维生素 E(Trolox)作为阳性对照,按试剂盒说明书的步骤进行测定,在 550 nm 波长处测定吸光值,并计算超氧阴离子自由基清除率,公式同 1.2.4.1。
根据不同浓度的多糖溶液对超氧阴离子自由基的清除率,通过拟合计算清除率为50%时的样品浓度,即为该样品对超氧阴离子自由基清除能力的EC50值。
1.2.4.3 多糖的总抗氧化能力(T-AOC)测定 配制 5.0 mg/mL 的SBP溶液,取0.1 mL多糖溶液,根据试剂盒说明书进行总抗氧化能力(total antioxidant capacity,T-AOC)测定。以Trolox为阳性对照,测定 520 nm 处的吸光值。定义:在37℃时,每分钟每毫克SBP,使反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位。计算公式如下:
T-AOC(U/mg)=(OD测定组-OD对照组)×Vs/(Vt×△OD×T×Mt)
式中:Vs 为反应体积3.7 mL;Vt 为参与反应的多糖样品或阳性对照样品体积0.1 mL;ΔOD 为吸光值单位增加值 0.01;T 为反应时间 30 min;Mt为样品浓度(5 mg/mL)。
1.2.5 SBP抗肿瘤活性研究
1.2.5.1 细胞的培养 参照文献[12]的方法,将胃癌细胞MGC80-3采用含10%胎牛血清的RPMI-1640培养基进行培养,置于含5% CO2的培养箱中,培养温度为37℃,待其汇合率达到约80%时,用胰酶-EDTA消化液将细胞消化下来,进行传代培养。
1.2.5.2 MTT实验 参照文献[12]的方法,细胞计数后,按照约5 000个细胞/孔的密度接种到96孔板中,每孔加入200 μL,进行培养,待细胞完全贴壁后,分别加入不同浓度的SBP溶液处理细胞,多糖溶液终浓度为2.5、1.25和0.625 mg/mL。同时设置对照组,每组设3个复孔,置于 5% CO2、37℃ 培养箱中培养24 h和 48 h。培养结束后,弃去培养基,并加入新鲜培养基,添加1 /10体积的5 mg /mL MTT溶液,继续孵育4 h后,然后倒掉培养基,加入150 μL DMSO,振荡15 min,待蓝色物质完全溶解后,测定OD570值,并计算抑制率,抑制率计算公式如下:
细胞生长抑制率%=(OD对照组-OD测定组)/OD对照组×100%
1.2.5.3 Western blot实验 将MGC80-3细胞接种于Φ35 mm培养皿中,用不同浓度的SBP处理细胞48 h后,收集细胞,用冰预冷的PBS溶液洗涤,加入适量含蛋白酶抑制剂和磷酸酶抑制剂的RIPA细胞裂解液,置于冰上孵育30 min,在4℃下12 000 r/min离心15 min,收集上清液,利用BCA法检测蛋白质浓度。然后,经SDS-PAGE电泳、转膜、一抗(见1.1.1部分)4℃过夜孵育、二抗(HRP标记的鼠二抗或兔二抗)常温孵育1 h及PBS-T溶液漂洗后,利用ECL试剂盒显色,在成像系统下进行拍照。
1.2.6 数据分析 利用Graphpad 5.0软件对实验数据进行t检验。实验数据均以平均值±标准差(± s)表示。
2 结果
2.1 SBP提取方法的确定
称取等量的黄芩粉末,通过水提醇沉法、微波提取法和超声波提取法分别提取SBP,然后通过苯酚-硫酸法测定多糖含量,计算出各自的提取率。微波提取法的提取率最高,达到(7.26±0.33)%,其次是超声波提取法,提取率为(5.27±0.37)%,而水提醇沉法提取率最低,为(3.20±0.21)%。因此,在多种提取方法,通过微波提取法提取效率最高,可以得到最多的SBP。
2.2 SBP的体外抗氧化活性
2.2.1 SBP的羟自由基清除能力 分别将SBP和阳性对照 Trolox 稀释成一系列浓度梯度后,检测其羟自由基清除活性。结果如图1所示,SBP对羟自由基的清除能力随着样品浓度的增加而增大,呈现出明显的量效关系。当多糖浓度 5.0 mg/mL 时,对羟自由基的清除率达到 91.30%。根据各个浓度下清除率数据,计算SBP对羟自由基清除能力的EC50值是1.298 mg/mL,Trolox 的 EC50值为 1.90 mg/mL,高于SBP的EC50值。EC50值越高,则样品的羟自由基清除能力越弱。表明SBP具有较好的羟自由基清除能力,而且在相同浓度下,其清除率显著高于阳性对照Trolox,开发前景很好。
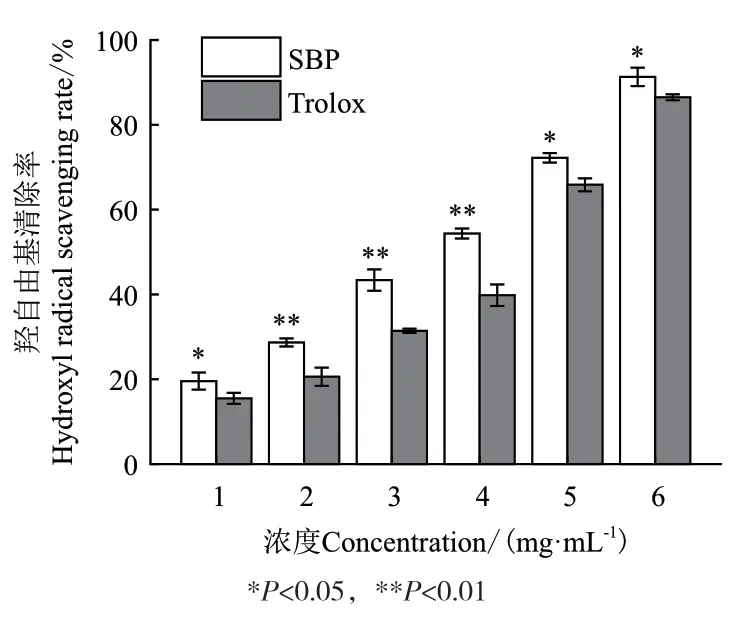
图1 SBP的羟自由基清除能力检测Fig.1 Hydroxyl radical scavenging capacity of SBP
2.2.2 SBP的超氧阴自由基清除能力 分别将SBP和阳性对照 Trolox 稀释成一系列浓度梯度后,检测其超氧阴离子自由基清除活性。结果如图2所示,SBP和 Trolox的超氧阴离子清除效能力仍然与其浓度呈明显的剂量依赖效应,但是与 Trolox 相比,SBP的清除作用相对较低。当样品浓度为 5.0 mg/mL 时,SBP的超氧阴离子清除率达到43.06%。研究结果表明SBP具有一定的超氧阴离子清除能力,在相同浓度下,其清除能力弱于Trolox。
2.2.3 SBP的总抗氧化(T-AOC)能力 将精制的SBP配制成5 mg/mL的溶液,检测其总抗氧化能力,结果如图3所示。SBP的总抗氧化能力为(3.27±0.14)U/mg,阳性对照 Trolox的总抗氧化能力为(3.64±0.21)U/mg。结果表明,二者无显著差异(P = 0.064),即表明SBP与 Trolox 具有相当的总抗氧化能力,结合其羟自由基和超氧阴离子自由基的清除效果,提示SBP具有开发为天然抗氧化剂的潜力。
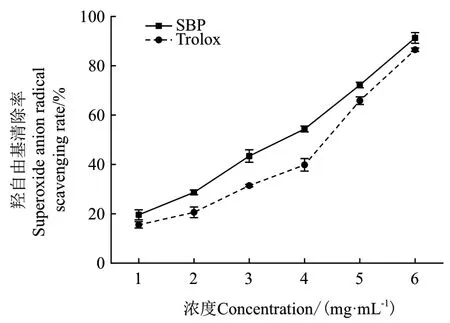
图2 SBP的超氧阴离子清除能力检测Fig.2 Superoxide anion radical scavenging capacity of SBP
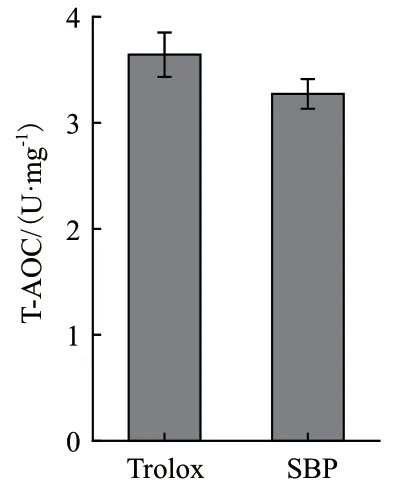
图3 SBP总抗氧化能力检测Fig.3 T-AOC detection of SBP
2.3 SBP的抗肿瘤活性
2.3.1 SBP对胃癌细胞MGC80-3增殖的影响 利用不同浓度的SBP处理胃癌细胞MGC80-3,通过MTT实验检测抑制率。结果如图4所示,当SBP终浓度从 0.16 mg/mL 增大至2.50 mg/mL 时,对 MGC80-3细胞的抑制率逐渐升高,其中处理24 h时,抑制率从7.07%升高至60.93%,处理48 h时,抑制率从48.54%升高至89.63%,在相同浓度下,处理48 h后的抑制率明显高于处理24 h的抑制率(P<0.01)。经计算,IC50分别为1.214 mg/mL和0.174 mg/mL。表明SBP对MGC80-3细胞的抑制作用具有剂量和时间依赖性。
2.3.2 SBP对胃癌细胞MGC80-3形态的影响 SBP对MGC80-3细胞形态的影响结果如图5所示,对照组细胞形态饱满,生长紧密。用SBP分别处理24 h和48 h后,细胞数量明显减少,细胞收缩,变为球形,随着多糖浓度升高,越来越多的细胞膜结构出现破坏,细胞间隙间中出现细胞碎片。而且处理时间越长,细胞表面褶皱程度越高。
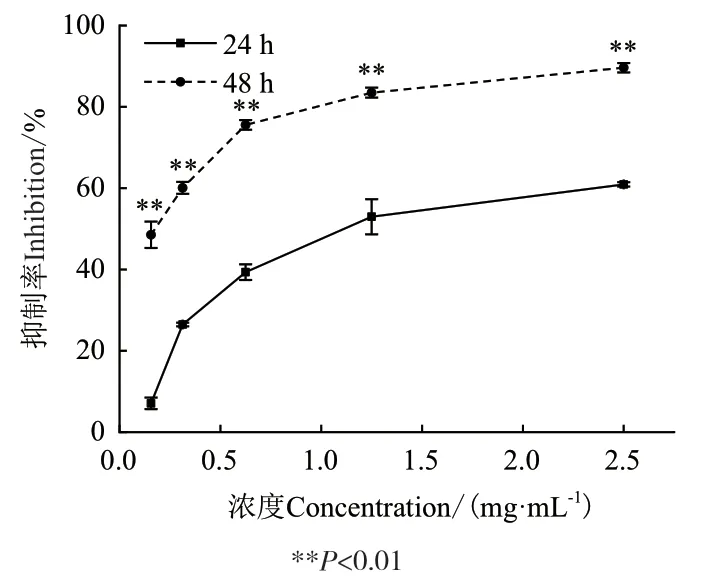
图4 SBP对MGC80-3细胞增殖的抑制作用Fig4 Inhibitory effects of SBP on the cell proliferation of MGC80-3 cells
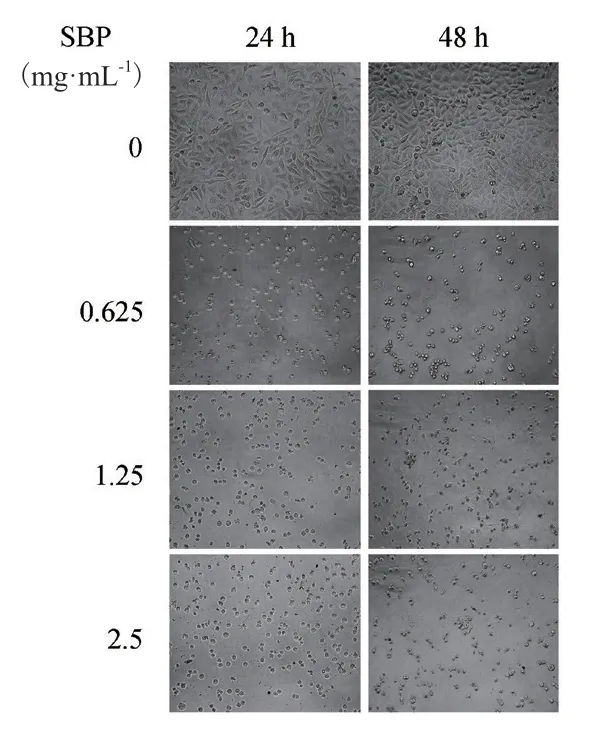
图5 SBP对MGC80-3细胞形态的影响Fig.5 Effects of SBP on the morphology of MGC80-3 cells
2.3.3 SBP抑制MGC80-3细胞增殖的分子机制探讨 为进一步揭示SBP抑制MGC80-3细胞增殖的分子机制,以GAPDH为内参,通过Western blot检测相关蛋白的表达和活性(图6)。通过对蛋白条带的灰度进行分析,如图7和图8所示,IKK β和procaspase3均随SBP浓度升高而表达增强。此外,LC3 B和LC3 A以及cleave-caspase 3和pro-caspase 3比值也与SBP浓度呈正相关,表明SBP既可能触发MGC80-3细胞自噬,同时也可能诱导其凋亡。此外,值得注意的是,在低浓度SBP(0.156 mg/mL)处理细胞时,Akt的表达以及p-IκB α水平显著提高,但是随着SBP浓度升高,二者水平则出现明显下调,表明低浓度SBP能诱导Akt和p-IκB α水平升高,但高浓度对二者可能产生抑制作用。
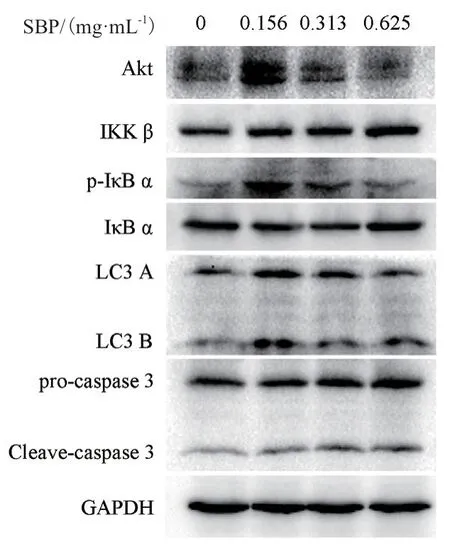
图6 Western blot实验Fig.6 Western blot assay
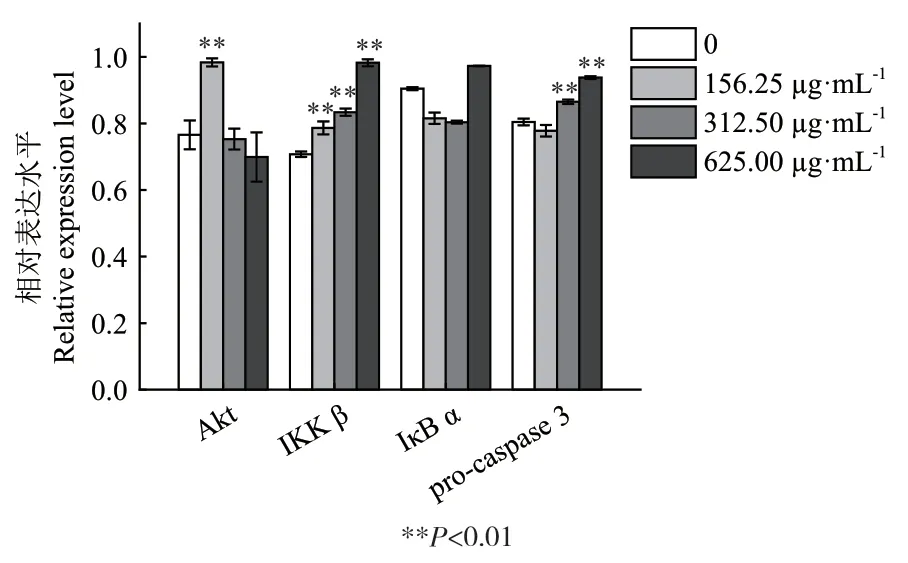
图7 相关蛋白质表达水平分析Fig.7 Expression level analysis of associated proteins
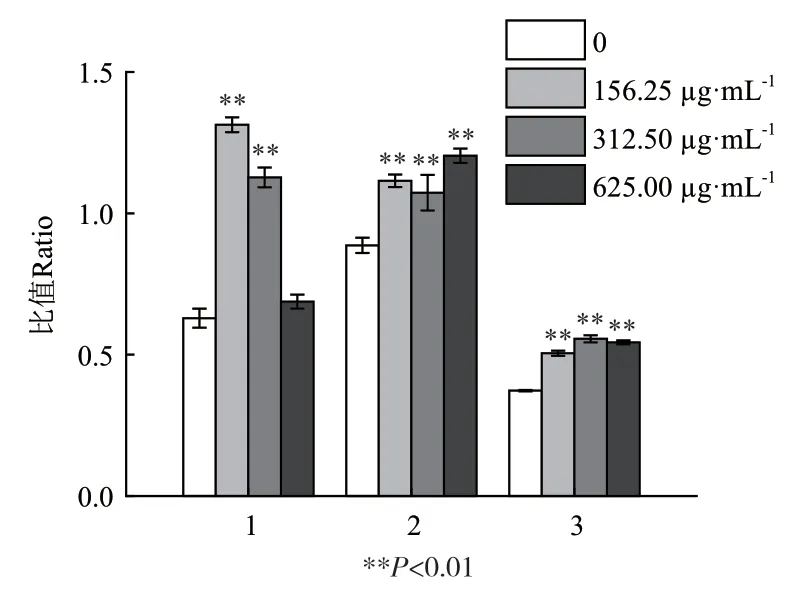
图8 相关蛋白活性形式含量分析Fig.8 Content analysis of active forms of associated proteins
3 讨论
黄芩是多年生草本植物,以根部入药,耐寒冷,喜温和气候。黄芩是山西省的道地药材,品质优良,野生黄芩资源在全省各地都有分布,人工种植面积也居于全国前列[13]。多糖是黄芩的重要组成部分,但是目前针对黄芩多糖的研究相对较少,还处于初步阶段。植物多糖的提取方法常有水提醇沉法、微波提取法、超声波提取法等,本研究比较了这些提取方法的RGP提取率,其中微波提取法最高,达到7.26%,为进一步的提取工艺优化奠定基础。此外,本研究进一步除去粗多糖中的蛋白成分和小分子,得到精制的SBP,然后分析其抗肿瘤活性和抗氧化能力。
目前对黄芩药理活性成分研究较多的是黄酮类化合物,包括黄芩素、黄芩苷、汉黄芩苷等。Wang等[14]研究发现黄芩苷-锌复合物有较低的细胞毒性和较高的抗HIV-1活性,并能有效抑制 HIV- 1进入宿主细胞。苏宁等[15]研究发现黄芩苷能提高糖尿病肾病大鼠肾组织中的SOD和GSH-PX 活性,延缓糖尿病肾病的发展进程。此外,研究表明黄芩苷对人黑色素瘤 A375 细胞[16]、胃癌细胞 SGC-7972[17]、S180实体瘤细胞[18]等多种肿瘤有抑制作用。
体内产生的过量氧自由基,可使 DNA 损伤,导致细胞膜的降解,从而引起细胞的破坏和机体组织的损伤,成为衰老及多种疾病,如癌症、心血管疾病、糖尿病及风湿性关节炎等的共同诱因。适当补充抗氧化剂,能促使体内自由基水平达到的平衡。近年来,安全低毒的天然抗氧化剂的开发备受关注。大量研究表明,多种中药的多糖成分具有良好的抗氧化效果。张全才等[19]在体外实验中证实山楂多糖对超氧自由基、羟自由基和DPPH自由基均具有一定的清除能力;蔡惠钿等[20]发现无花果多糖在2 500 μg/mL时对超氧阴离子和羟基自由基的清除率分别达到75%和38%,而在1 000 μg/mL时还原能力最强;许春平等[21]则发现枸杞多糖在经过羧甲基化修饰后,其清除羟自由基和DPPH自由基的能力显著增强;史娟等[9]证实白花蛇舌草多糖对DPPH自由基具有良好的清除作用,而pH值、温度、光照和金属离子对其上述作用都有一定程度的影响。目前,有少量针对SBP抗氧化能力的报道,如金迪等[22]发现其自制的SBP还原力较低,但是对DPPH和超氧阴离子的清除能力强于维生素C;另外,刘梦杰等[23]证实SBP能显著提高小鼠血清、肝脏、脾脏和肾脏中GSH-Px和SOD活性,显著降低其中MDA水平。本研究结果显示,与抗氧化剂Trolox相比较,SBP对羟自由基的清除能力较强,对超氧阴离子自由基的清除能力相对弱于Trolox,而其总抗氧化能力(T-AOC)与Trolox相当,表明本研究所获得的SBP具有较为理想的抗氧化能力,与上述文献报道一致。
在抗肿瘤方面,诱导细胞凋亡是中药抗肿瘤活性成分的主要作用途径。例如,Qiu等[24]发现从中药天麻中获得并修饰的多糖化合物WSS25能够通过靶向BMP2蛋白及其受体,阻断BMP/SMAD/ID1信号通路,在体内诱导肝癌细胞凋亡。Li等[25]认为黄精多糖能够调控Bak、Cytc、Puma和caspases-3、-7、-9等多个凋亡相关基因的表达,诱导HeLa细胞凋亡。Guo等[26]的研究发现黄芪多糖可能通过microRNA-27a/FBXW7信号途径诱导卵巢癌细胞凋亡。Wang等[27]的研究发现人参浆果多糖能够促进结肠癌细胞凋亡,并增强其对5-氟尿嘧啶的敏感性。本研究发现SBP能够有效抑制胃癌细胞MGC80-3的增殖,进一步的分子机制研究发现SBP能够提高caspase 3活性形式水平,表明可能促进了细胞凋亡。此外,值得注意的是,SBP还使细胞自噬标志因子LC3 B的水平显著升高,表明可能还触发了细胞自噬途径,目前尚未有文献揭示SBP和肿瘤细胞自噬过程之间的关系。而Akt和IκB α相关信号通路则可能是SBP诱导细胞凋亡和自噬的重要分子机制之一。然而,SBP的成分和结构以及进一步的抗肿瘤信号分子网络还需要更为深入的研究予以揭示。
4 结论
利用3种方法提取SBP,通过比较提取率,确定微波提取法最佳。通过体外抗氧化实验,证实SBP具有较强的羟自由基清除能力、一定的超氧阴离子清除能力和较强的总抗氧化能力。通过MTT实验和细胞形态观察,证实SBP能够显著抑制胃癌细胞MGC80-3的增殖,改变细胞形态。通过western blot实验,证实SBP能够显著影响Akt、caspase3、LC3 和 IκB α 的表达及活性。
