重组腺病毒Ad-DDAH2转染大鼠脂肪干细胞的可行性
2021-05-14李学峰周世豪王新花庞益伟王雁林李清春刁兴华刘海燕
李学峰 周世豪 王新花 庞益伟 王雁林 李清春 刁兴华 刘海燕
1 滨州医学院附属医院生殖医学科 山东 滨州 256603;2 滨州医学院附属医院消化内科 山东 滨州 256603
一氧化氮(nitric oxide,NO)是内皮细胞分泌的一种介导血管舒张的主要神经递质,与阴茎勃起功能障碍密切相关[1]。一氧化氮合酶(nitric oxide synthase,NOS)是调节NO浓度的关键酶。非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)是NOS的内源性抑制物,因而ADMA是体内NO合成的抑制性调节物,90%以上的内源性ADMA由二甲基精氨酸-二甲胺水解酶(dimethylarginine-dimethylamine hydrolase,DDAH)水解代谢,因而体内NO的浓度与DDAH的活性含量有关。DDAH有DDAH1和DDAH2两种亚型,DDAH1主要分布在肾小管、肝脏,而DDAH2主要分布在血管内皮细胞,与内皮型NOS表达的组织一致[2-4]。利用干细胞治疗可以明显改善勃起功能障碍动物的勃起功能,脂肪干细胞(adipose-derived stem cells,ADSCs)取材于睾丸附睾周围的脂肪组织,操作简单,技术成熟,分离成功率高,并发症少,是理想的载体[5-6]。本研究应用基因工程技术将DDAH2基因导入干细胞基因组中,使DDAH2在ADSCs持续表达,降低ADMA生成,提高NO生成,改善修复血管内皮细胞,从而期望在以后的临床应用上达到改善勃起功能的目的。
1 材料与方法
1.1 实验动物与试剂 雄性SD大鼠,体质量为(100±30)g,购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2017-0005。Ad-DDAH2-GFP(上海吉凯生物有限公司),低糖DMEM培养基(Hyclone公司),胎牛血清、胰酶(Gibco公司),DDAH2抗体(H-85)(santa cruz biotechnology公司,No. sc-32859),β-Actin抗体(Epitmics公司),PCR试剂盒(TaKaRa公司)。培养板及培养瓶(Corning公司)。
1.2 方法
1.2.1 SD大鼠ADSCs的分离培养 3月龄雄性SD大鼠,颈椎脱臼法处死,75%酒精浸泡30 min,超净工作台内将大鼠固定。取双侧腹股沟区切口,充分分离切取皮下脂肪组织,将脂肪组织剪成尽可能小的组织小块,加入2倍体积0.1%Ⅰ型胶原酶,37℃震荡消化30~45 min;加入DMEM完全培养基混匀后1 000 r/min离心10 min。弃除上层脂肪组织消化液,加入2倍体积DMEM完全培养基,充分吹打混匀,并将液体于200目不锈钢筛网过滤;1 000 r/min离心10 min,弃除上清,用DMEM完全培养基充分悬浮细胞沉淀,细胞计数后接种至培养瓶内,于37℃、5%CO2培养箱内培养换液。待细胞培养融合至80%~90%时,弃除培养瓶内培养基,灭菌PBS轻轻漂洗2次,加入1.5~2.0 mL 0.25%胰蛋白酶细胞消化液(含0.02% EDTA),并于倒置显微镜下观察细胞形态变化,待细胞形态变圆且开始从培养瓶壁脱落时即可终止消化;轻轻拍打瓶壁,加入1.5~2.0 mL完全培养基终止消化,并沿培养瓶壁顺序充分吹打混匀制成单细胞悬液,以1∶3比例传代培养。
1.2.2 Ad-DDAH2-GFP对ADSCs转染效率的测定 根据重组腺病毒感染复数(multiplicity of infection,MOI)将实验分为MOI=0、MOI=20、MOI=40、MOI=60、MOI=80和MOI=100转染组,每个转染组又分为空白对照组(未转染组)和实验组(Ad-DDAH2-GFP转染组)2个亚组,每组同时设3个复孔。将生长状态良好的第4代大鼠ADSCs种于24孔培养板。待细胞融合至60%~70%,将病毒原液滴度稀释为1.0×108PFU/mL,弃除孔内培养基,转染孔内依次加入病毒稀释液和无血清DMEM培养基,充分混匀,培养24 h后,将孔内培养基更换为1ML DMEM完全培养基,并观察细胞生长状态。转染48 h后,0.25%胰蛋白酶消化细胞,1 000 r/min离心10 min,250 mL PBS重悬细胞后,荧光显微镜观察各MOI值转染效率,根据各MOI值转染效率及细胞状态选取最佳MOI值。
1.2.3 DDAH2基因在ADSCs中的表达 在最佳MOI值转染前提下,转染ADSCs 48 h后,提取细胞mRNA、总蛋白,通过RT-PCR、Western Blot技术检测DDAH2表达情况。实验分为空白对照组(未转染组)、阴性转染组(Ad-NC-GFP转染组)和实验组(Ad-DDAH2-GFP转染组)3个组,每组同时设立2个复孔。
2 结果
2.1 大鼠ADSCs的分离和培养 原代细胞培养72~96 h后,大部分细胞贴壁生长,随着传代次数的增加,细胞多呈多角形、短梭形,偶见长梭形细胞(图1)。
2.2 大鼠ADSCs的生长曲线 第4代大鼠ADSCs的生长曲线呈“S”形(图2)。细胞于第1~2天生长较缓慢,第3天后呈对数生长,第8天后生长速度减慢,并进入平台期,第9天后细胞生长速度呈下降趋势。

图2 第4代ADSCs的生长曲线
2.3 大鼠ADSCs的免疫表型鉴定 流式细胞术检测结果显示,第4代ADSCs的CD29、CD90表达呈阳性,表达率分别为(95.83±0.53)%、(91.32±0.27)%,而造血干细胞表面标志CD45表达呈阴性,表达率为(1.59±0.06)%,符合ADSCs免疫表型特征,这表明所培养的细胞为ADSCs(图3)。

图3 第4代ADSCs的免疫表型检测结果
2.4 Ad-DDAH2载体质量检测 pH值判定:腺病毒保存液pH值范围在6.4~7.0之间。粘稠度判定:用20~200 μL规格移液器缓慢吸取50 μL腺病毒保存液体,无明显粘稠感或吸液滞后现象。无菌检测:将腺病毒加入HEK293细胞验证,正常培养24 h后镜检,无任何细菌及真菌污染情况,同时参照空白细胞组,细胞间隙无明显颗粒存在,培养基澄清透明。腺病毒滴度测定:以 10-6~10-12稀释比病毒液转染HEK 293细胞10 d后,致细胞病变效应(cytopathic effect,CPE)严重程度随稀释倍数的增加而减弱,Ad-DDAH2病毒滴度为2×1010PFU/mL,可满足后续研究需求(图4)。
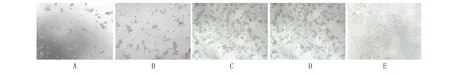
A. 病毒液稀释比为10-6;B. 毒液稀释比为10-8;C. 毒液稀释比为10-10; D. 毒液稀释比为10-12;E. 空白对照组。图4 腺病毒的滴度测定(倒置显微镜,×100)
2.5 Ad-DDAH2-GFP转染ADSCs的效率 腺病毒转染24 h后,转染孔细胞浆内开始表达GFP,且阳性率随MOI值增大而增加,48 h后GFP表达显著增强。Ad-DDAH2-GFP转染效率随MOI值的增大而增加,MOI=80~100时转染效率虽然达到90%以上,但细胞CPE阳性率随着MOI值增大而逐渐增加。MOI=80对ADSCs的生长无显著影响,为Ad-DDAH2-GFP转染ADSCs的最佳MOI值(图5)。
2.6 DDAH2在ADSCs中的表达 通过PCR对DDAH2基因进行扩增,1%琼脂糖凝胶电泳结果显示,Ad-DDAH2-GFP转染ADSCs 24 h后,DDAH2基因在mRNA水平显著上调,见151bp阳性条带(图6A),与空白对照组及阴性对照组相比,差异有统计学意义。这表明,腺病毒介导的DDAH2基因在大鼠ADSCs中有效表达。转染48 h后,通过Western Blot技术于第3泳道130~250 kDa处检测到约为25 kDa的条带(图6B)。这表明,DDAH2蛋白在ADSCs中有效表达,从而证实Ad-DDAH2-GFP构建成功,并在ADSCs中稳定表达。
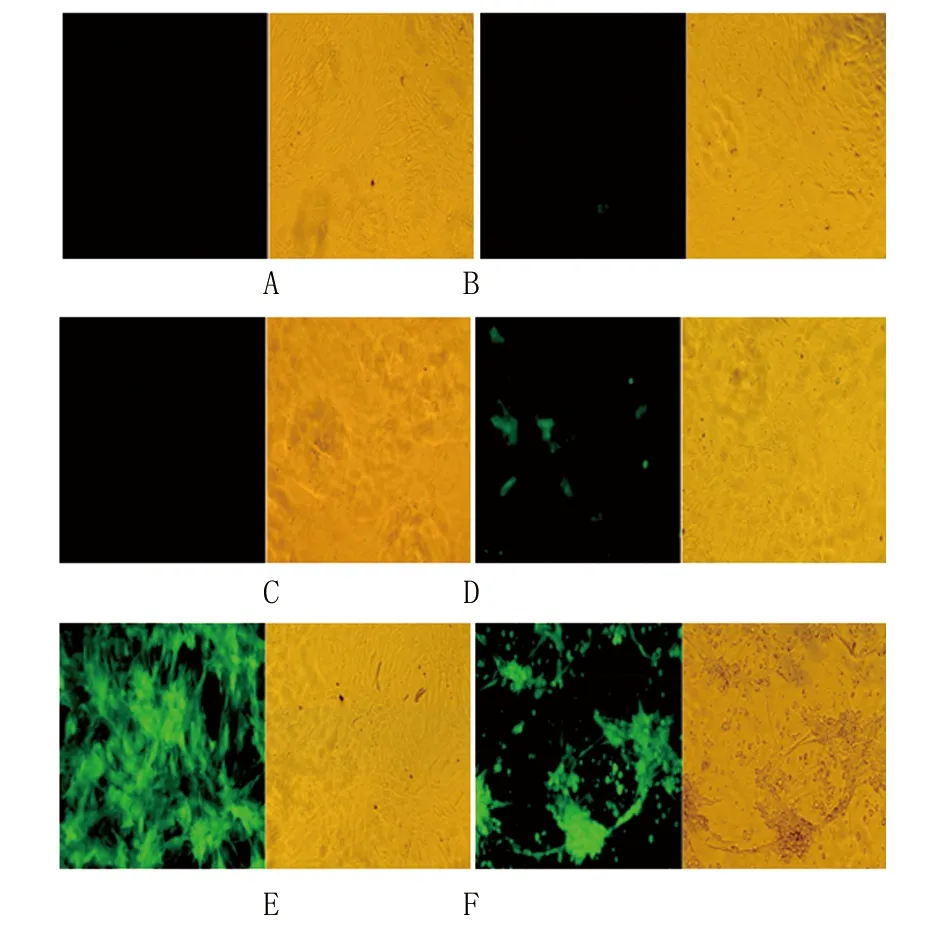
A. MOI=0;B. MOI=20;C. MOI=40;D. MOI=60;E. MOI=80;F. MOI=100。图5 不同MOI情况下Ad-DDAH2-GFP转染ADSCs的效率(倒置显微镜,×200)
3 讨论
NO是血管内皮细胞分泌的一种介导血管舒张的主要神经递质,NO的浓度与DDAH的活性含量呈正相关。DDAH2对NO-cGMP通路的完整性具有重要的意义,因此,DDAH2基因治疗是治疗糖尿病、勃起功能障碍、慢性肾病的潜在可行方法[7-9]。

A. DDAH2mRNA在ADSCs中的表达;B. DDAH2蛋白在ADSCs中的表达。1. 空白对照组(PBS);2. Ad-null-GFP组;3. Ad-DDAH2-GFP组。图6 DDAH2在ADSCs中的表达情况
干细胞具有自我更新和分化的能力,一直是生物学研究的热点,其中ADSCs由于取材方便,增殖能力较强,干细胞性状稳定,受到广大研究者的普遍认可,基因修饰干细胞治疗需要载体将目的基因转移到干细胞内,使干细胞在基因水平上发生改变,但不影响细胞的正常功能,再通过体内回输达到治疗疾病的目的。腺病毒作为双链DNA病毒,转染率高,既可以转染分裂期细胞,也可以转染静止期细胞,对靶细胞病理性损害小,转染后的基因,尤其是大片段基因能表达数天到数周,因此作为基因载体广泛应用于治疗研究中[10-12]。
在本研究中,腺病毒载体在最佳MOI=80条件下,转染效率高达90%以上,且干细胞毒性较小。DDAH2基因导入ADSCs基因组后,使DDAH2在ADSCs中持续表达,然后将转染后的ADSCs注射到体内。利用ADSCs能够特异性迁移到损伤器官/组织,在不同条件下分化成不同的细胞类型,导入的基因可长期稳定表达,植入体内无免疫反应等特点,可以修复损伤组织细胞。此外,DDAH2在基因水平上提高了NO生成,改善修复血管内皮细胞,增强局部抗氧化应激的能力[13-16]。本研究成功将干细胞治疗和基因治疗结合起来,为临床DDAH2基因修饰ADSCs治疗提供指导意义。
