异基因造血干细胞移植对第一次形态学完全缓解急性髓系 白血病患者预后的影响研究
2021-05-13张改玲张芳芳赵晓贞刘玮玮
马 薇,张改玲,张 薇,董 磊,张芳芳,赵晓贞,刘玮玮
(河北燕达陆道培医院移植科,廊坊 065200)
急性髓细胞性白血病(acute myeloid leukemia,AML)是一种起源于异常造血祖细胞的血液系统恶性肿瘤,病情进展迅速且严重,预后较差[1]。目前,AML 患者主要采用诱导缓解化疗控制急性白血病细胞的恶性克隆,在获得第1 次完全缓解(the first complete remission,CR1)后,采用巩固化疗抑制体内残存的白血病细胞,延长患者的生存期[2]。然而,既往研究显示,AML 患者巩固化疗后的复发率较高,生存率仍有待提高[3]。造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是近年来应用于AML 患者临床治疗的一种新技术,也是唯一有可能治愈AML 的手段,根据供体来源可分为自体移植和异基因移植[4]。异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)可以发挥大剂量放化疗和免疫治疗的作用,清除肿瘤细胞,具有良好的临床疗效,且可以避免自体移植的高复发率,但仍存在移植物抗宿主病(graft-versus-host disease,GVHD)等移植相关并发症死亡的风险[5]。有研究显示,在诱导化疗CR1 后进行allo-HSCT,身体耐受性较强,可以提高治愈率,降低因GVHD 等并发症而死亡的风险[6]。因此,本研究探讨了allo-HSCT 和常规巩固化疗治疗CR1 后AML 患者的疗效,旨在明确allo-HSCT 在AML 治疗中的应用价值。
1 资料与方法
1.1 材料与仪器 回顾性分析2016 年8 月~2017 年8月在我科就诊的AML 患者62 例,男34 例,女28 例,年龄19~54 岁,平均(32.78±6.73)岁。纳入标准:均符合《血液病诊断及疗效标准》中AML 的诊断及分型标准[7],均在本院接受诱导缓解化疗后经骨髓形态学显示为CR1,经本院医学伦理委员会通过。排除标准:合并其它系统恶性肿瘤;合并严重感染者;入院时合并严重心、脑、肝、肾等功能不全者;临床资料不完整者。根据治疗方法将患者分为巩固化疗组(n=27)和allo-HSCT组(n=35)。
1.2 治疗方法 所有纳入AML 患者均给予常规输血、抗感染、碱化和水化等支持治疗,采用DA 化疗方案诱导缓解化疗,柔红霉素(daunorubicin,DNR)(海正辉瑞制药有限公司,国药准字H33020925):50~60mg/m2/d,iv,d1~3,阿糖胞苷(cytosine arabinoside,Ara-C)(海正辉瑞制药有限公司,国药准字H20054695):100~200mg/m2,持续iv drip(>3h),QD d1~7,21 d 为一个周期。
巩固化疗组患者获得CR1 后,采用巩固化疗,采用大剂量Ara-C,1.5~2.0g/m2iv(>3h),Q12h d1、3、5,每疗程休疗4~6 周。完成4 疗程并休息3 个月后,交替给予标准DA 及标准MA 方案各2 疗程,每疗程间隔3个月。DA 剂量及用法同诱导缓解,MA 方案:米托蒽醌(mitoxantrone,MTN)(江苏恒瑞医药股份有限公司,国药准字H32020964):10~12 mg/m2/d,iv drip d1~3,Ara-C:50~75 mg/m2,Q12h 持续iv drip(> 3h),d1~7。
allo-HSCT 组患者获得CR1 后先采用Ara-C 巩固化疗1~4 个疗程,再采用allo-HSCT 治疗[8]。
预处理方案:人类白细胞抗原(human leukocyte antigen,HLA)相合的亲缘供体移植者采用BUCY 为主方案,阿糖胞苷3g/m2,-12 至-10 d;Bu 白舒非0.8mg/m2,q6h,-9 至-6 d;Cy 环磷酰胺1.8g/m2,-5 至-4 d;司莫司汀250mg/m2,-3 d。HLA 配型不完全相合的供体移植者联合应用ATG 方案预处理。
GVHD 预防:预防采用环孢素A(CSA),骁悉,短疗程甲氨蝶呤(MTX)等预防GVHD,即MTX15mg/m2,静脉注射(移植后第1 天),10mg/m2,静脉注射(移植后第3 d,第6 d,第11 d)。CSA2.5mg/kg/d,-9 d 开始静脉输液,移植后1 个月左右改口服,根据血药浓度调整用药剂量;骁悉1g/d,-9 d 开始口服;环孢素及骁悉的减停根据患者的病情而定;30 例辅助输注非血缘HLA 配型低分辨4/6~5/6 位点相合的脐带血1 份,3 例辅助输注半相合父亲及2 例辅助回输半相合堂兄弟的骨髓预防GVHD。发生Ⅱ度或Ⅱ度以上aGVHD 后,应用甲泼尼龙及其他免疫抑制剂(如:CD25 单抗、重组人肿瘤坏死因子单克隆抗体)治疗。植活标准[8,9]:外周血中性粒细胞连续3 d 绝对值在0.5×109/L 或以上,以及在连续7d 不输血小板的情况下血小板在20×109/L 或以上,为植入指标。
巨细胞病毒(cytomegalovirus,CMV)预防:移植前-9 d 至移植前1 d 应用更昔洛韦5mg/kg,2 次/d,移植后第1 d 开始应用阿昔洛韦预防CMV,移植后常规以PCR 方法检测巨细胞病毒及EB 病毒。
其他并发症的预防:前列地尔预防肝静脉阻塞综合征,移植后30 d 停用;复方新诺明预防卡氏肺孢子菌感染,移植后30 d 改为预防量;氟康唑预防真菌治疗,如患者既往有真菌感染病史,根据患者情况选择抗真菌药物。
1.3 观察指标 (1)一般资料收集:记录两组患者的年龄、性别、FAB 分型、NCCN 危险分层[9]、达到CR1 所需疗程、初诊白细胞计数、初诊血小板和初诊血红蛋白。采集AML 患者空腹血液4 mL,离心(3000 r/min,10 min),取上清0.5 mL,测定白细胞、血小板和血红蛋白水平。
(2)生存情况:记录患者达到CR1 后1 年、2 年和3 年内的生存、死亡和复发[10]情况,包括死亡原因:复发、严重感染、骨髓抑制、GVHD、弥漫性肺泡出血等。
(3)免疫功能检测:分别于达到CR1 和CR1 后1年,采集20μL 抗凝血,红细胞裂解液溶解红细胞,离心(1000 rpm,5 min),加入5μL 荧光标记抗体,室温避光孵育15~20 min,离心(1000 rpm,5 min),重悬,取200μL置于FACSCanto II 流式细胞仪(美国BD Biosciences公司),分析CD3+T、CD4+T、CD4+T/CD8+T、CD8+T 和CD4+CD25+Treg 水平。
1.4 统计学处理 采用SPSS 17.0 软件对所得数据进行分析,正态分布的计量资料以mean±SD 表示 t 检验分析比较组间差异;计数资料均以率(%)表示,χ2检验比较组间分类资料差异,Log-rank χ2检验比较组间生存资料差异,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 两组患者的年龄、性别、FAB 分型、危险分层、达到CR1 所需疗程、初诊白细胞计数、初诊血小板和初诊血红蛋白水平均无明显差异(P>0.05),见表1。
2.2 两组患者的生存率比较 allo-HSCT 组患者的1年、2 年和3 年总生存率和无病生存率明显高于巩固化疗组(P<0.05),见表2。
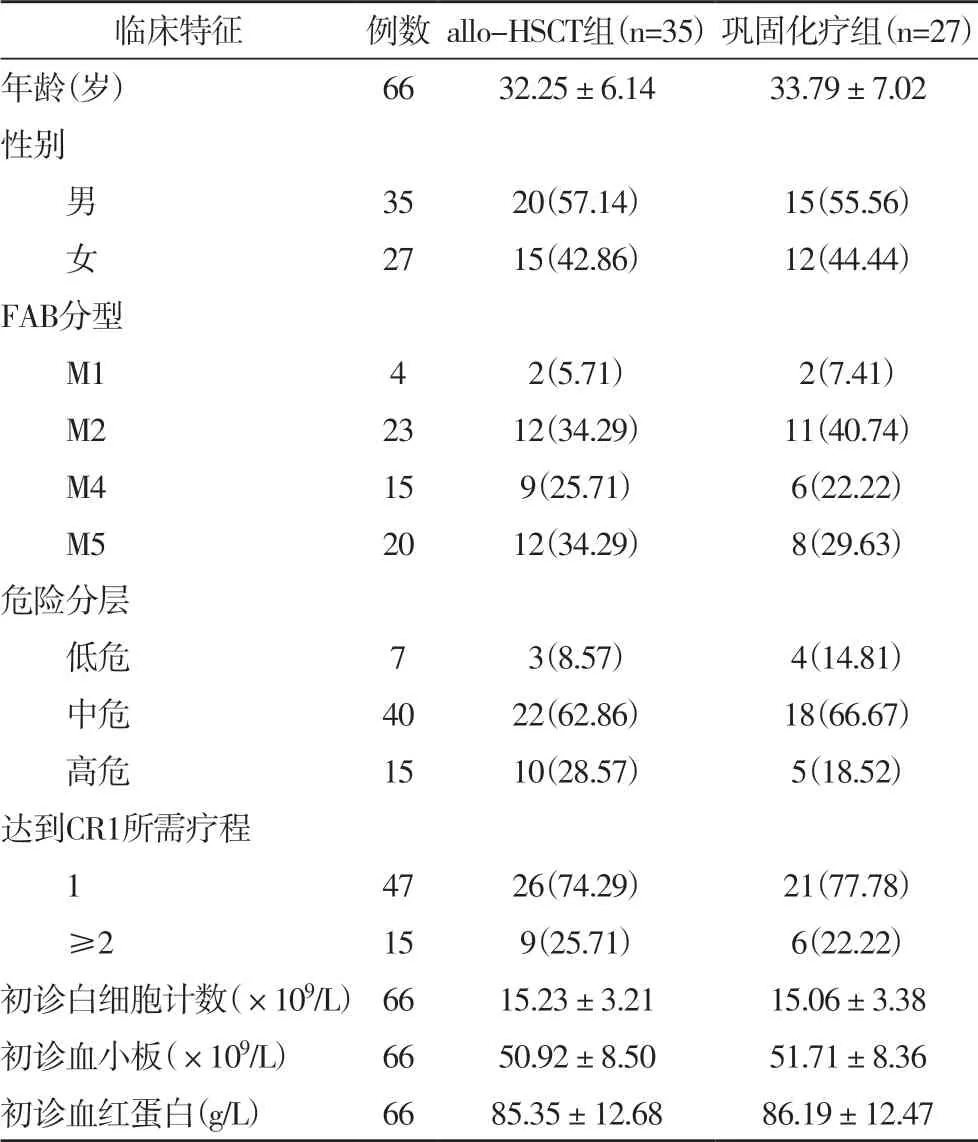
表1 两组患者一般资料比较

表2 两组患者的生存率比较
2.3 两组患者的复发率比较 allo-HSCT 组患者的1年、2 年和3 年复发率明显低于巩固化疗组(P<0.05),见表3。

表3 两组患者的生存和复发情况比较
2.4 两组患者的死亡情况分析 allo-HSCT 组患者3年死亡9 例,巩固化疗组患者3 年死亡17 例。且allo-HSCT 组复发死亡率明显低于巩固化疗组,GVHD 死亡率明显高于巩固化疗组(P<0.05),见表4。
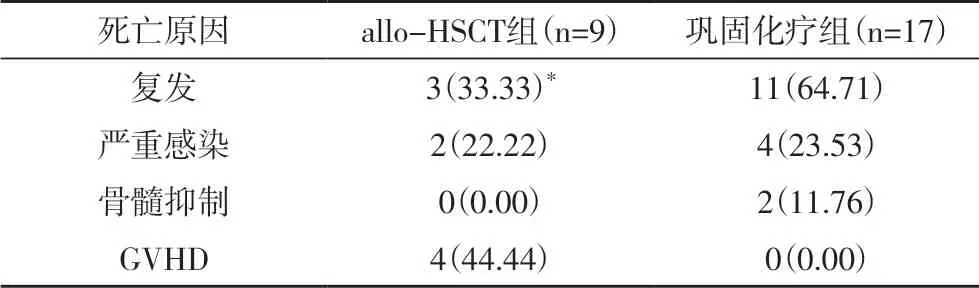
表4 两组患者的死亡情况分析
2.5 两组患者的免疫功能比较 两组患者CR1 的CD3+T、CD4+T、CD4+T/CD8+T、CD8+T 和CD4+CD25+Treg水平无明显差异(P>0.05);CR1 后1 年,allo-HSCT 组的CD4+T 和CD4+T/CD8+T 水平明显高于巩固化疗组(P<0.05),CD4+CD25+Treg 水平明显低于巩固化疗组(P<0.05),见表5。
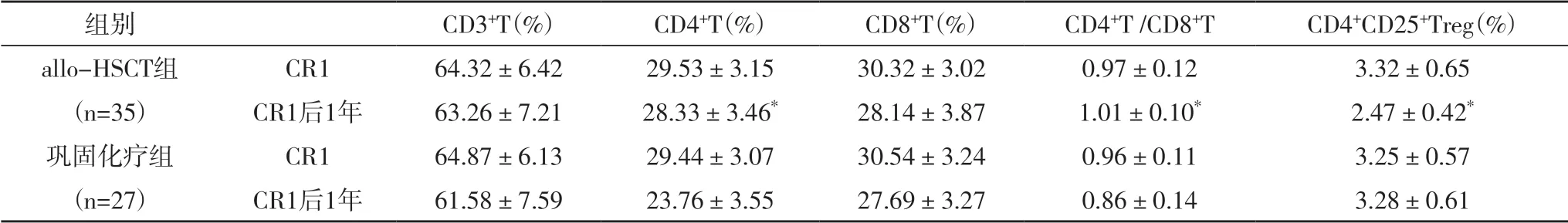
表5 两组患者治疗前后的免疫功能比较
3 讨论
AML 是一种恶性血液系统疾病,其发病机制复杂,预后较差,以骨髓与外周血中原始/幼稚髓性细胞异常增生为主要特征,临床治疗主要包括诱导缓解治疗和巩固治疗两个阶段[11]。目前,临床医师主要根据患者病情进展、经济情况、是否具备合适的供体源等,在诱导缓解治疗后选择相应的巩固化疗和allo-HSCT 治疗[12]。既往研究显示,AMI 患者在获得诱导化疗CR1后,身体耐受性较强,可以耐受allo-HSCT 治疗引起的GVHD 等并发症,降低治疗后的复发率,延长生存期[13]。本研究探讨了allo-HSCT 和巩固化疗治疗CR1后AML 患者的疗效,发现相较于巩固化疗,allo-HSCT治疗后患者的总生存率和无病生存率明显提高,提示allo-HSCT 治疗可以提高CR1 患者的临床疗效。王炳晨等[14]研究显示,allo-HSCT 治疗可以结合放化疗和免疫治疗的特点,发挥移植物抗白血病细胞效应,抑制肿瘤细胞的免疫逃避,改善AMI 患者预后,本研究结果与其类似。本研究中,allo-HSCT 组患者的1 年、2 年和3 年复发率明显低于巩固化疗组,且allo-HSCT 组复发死亡率明显低于巩固化疗组,GVHD 死亡率明显高于巩固化疗组,提示allo-HSCT 治疗可以降低AML 患者的复发率,提高生存率,但其GVHD 的发生率较高。既往研究显示,GVHD 是allo-HSCT 治疗的常见并发症,也是导致AML 患者allo-HSCT 治疗后死亡的主要因素之一,选择合适的供体是减轻GVHD 反应的关键[15]。研究结果表明,allo-HSCT 治疗可以提高AMI 患者的生存率,降低复发率,在临床条件允许时可优先选择allo-HSCT 治疗。
本研究中,两组患者在达到CR1 时的CD3+T、CD4+T、CD4+T/CD8+T、CD8+T 和Foxp3+Treg 水平无明显差异;而在CR1 后1 年,allo-HSCT 组的CD4+T 和CD4+T/CD8+T 水平明显高于巩固化疗组,CD4+CD25+Treg 水平明显低于巩固化疗组。CD4 主要表达于辅助性T 细胞(Th),在抗原刺激下可以分化为Th1、Th2 等细胞,调节机体白介素、干扰素γ、肿瘤坏死因子α等多种细胞因子的合成和释放,调控细胞内免疫应答反应[16]。黄方等[17]研究显示,CD4+/CD8+T淋巴细胞可以敏感的反映机体的细胞免疫功能,其比例下降与AML 患者的恶性进展有关,提示allo-HSCT治疗可以改善AML 患者免疫功能,发挥抗肿瘤作用。Treg 是CD4+T 细胞中的一类重要亚群,主要来源于胸腺,可以通过多种机制抑制效应T 细胞的功能,介导肿瘤细胞的免疫逃避,还可以抑制自身免疫反应的发生[18-19],提示allo-HSCT 治疗可以改善AML 患者免疫功能,抑制肿瘤细胞的免疫逃避。向金峰等[20]研究显示,allo-HSCT 治疗后降低的CD4+CD25+Treg 水平可以通过调节自身免疫反应,促进GVHD 的发生,提示allo-HSCT 治疗后AML 患者体内降低的CD4+CD25+Treg 水平与GVHD 发生有关,临床可采用相应的预防治疗措施,降低GVHD 的发生。
allo-HSCT 治疗CR1 后AML 患者的总生存率和无病生存率明显高于巩固化疗,复发率明显降低,可能通过调节机体T 淋巴细胞亚群水平,改善免疫功能,改善患者预后。本研究不足之处在于总样本量较少,可能会对结果差生一定影响,本研究仍为AML 的治疗提供了一定的参考依据。
