丹参活性成分对心肌缺血再灌注损伤保护作用及机制研究进展
2021-05-13李永鑫高彦宇胡晓阳沈芳玲李文慧李冀
李永鑫,高彦宇,胡晓阳,沈芳玲,李文慧,李冀
(黑龙江中医药大学基础医学院,黑龙江 哈尔滨 150040)
丹参为唇形科植物丹参的干燥根及根茎。其味苦,微寒,归心、肝经,具有活血祛瘀、凉血消痈、清心除烦等功效,为现代临床治疗心血管疾病常用中草药。目前已经初步从丹参中分离鉴定100余种成分主要包括脂溶性菲醌类以及水溶性多聚酚酸类成分。脂溶性二萜醌类化合物主要包括:丹参酮I、丹参酮ⅡA、隐参酮等其中参酮ⅡA含量相对较高,丹参脂溶性成分目前均以丹参酮为有效成分的参考指标。水溶性酚酸类化合物:主要成分有丹参素、原儿茶醛、咖啡酸、迷迭香酸及丹酚酸A,B,C等。现代药理学及临床研究表明丹参具有抗动脉粥样硬化、抗心律失常、降血脂、降血压及改善血液循环等多种心血管疾病防治作用[1-3]。丹参活性成分的研究成为近年来研究的热点和重点。本文查阅近年来国内外相关文献,现对丹参活性成分对心肌缺血再灌注损伤保护作用的体内外研究进行综述,为中医药新产品开发以及临床辨证治疗用药提供理论指导。
1 丹参活性成分多角度抗心肌缺血再灌注损伤
1.1 清除氧自由基、抗氧化
心肌血氧供应不足时,心肌细胞有氧代谢功能异常导致代谢废物活性氧自由基增多,过多的活性氧自由基难以及时被心肌清除,会与细胞膜上的不饱和脂肪酸反应而损伤细胞结构,从而使心肌缺血的现象更加严重。研究表明[4]丹参素对I/R损伤时离体心脏的氧化应激具有保护作用,能够清除活性氧(ROS)和提高内源性抗氧化剂SOD、CAT、GSH-Px和HO-1活性,并且该机制与激活Akt/ERK1/2/Nrf2信号通路增强抗氧化防御系统有关。王木兰等[5]研究发现,丹酚酸A能明显抑制大鼠心肌缺血再灌注损伤所致血浆中LDH、AST、CK以及CK-MB活性的升高,并能明显提高血浆NO含量,降低血浆MDA含量,从而抑制心肌脂质过氧化,起到保护血管内皮和保护心肌的作用。在缺血心肌中,氧化应激导致活性氧(ROS)的过度生成和积累,是心肌缺血损伤的中心环节。研究发现[6],丹酚酸B对心肌缺血损伤大鼠有良好的心肌保护作用,主要是清除氧化应激引起的ROS生成和积累,减轻心肌缺血损伤和心肌细胞死亡。
1.2 抑制心肌细胞钙超载
Ca2+对维持心肌能量代谢极为重要,在正常生理状况下,心肌细胞外Ca2+浓度远高于细胞内。当心肌血氧供应不足时,会使细胞内Ca2+浓度异常增加,而出现Ca2+超载的现象。对于心肌细胞内Ca2+超载主要与Na+/Ca2+交换有关,还可能与心肌细胞膜对Ca2+的通透性增大以及肌浆网对Ca2+的摄取能力降低有关[7]。当Ca2+超载时会对线粒体造成一系列影响,从而导致细胞损伤引起细胞凋亡。哺乳动物TRP通道的发现是研究Ca2+进入分子基础的一个新的起点,这一发现极大地促进了心血管疾病研究的发展,TRP家族对钙具有高度的渗透性[8]。有研究表明[9]丹参素预处理组可以降低I/R损伤诱导的H9c2细胞中TRPC6蛋白表达、Ca2+水平以及细胞凋亡率。苏亚平等[10]通过制备急性心肌梗死模型,发现丹参酮ⅡA注射液可以下调造模后心肌细胞CaMKⅡm RNA、CaM表达,抑制Ca2+与CaM-CaMKⅡ信号转导途径,阻断了Ca2+过多内流使心肌正常除极而避免由钙超载诱导心肌梗死并通过扩张冠状动脉而达到心肌缺血的保护作用。
1.3 改善能量代谢
当心肌血氧供应不足时,有氧代谢受到抑制,ATP生成减少,心肌能量代谢以无氧方式为主,产生大量乳酸导致心肌细胞内酸中毒。同时心肌细胞内Ca2+内流增多,线粒体从胞浆摄取过量的Ca2 +,造成线粒体Ca2 +超载引起膜通透性改变,心肌能量代谢障碍导致细胞超微结构异常,造成不可逆损伤[11]。膜电位下降是线粒体生成ATP减少的重要原因之一,其稳定与否与线粒体通透性转换孔(mPTP)有关,而ROS又是mPTP开放的重要诱因之一。孙大伟等[12]通过制备离体心脏灌流系统构建模型,发现10 μmol/L的丹参素可以下调FoxO1 mRNA表达,减少ROS生成,抑制mPTP过度释放以及稳定膜电位从而改善缺血再灌注损伤。有研究表明[13]MI/RI发生后细胞中Ca2+-Mg2+-ATP 酶和Na+-K+-ATP 酶活性均有明显降低,表明再灌注后心肌组织能量代谢障碍,而丹酚酸B不同浓度预处理组均可提高心肌细胞中ATP酶活性,减少心肌梗死面积。马春香等[14]研究发现丹参酮ⅡA可以通过抑制mPTP过度开放以及减少细胞色素C的释放来减轻心肌细胞凋亡从而实现心肌保护。
1.4 抑制心肌细胞凋亡
细胞凋亡是一种程序化的由基因控制的细胞自然死亡的形式。但是当心肌缺血时,会逐渐出现大量损伤心肌细胞凋亡的现象,细胞凋亡参与心肌MIRI损伤的过程,多种原因如氧自由基增多、Ca2+超载、能量代谢障碍等都是加剧细胞凋亡的诱因。凋亡机制起始于数个蛋白从线粒体释放,包括细胞色素C一旦释放到细胞质中便与蛋白质Apaf1相互作用形成复合物并激活蛋白酶Caspase-9;Caspase-9激活另外的Caspase家族的成员导致不可逆转的蛋白酶活性升高,则细胞进入凋亡模式。Caspases蛋白酶的级联激活是凋亡过程的中心环节,Bcl-2家族蛋白是主要控制因素[15]。有研究表明[16]MIRI损伤大鼠通过丹参多酚酸盐治疗能减少心肌梗死面积,减少心肌细胞凋亡,明显上调凋亡相关蛋白Bcl-2、抑制Bax和激活型Caspase-3表达。JAK/STAT 信号通路的激活可以抑制细胞凋亡,保护心肌细胞,而 JAK2/STAT3是JAK/STAT通路中的重要成员之一。AG490是JAK2的特异性抑制剂,可以阻断JAK2下游蛋白STAT3的磷酸化。张美齐等[17]研究发现丹参酮ⅡA组相对于模型组细胞凋亡数量明显减少,WB结果显示丹参酮ⅡA可以诱导JAK2、STAT3表达增加,而加入AG490后明显消弱这一作用,表明丹参酮ⅡA保护心肌、减少细胞凋亡的作用可能通过激活AK2通路,诱导STAT3的磷酸化实现的。
1.5 调节自噬
细胞自噬是将细胞内受损、变性或衰老的蛋白质以及细胞器运输到溶酶体内进行消化降解的过程,在心脏中心肌细胞自噬对维持心肌功能具有重要的作用,心肌缺血时,自噬可以通过多种途径来保护心肌细胞免受心肌缺血引起的损伤,自噬信号通路在心肌MI/RI过程中起重要调控作用。目前研究较多的是线粒体自噬,通过线粒体自噬可以消除细胞内受损的线粒体,促进线粒体在体内的更新以及维持线粒体在细胞内的数量,从而保护和维持心肌细胞功能[18-19]。在心血管系统疾病中,miR-30a通过Beclin-1蛋白在血管紧张素II引起的心肌损伤中调节自噬起重要作用,miRNA-30a可以直接与Beclin-1的3′-UTR结合并促进其mRNA的降解[20]。LI D等[21]研究发现丹酚酸B可以抑制小鼠原代心肌细胞I/R损伤,提高细胞活力,降低LDH漏出。丹酚酸B能显著降低beclin-1、LC-Ⅱ的表达,在将miR-30a抑制剂转入心肌细胞后,发现miR-30a抑制剂可以减弱丹酚酸B诱导的心肌保护作用,对抗模拟I-R损伤诱导的自噬,表明Sal B通过miR-30a上调介导的自噬抑制保护心肌细胞。适度的自噬可以清除再灌注过程中的ROS,而过度自噬则损伤心肌细胞。孙大伟等[22]研究发现丹参素预处理可抑制H/R损伤H9c2心肌细胞自噬基因LC3、Beclin-1表达。抑制细胞过度自噬充分发挥清除ROS的作用,减少其对ATP5G1的过氧化损伤,而起到保护心肌细胞的作用。mTOR作为一种典型的丝氨酸/苏氨酸蛋白激酶,在缺血损伤的自噬和凋亡中起着重要的调节作用,对心脏的结构和功能起着重要的作用[23]。研究表明[24]丹参素的预处理显著提高了细胞存活率,并防止了I/R引起的心功能恶化,降低I/R期间凋亡蛋白和自噬相关蛋白Beclin-1、LC3及p62的上调,而加入雷米帕素(mTOR抑制剂)后抑制了这种作用,表明丹参素对自噬具有负性调节作用且激活mTOR是丹参素调节细胞凋亡和自噬的重要机制。
1.6 抑制炎性反应
炎性反应参与心肌损伤的全过程。当心肌缺血/再灌注时,中性粒细胞增多阻塞毛微血管,还可黏附并迁移至内皮下与内皮细胞上的黏附因子结合释放如TNF-α、IL-1、IL-6等炎性介质,从而扩大炎症反应,因而抑制炎性因子表达有助于抵抗心肌缺血再灌注的作用。HMGB1是一类高度保守的非核蛋白,存在于大多数真核细胞中。当HMGB1受到某些因素的刺激时,可通过主动分泌或被动释放进入细胞间隙,介导炎症反应[25]。有研究表明[26]大鼠腹腔注射15 d丹参酮ⅡA后建立再灌注模型,发现与IR组相比,不同剂量给药组均可提高SOD、GSH-Px活性,降低MDA、TNF-α、IL-6、iNOS水平,不同剂量丹参酮ⅡA处理大鼠心肌组织中HMGB1的含量均可明显减少,表明丹参酮ⅡA可通过抑制ROS升高及HMGB1表达来减轻心肌组织炎症反应。权伟等[27]采用结扎冠状动脉复制大鼠MI/RI损伤模型,发现丹参素钠高剂量组(60 mg·kg-1)TNF-α、IL-1 、IL-6均显著小于模型组,且所有给药组心肌组织的病理损伤也小于模型组,表明丹参素钠对大鼠MI/RI损伤有保护作用,其机制与抑制炎症反应有关。WEI G等[28]发现原儿茶醛预处理能明显降低I/R模型TNF-α、IL-6和NO水平,减少心肌梗死面积。一些研究表明PPARγ通过负性调节巨噬细胞分化和活化过程中诱导的促炎症基因表达而发挥抗炎作用。 JICHUN H等[29]研究发现迷迭香酸对I/R损伤有明显的心脏保护作用。迷迭香酸预处理可以恢复大鼠心脏I/R损伤模型中降低的心脏血流动力学参数,减少梗死面积和心肌细胞凋亡,抑制I/R诱导心肌损伤大鼠心肌组织炎性细胞因子(IL-6、TNF-α和CRP)、PPARγ表达上调和NF-κB表达下调。表明迷迭香酸介导的心脏保护机制之一是通过其抗炎特性。心肌组织中MPO主要由NEU分泌,其水平与NEU激活程度显著相关,ICAM-1 抗体可抑制心肌组织内NEU与血管内皮细胞之间的黏附,改善心肌损伤。夏杨等[30]研究表明丹酚酸B预处理可以降低心肌MPO活力、ICM-1阳性表达以及炎症因子TNF-α、IL- 1β 的生成。
1.7 抗血小板聚集
血小板在生理或病理条件下发生黏附聚集,会使冠脉血流不畅,心肌血氧供应不足而诱发心肌缺血。血小板在I/R损伤中起关键作用。再灌注后,血小板与内皮下胶原接触可刺激血小板黏附和活化。YUAN X等[31]于再灌注开始前10 min,大鼠颈静脉注射丹酚酸A(10 mg/kg),再灌注3 h后,用血小板聚集仪测定血小板聚集,发现丹酚酸A有较强的血小板活性,能够降低二磷酸腺苷诱导的血小板聚集。且在再灌注后3、24 h降低了血清P-选择素水平,P-选择素存在于活化血小板上,一旦血小板在缺血和再灌注期间被激活,P-选择素可能会从膜上被裂解,形成可溶性形式,可以在血浆中检查到。因此丹酚酸A可能通过抑制血小板活化和改善冠状动脉血流来降低冠状动脉血栓。
1.8 调节血管内皮功能及促进微血管再生
内皮细胞可以分泌多种调控血管收缩和舒张的活性因子,来抑制血小板的黏附聚集。血管内皮细胞功能障碍会使动脉血管调节功能失调从而导致冠状动脉粥样硬化的发生。NO是一种扩血管因子,可促进内皮细胞增殖,增加冠脉血流量,ET-1是一种强力的血管收缩肽,能够产生血管收缩作用[32]。NO/ET-1两者共同维持体内血管内环境的平衡。当心肌缺血时,促进ET-1分泌而打破平衡,使血管壁收缩从而加剧心肌缺血。周淑妮等[33]通过对192例冠心病心绞痛患者作为研究对象,在常规冠心病治疗基础上采用注射用丹酚酸盐治疗14 d,发现给与丹酚酸盐治疗后,心绞痛发作次数、硝酸甘油使用剂量均较治疗前明显降低,血清中ET-1水平明显降低,NO水平明显升高。
血管内皮生长因子(VEGF)在促进血管生成中发挥重要作用,特别是在损伤和缺血组织的血管修复中[34]。周丹等[35]通过结扎冠脉制备大鼠MI/RI模型,发现丹酚酸B预处理可以减轻心肌梗死面积,增加心肌梗死边缘区域微血管密度,不同浓度丹酚酸B预处理组均可增加心肌梗死边缘区域Nrf2 、HO-1以及VEGF的表达,表明丹酚酸B有促进缺血心肌区域血管再生的功能。刘家军等[36]在制备家兔心肌H/R损伤模型前经丹参酮ⅡA磺酸钠注射液预处理,可明显提高 VEGF及mRNA表达,提高氧自由基清除酶的活性,加快缺血心肌血管内皮新生,促进血管新生。
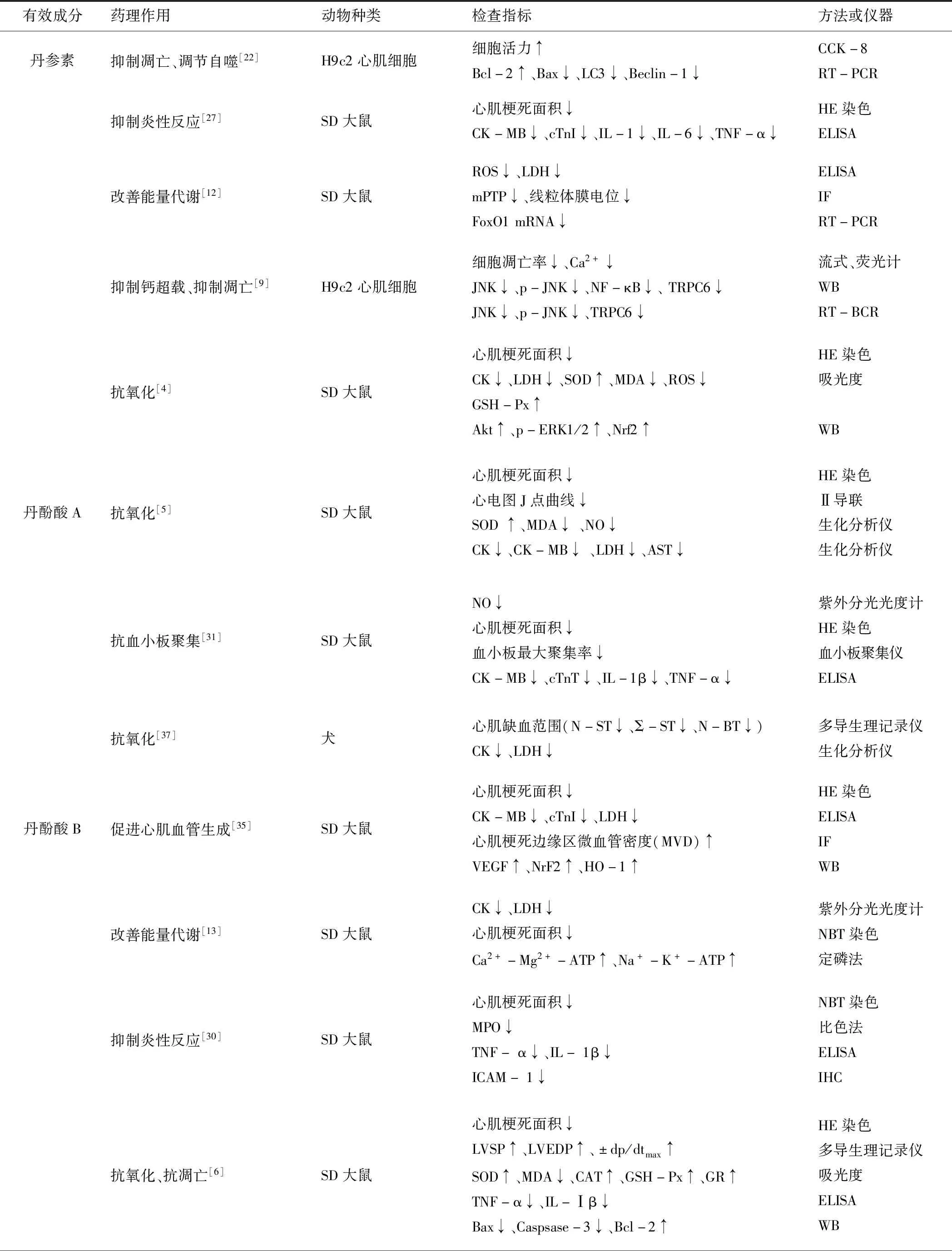
表1 丹参主要有效成分对心肌缺血再灌注损伤的保护作用(近5年)
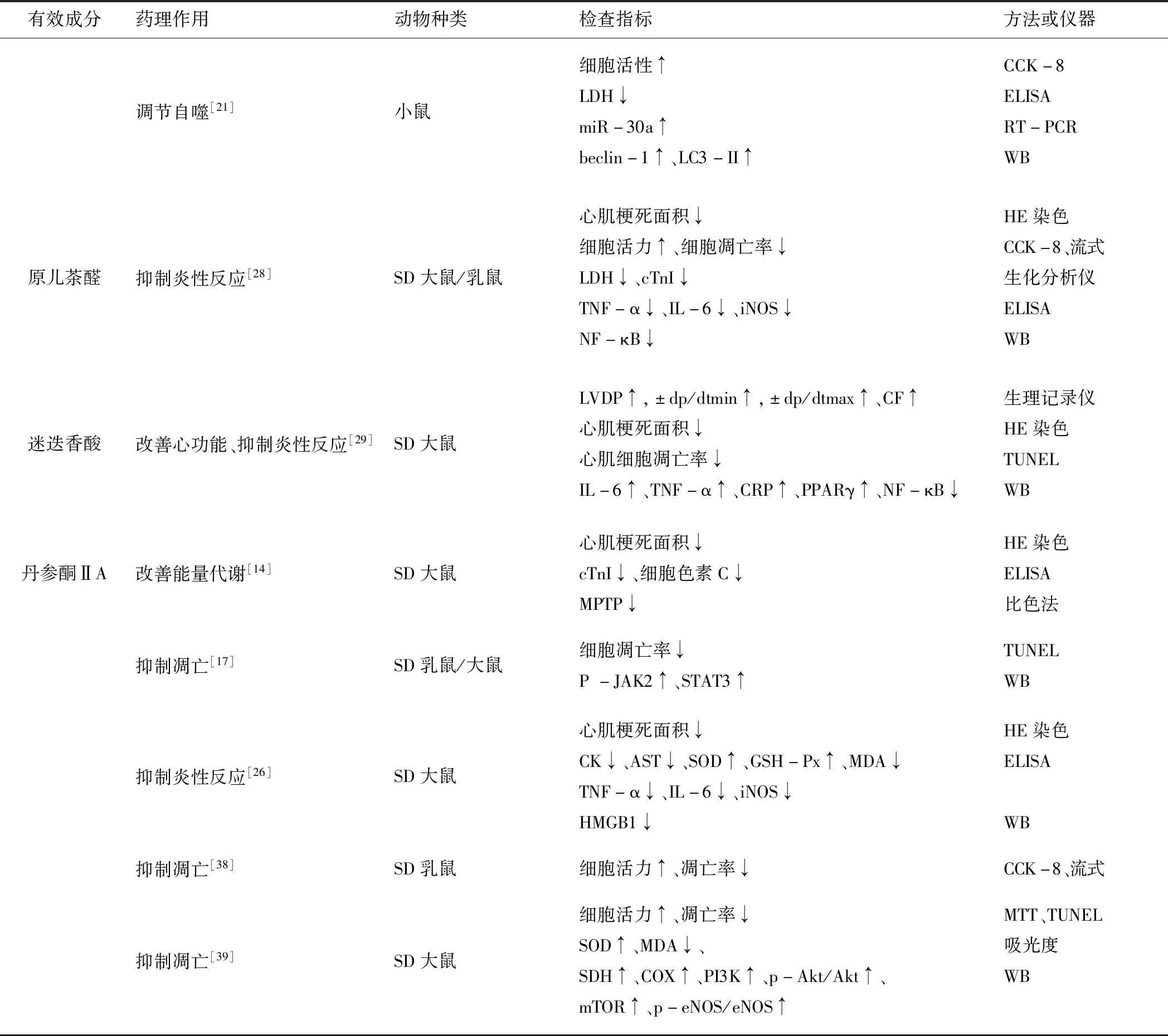
续表1
2 结语
心肌缺血是指心肌血氧供应不足引起心肌代谢及结构改变,主要由于冠脉粥样硬化斑块缩小血管内径导致血流量减少引起。血压降低、冠脉阻塞、心肌病变等都会导致心肌缺血进而出现多种心脏疾病,严重者出现心源性休克从而威胁生命[40]。丹参活性成分丹参素、丹酚酸A,B、原儿茶醛、迷迭香酸、丹参酮ⅡA等均可在机体、组织、细胞水平上发挥防治心肌缺血再灌注损伤的作用。近年来关于丹参有效成分防治心肌缺血再灌注损伤相关机制也不断被揭示,主要与氧自由基、钙超载、能量代谢、细胞凋亡、自噬、炎症反应、血小板聚集、内皮细胞及微血管再生等因素有关,他们如同一个网络互相交织共同保护心肌。如心肌细胞胞浆内Ca2+浓度过高会造成心肌能量代谢障碍的现象。内皮细胞功能障碍会导致血小板聚集黏附从而阻碍冠脉循环等。相信随着丹参有效成分的深入研究可以为丹参复方配伍、组分配伍等研究及新产品开发提供理论依据。
