骨关节炎患者膝关节滑膜组织的基因表达谱分析
2021-05-13谌虹焰张明媚陈杏王涛谢庆云魏萌
谌虹焰,张明媚,陈杏,王涛,谢庆云,魏萌
(1.西南交通大学医学院;2.西部战区总医院风湿免疫科;3.西部战区总医院骨科,四川 成都 610083)
骨关节炎(osteoarthritis,OA)是最常见的退行性关节疾病,以关节软骨损害为主要特点,可逐渐累及软骨下骨、滑膜、周围软组织等直至整个关节,给患者造成关节疼痛、关节畸形及活动受限等痛苦。我国OA的总患病率在60岁以上年龄段达50%,75岁以上高达80%[1],因其好发于下肢负重关节,如髋、膝关节,也成为中老年人下肢残疾的主要原因。年龄、性别、肥胖、遗传易感性、关节过度活动与压力等都是OA的病因[2],而OA的发病机制尚不完全清楚。从近年来不断发展的表达谱芯片入手,以基因组学来研究发病机制,对寻找潜在诊断标志物和治疗靶点有重要意义。本研究旨在通过挖掘基因表达综合数据库(gene expression omnibus,GEO)中膝OA滑膜组织与正常滑膜相比的基因芯片数据,对差异表达基因进行生物信息学分析,为找到新的治疗靶点和揭示OA的发病机制提供更多的线索和依据。
1 资料与方法
1.1 一般资料
从美国国家生物信息技术中心(national center for biotechnology information,NCBI)的GEO数据库中寻找OA滑膜组织相关的基因表达谱数据。以“Osteoarthritis”、“Synovial tissue”为关键词,在人类组织标本的分类下,搜索近5年的数据,选取在同一研究平台使用相同芯片进行分析的数据集,尽量减少数据集之间比较的差异,保证数据分析的可靠性,数据集GSE55457和GSE55235符合要求。这两组数据集均来自GPL96平台,所用芯片类型为Affymetrix Human Genome U133A Array(HG-U133A),每组数据中均包含健康对照样本、OA患者样本和RA患者样本,本研究选择其中的OA患者样本和健康对照样本作为研究对象,共纳入40例样本(20例OA样本、20例健康对照样本)进行综合分析。
1.2 方法
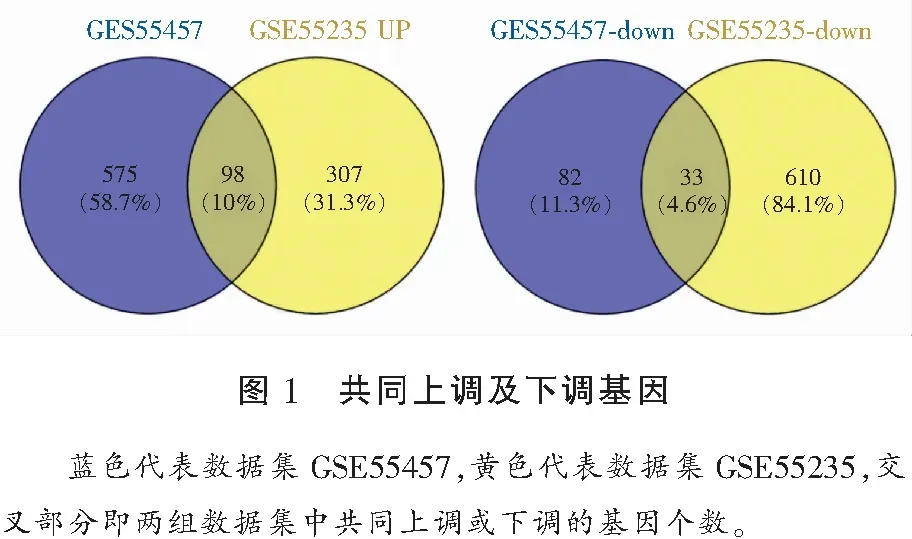
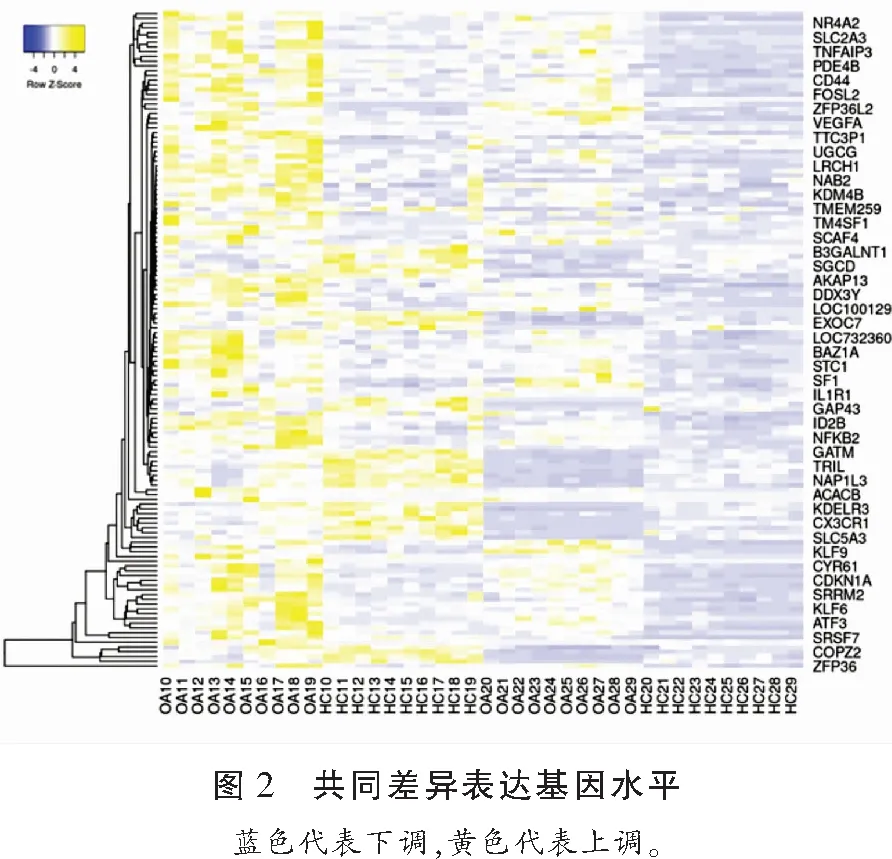
1.2.1 差异表达基因的筛选 利用GEO2R在线软件(http://www.ncbi.nlm.nih.gov/geo/geo2r/)分别对两组数据集进行分析,从GEO数据库中获取特定基因的表达值,利用R语言中的limma 工具包确定OA和健康对照滑膜组织之间的差异表达基因,通过Benjamini-Hochberg方法纠正错误发现率(FDR),以FDR-P<0.05,|log2FC|≥1,(差异表达倍数为两倍)为条件筛选差异表达基因,并对筛选的两组差异表达基因求交集,获得共同表达上调和下调的基因,构建维恩图(venn diagram),绘制基因热图。
1.2.2 差异表达基因的功能富集及注释 将上调和下调的基因分别上传至DAVID 6.8在线分析软件(https://david.ncifcrf.gov/summary.jsp),对差异表达基因进行GO(gene ontology)富集分析,包括生物过程、细胞组成和分子功能三个方面,以及KEGG(kyoto encyclopedia of genes and genomes)通路富集分析,以P<0.05为筛选条件,得到富集分析结果,从功能层面对差异表达基因进行解读。
1.2.3 蛋白间相互作用网络分析 将差异表达基因导入STRING数据库(https://string-db.org/)获得基因所编码的蛋白间相互作用(protein-protein interaction,PPI)网络图。再利用Cytoscape 3.8.0软件进行可视化,通过cytoHubba插件计算各个节点间相互作用程度“degree”,根据degree值筛选出关建基因。
1.3 统计学分析
采用SPSS 20.00软件对数据进行分析与处理。采用t检验分析OA和正常滑膜组织之间的基因表达。P<0.05为差异具有统计学意义。
2 结果
2.1 差异表达基因
通过GEO2R筛选出数据集GSE55457和GSE55235满足调整后P<0.05,|log2FC|≥1的差异表达基因,其中GSE55457组788个(上调基因673个、下调基因115个)、GSE55235组1048个(上调基因405个、下调基因643个)。取交集并构建维恩图,可见两组共有131个差异表达基因,其中有98个上调基因,33个下调基因。见图1、图2。
2.2 差异表达基因的GO功能和KEGG通路富集分析
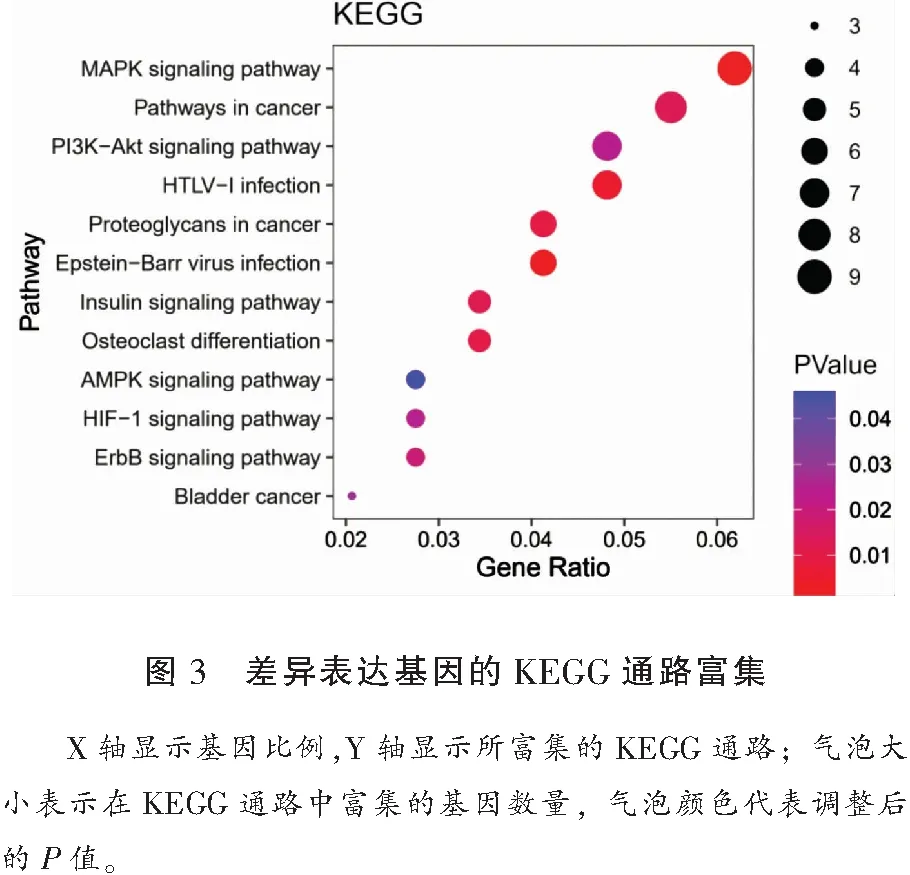
GO富集分析从生物过程、细胞组成和分子功能三个方面诠释了差异表达基因的功能。上调的差异表达基因在生物过程方面富集丰富,如对成纤维细胞生长因子刺激的反应、细胞内受体信号通路等,下调的差异表达基因主要在细胞粘附、运输囊泡等功能富集。气泡图显示,差异表达基因在信号通路富集明显,例如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、磷脂酰肌醇3 激酶(phosphatidylinositol 3 kinase,PI-3K)/ 蛋白激酶B(protein kinase B,PKB)-PI3K-Akt信号通路、低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)信号通路等。见表1、表2、图3。
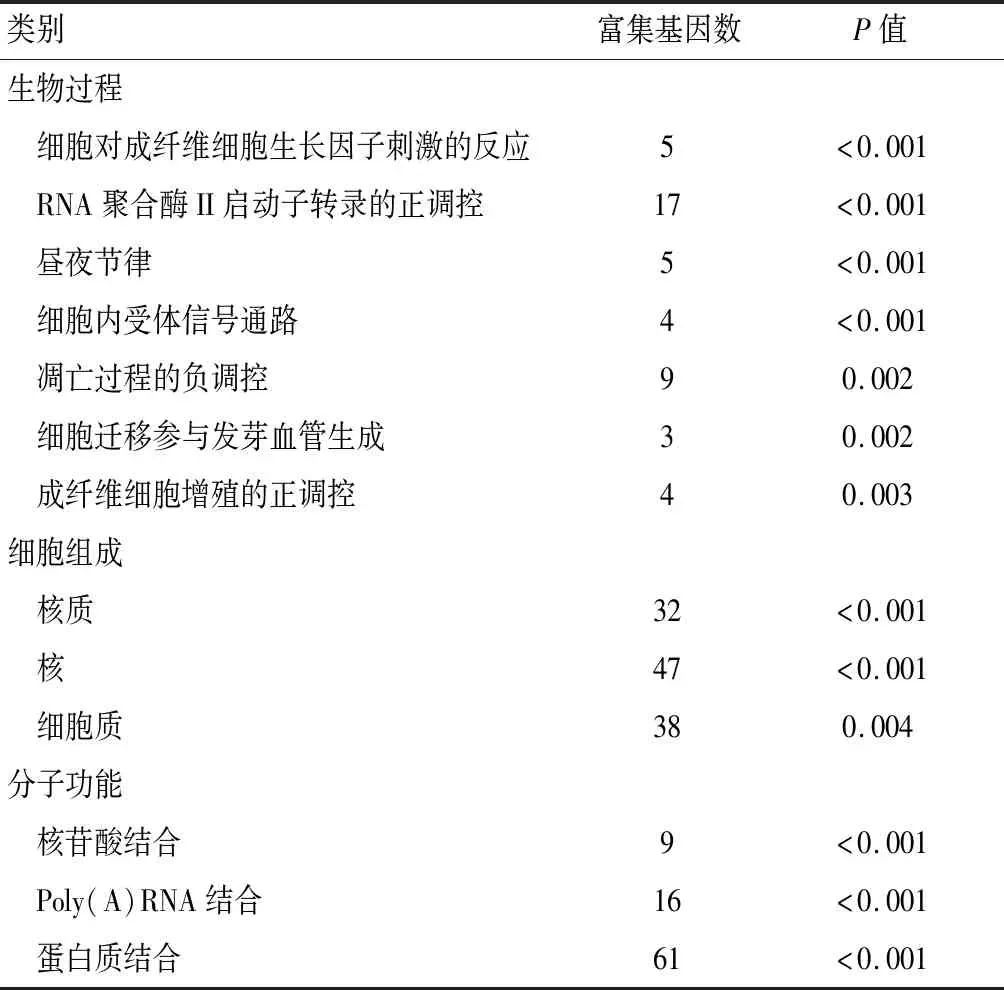
表1 上调差异表达基因的GO富集分析
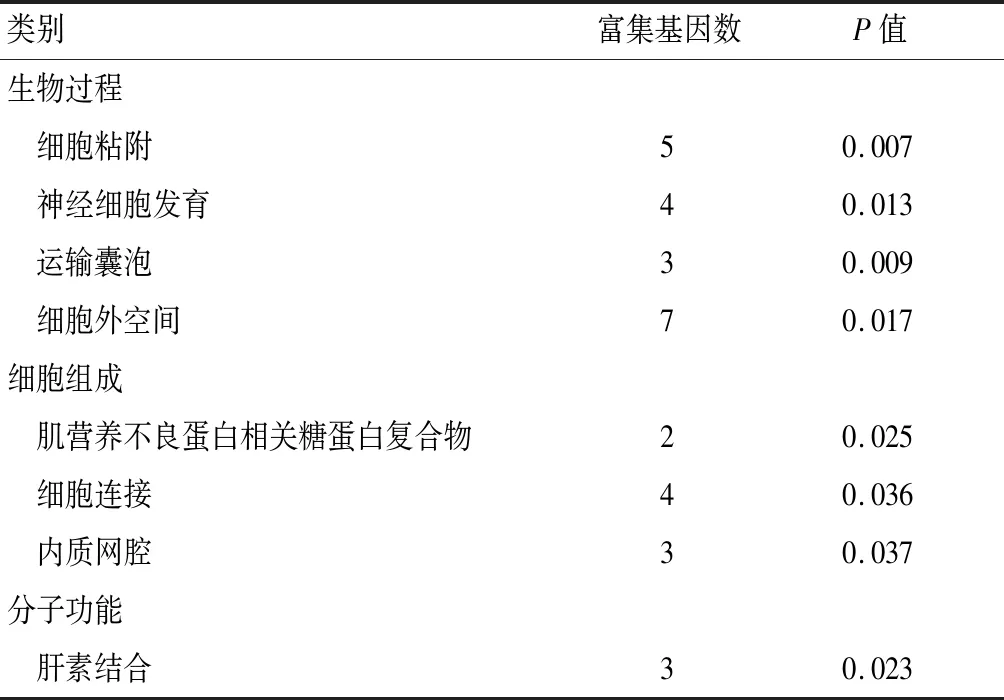
表2 下调差异表达基因的GO富集分析
2.3 PPI网络分析
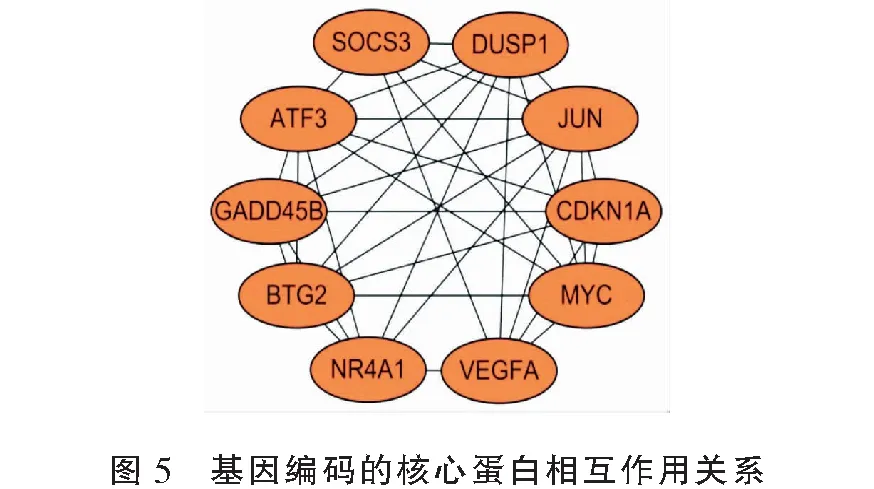
PPI网络图显示,有83个节点蛋白,248条相互作用关系。通过degree值筛选出排名前10的核心节点蛋白发现,编码这些蛋白的基因均表达上调,分别为JUN、VEGFA、ATF3、MYC、DUSP1、NR4A1、CDKN1A、BTG2、SOCS3、GADD45B。见图4、图5。

3 讨论
本研究综合两组高通量的基因芯片数据,筛选出OA滑膜组织中131个共同差异表达基因,通过分析其功能探讨OA发病的分子机制。从GEO数据库中可以看到,随着技术的完善与发展,基因表达谱芯片的类型繁多,各种芯片能检测的基因数及检测效力各不相同。即便是使用同种芯片多次对同类型样本进行检测,由于检测人员的操作以及分析过程带来的不可避免的批次差异,原始数据处理方式、质量控制标准和分析方法的不同,都会使检测结果不完全一样。因此,选择相同检测平台的数据集进行综合分析,所选出的共同差异表达基因在一定程度上排除了未知混杂因素的干扰,通过这些差异表达基因来研究疾病的发病机制可靠性更高。
从GO富集结果来看,上调的差异表达基因在细胞核和细胞质的组成成分方面富集,主要参与多种核苷酸结合以及蛋白质结合等分子功能,调节多种生物过程,其中昼夜节律、细胞内受体信号通路、细胞迁移参与发芽血管生成、成纤维细胞增殖的正调控、对机械刺激的反应、炎症反应的调节等都与OA的发病相关[3]。而下调的差异表达基因主要位于细胞器、细胞外基质的组成成分,调节细胞粘附、神经功能发育以及肝素结合等过程。
KEGG富集结果则提示了上调的差异表达基因通过MAPK、PI3K-Akt、HIF-1等通路参与OA的炎症过程及滑膜纤维化[4]。滑膜组织中的成纤维样滑膜细胞和巨噬细胞均在炎症的发生发展中发挥作用,促进炎症因子的产生与释放,导致关节的疼痛和硬化。MAPK与PI3K-Akt信号通路是经典的炎症信号通路,已被发现涉及多种疾病,它们对于调节OA的病理生理至关重要,其中的ERK、JNK信号传导途径还参与OA软骨细胞的增殖与凋亡以及病理性降解。在动物实验中发现,抑制PI3K-Akt信号传导可以减弱炎症反应,还能够阻止异常骨形成;而低氧诱导因子-1其亚基HIF-1α作为转录因子,可以调节促炎症细胞因子,HIF-1α的表达也与OA滑膜的增殖程度正相关。
蛋白相互作用网络则进一步解释了差异表达基因所编码蛋白的功能,基因编码的核心蛋白也参与OA的发生发展。OA患者的滑膜组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)水平升高,与OA的严重程度和疼痛相关[5]。VEGFA作为其家族成员,在诱导生理性和病理性血管生成方面至关重要。滑膜中血管生成的增加能刺激炎症反应,分泌炎性细胞因子,导致滑膜增生。靶向VEGF抑制其信号可以减缓OA进展,减少疼痛[6]。活化转录因子3(activating transcription factor 3,ATF3)参与细胞增殖和分化的调控。研究[7]提示,软骨细胞中表达的ATF3可能通过修饰NF-κB通路,调控炎性细胞因子诱导自身的表达及分泌,增强炎性细胞因子的产生,参与OA的发展,该基因可能成为治疗OA的新靶点。MYC基因是癌基因,包括C-myc、N-myc和L-myc。目前对MYC基因在OA中的作用研究较少,有一项大鼠实验[8]表示,用microRNA-24靶向C-myc基因,下调C-myc可以抑制细胞凋亡并促进软骨细胞的增殖,从而通过失活MAPK信号通路来防止OA的发生发展。MYC基因在滑膜组织中的作用还有待研究。
双特异性磷酸酶1(dual specificity phosphatase 1,DUSP1)被发现在OA的成纤维样滑膜细胞中具有保护作用,其过表达抑制了MAPK途径的激活以及OA相关介质的表达[9],这可能成为治疗OA的潜在靶点。而细胞信号传导因子3(suppressor of cytokine signaling 3,SOCS3)表达水平的升高在OA的发展中产生矛盾的影响[10]。SOCS3一方面可能通过抗炎作用以及抑制过度增生的软骨组织修复来减少炎症及骨赘的形成;另一方面有可能会延迟OA中软骨下松质骨损伤的修复。
综上所述,通过分析GSE55457和GSE55235这两组数据的共同差异表达基因,发现OA的发病机制不仅仅与细胞增殖、病理性血管生成、炎症刺激等方面有关,更是多信号通路、多靶点间相互作用的结果。这些差异表达基因(如VEGFA、DUSP1)可为深入解读OA的致病机理提供参考。
