丫蕊花皂苷P 的抗白色念珠菌活性研究
2021-05-13司马全曹林森徐贵丽
司马全,王 平,曹林森,徐贵丽
白色念珠菌(Candida albicans,CA)是一种普遍存在的条件性致病菌,也叫白假丝酵母。 白色念珠菌也是目前最主要发生侵袭性念珠菌感染的病原。 丫蕊花属(Ypsilandra Franch.)为百合科(Liliaceae Juss.)多年生草本植物,全草具有清热解毒等功效。甾体皂苷作为丫蕊花的主要活性成分,在近几年大量研究中发现其具有抗肿瘤、抗菌、止血等多种生理活性。本试验研究丫蕊花皂苷P 的抗白色念珠菌效果。
1 材料与方法
1.1 药物与试剂 丫蕊花皂苷P[1](ypsilandroside P,纯度≥97%),由解放军920 医院药学部临床微生物实验室前期制备,丫蕊花皂苷P 化学结构式见图1;氟康唑氯化钠注射液(fluconazole,FLC),辉瑞制药有限公司,批号:A490705; 注射用环磷酰胺(cyclophosphamide,CTX),百特国际有限公司,批号:6C105A。

图1 丫蕊花皂苷P 结构式
1.2 供试菌种 实验菌株标准菌株:CA(ATCCY0109和ATCCSC5314)采购自中国药品生物制品鉴定所。分离耐药菌株:CA 耐药菌(CA632、CA592、CA953、CA819、CA152、CA100、CA649、CA956), 均由第 920医院药学部临床微生物实验室提供。
1.3 实验动物 无特定病原体(SPF)级巴比赛(BALB/c)小鼠,雌性,6~9 w,18~22 g[昆明医科大学实验动物中心,实验动物生产许可证:SYXK(滇)K2015-0002]。 于实验室适应性饲养1 w 后再进行实验。
1.4 实验方法
1.4.1 药液制备 制备药液: 将丫蕊花皂苷P 以含10%二甲基亚砜的生理盐水作为溶剂,配置成浓度为4.096 mg/ml 的药液。 阳性药液的制备:将氟康唑用生理盐水配置为16 μg/ml 的药液以备用。
1.4.2 丫蕊花皂苷P 的最小抑菌浓度(MIC)的测定 参考CLSI 2017 版指南(CLSI:M07-A10, 2017)中微量液体培养基倍比稀释方法,测定丫蕊花皂苷P 对不同的白色念珠菌细胞的MIC 值。 重复3 次后数据取平均值。
1.4.3 最低杀菌浓度 (MBC) 的测定 确定MIC后,用接种环分别蘸取每个菌种MIC 值前3~5 个孔的培养液,转接种于相应的琼脂平板上,置于恒温培养箱中35 ℃培养24 h。 用活菌计数法检查琼脂平板上的菌落,菌落平均数<5 个最小药物浓度即为次药的MBC。
1.4.4 棋盘式微量稀释法[2]采用棋盘法测量丫蕊花皂苷P 是否与抗菌药物有联用效果。 将氟康唑与丫蕊花皂苷P 分别于96 孔板上的纵向和横向两个方向分别进行倍比稀释。 将培养板置于35 ℃培养箱中孵育18~24 h 观察结果。每组重复3 次后数据取平均值。 部分抑菌浓度及FICI 的计算方法参考文献[3-4]。
1.4.5 时间杀菌曲线法[5]采用时间- 杀菌曲线法进行试验,根据棋盘法所测定的FICI 的数值,选择结果为相加或协同作用的组合,进一步研究这种化合物和其他抗菌药之间联合的一种动态联合杀菌作用。 根据棋盘法实验测定的各药单用及联用MIC 设置各组用药浓度。 每组重复3 次后数据取平均值。 判断标准:如两药联合后,与单用效果最好组比较,降低值>2 log10CFU/ml,则认为二者有协同作用;降低值为1~2 log10CFU/ml,则认为二者为相加作用;降低或增加值为1 log10CFU/ml,则认为二者为无关作用;若两药联合使用后增加值大于1 log10CFU/ml,则认为两药有拮抗作用。
1.4.6 侵袭性白色念珠菌感染模型的建立与评估[6]巴比赛小鼠随机分为环磷酰胺组和生理盐水组,每组10 只、环磷酰胺组给药方案为:每日腹部注100 mg/kg 环磷酰胺,连续3 d 进行免疫抑制;生理盐水组则腹腔注射同剂量的生理盐水作为对照。以第1 d 和第4 d 的体重,外周白细胞数,脾脏体重系数作为指标,判断免疫抑制模型建立是否成功。
脾脏体重系数=脾脏重量/体重×100(mg/10 g)
1.4.7 丫蕊花皂苷P 给药生存率评价 免疫抑制小鼠随机划分为8 组: 免疫抑制组、 感染对照组﹑FLC 0.5 mg/kg 组﹑1 mg/kg 组﹑2 mg/kg 组、丫蕊花皂苷 P 0.5 mg/kg 组、1 mg/kg 组、2 mg/kg 组(n=10)。 每只小鼠侧尾静脉注射0.2 ml 浓度为1×107CFU/ml的菌悬液, 建成侵袭性白色念珠菌感染小鼠模型。感染2 h 后,分组灌胃给药,每天0.1 ml,免疫抑制组和感染对照小鼠给予等量生理盐水, 连续5 d 给药,观察12 d 后小鼠的死亡状况,绘制生存曲线。
1.4.8 白色念珠菌感染小鼠脏器菌落计数[7]将免疫抑制模型小鼠随机分为7 组:感染对照组﹑FLC 0.5 mg/kg 组﹑1 mg/kg 组﹑2 mg/kg 组、 丫蕊花皂苷 P 0.5 mg/kg 组、1 mg/kg 组、2 mg/kg 组。 侵袭性白色念珠菌感染小鼠模型连续给药5 d 后脱颈处死各组小鼠(n=6),立即取心脏、肝脏、肾脏并称重后用无菌玻璃匀浆器匀浆后用0.9%生理盐水不同稀释倍数稀释后取匀浆液30 μl 涂布于沙氏琼脂培养基培养板上, 每个样品平行3 块板,35 ℃恒温培养箱中静止培养24 h 后取出进行计数。
2 结果
2.1 丫蕊花皂苷P 的MIC 和MBC 及与氟康唑联合用药的效果评价 丫蕊花皂苷P 对白色念珠菌标准菌(CAY0109、CASC5314)及耐药菌(CA632、CA592、CA953、CA819、CA152、CA100、CA649、CA956)的 MIC值分布为 2~4 μg/ml,MB (F)C 值分布为 4~8 μg/ml,见表1。 棋盘法测定结果见表2。
2.2 时间杀菌曲线 根据棋盘法试验结果, 测试丫蕊花皂苷P 单用、与氟康唑联合用药及氟康唑单用对用棋盘法所筛选出的菌株的抗菌效果。 结果见图 2(A、B、C)。
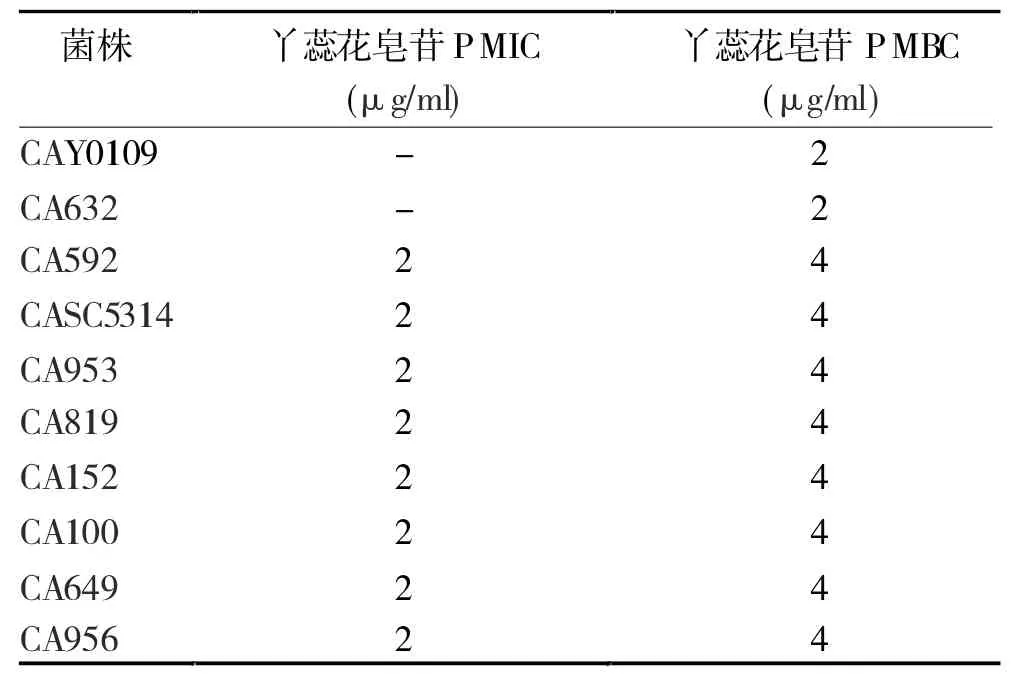
表1 丫蕊花皂苷P 单用对10 种菌株的MIC/MB(F )C 值(n=3)
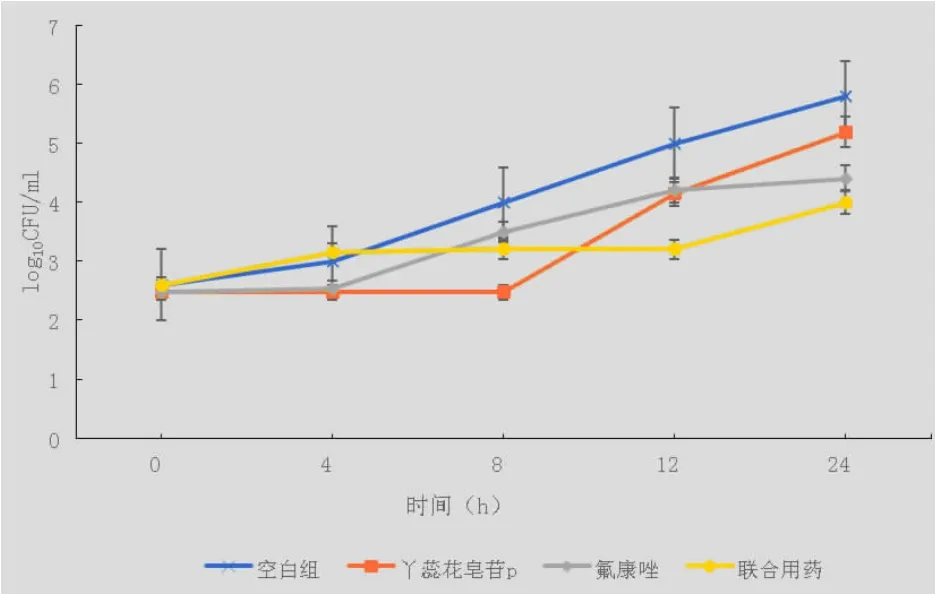
图2A 丫蕊花皂苷P 与氟康唑抗CAY0109 时间杀菌曲线
2.3 体内抗菌实验结果
2.3.1 侵袭性白色念珠菌感染模型的建立与评估
连续3 d 腹腔注射100 mg/kg 环磷酰胺免疫抑制后,各组小鼠体重、白细胞数、脾脏系数如表3、4所示。

图2B 丫蕊花皂苷P 与氟康唑抗CA632 时间杀菌曲线
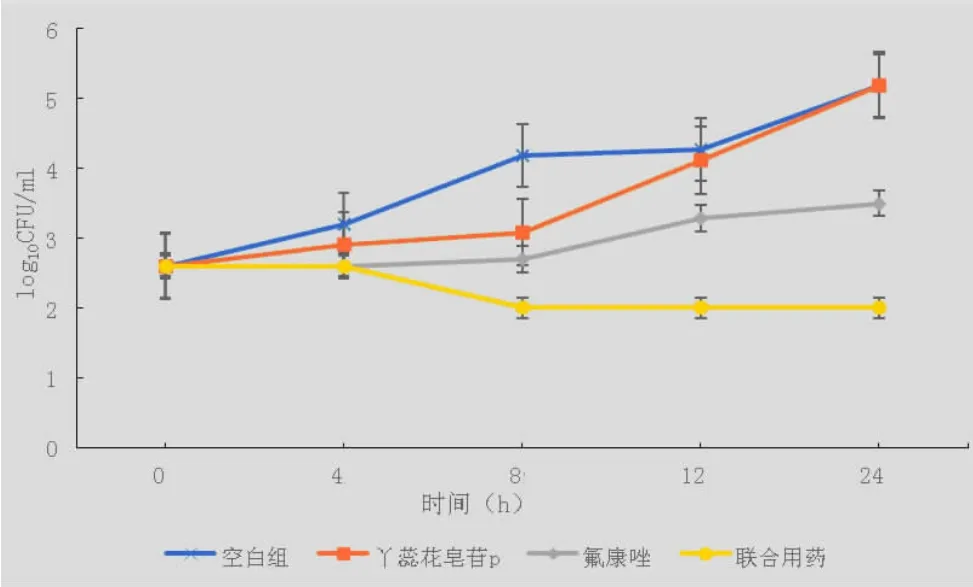
图 2C 丫蕊花皂苷P 与氟康唑抗CA152 时间杀菌曲线
2.3.2 丫蕊花皂苷P 给药治疗白色念珠菌感染小鼠疗效观察 白色念珠菌感染小鼠分组进行给药治疗后生存曲线见图3。
2.3.3 白色念珠菌感染小鼠给药治疗后脏器菌落计数 白色念珠菌感染小鼠给药治疗后脏器菌落计数结果见图 3(A、B、C)。
3 讨论
目前的研究表明,白色念珠菌耐药性和其机理可能由于靶酶基因突变或表达、药物外排泵基因过表达、真菌细胞膜的通透性变化,使药物很难进入细胞。 许多研究表明,一些从中药提取的单体化合物,可以通过抑制药物外排泵基因表达,诱导真菌细胞内的活性氧上升,损伤真菌细胞壁或细胞膜的结构,从而达到抑菌作用[8]。
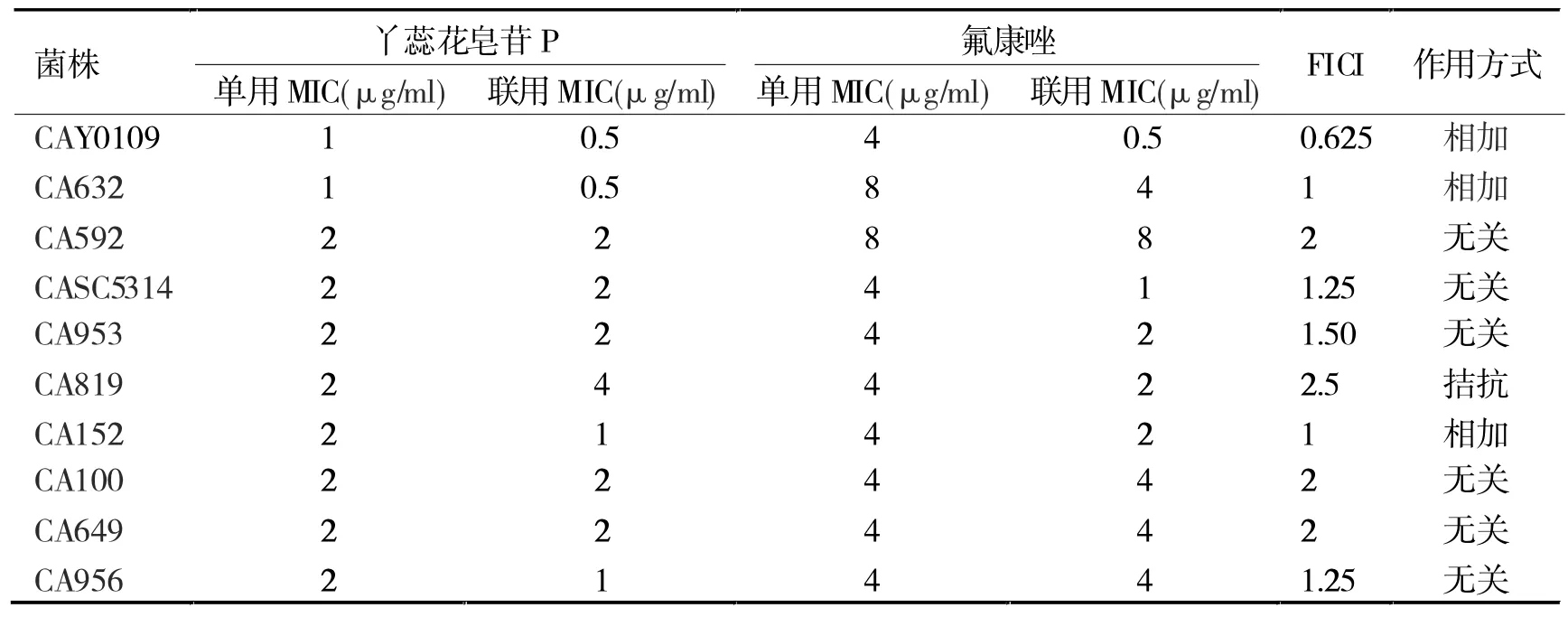
表2 棋盘式微量稀释法测定丫蕊花皂苷P 与氟康唑联用结果(n=3)
表3 小鼠侵袭性白色念珠菌感染模型体重与白细胞数(,n=10)

表3 小鼠侵袭性白色念珠菌感染模型体重与白细胞数(,n=10)
注:与CTX组第1 d 比较,①P < 0.01
生理盐水组第1 d 19.6±0.5 8.01±0.09 CTX 组第 1 d 19.4±0.6 7.98±0.12生理盐水组第4 d 19.8±0.4 8.02±0.11 CTX 组第 4 d 16.8±0.5 2.53±0.52
表4 小鼠侵袭性白色念珠菌感染模型脾脏系数(? s,10)n=

表4 小鼠侵袭性白色念珠菌感染模型脾脏系数(? s,10)n=
注:与生理盐水组比较,①P < 0.01
组别 脾脏系数

图3 小鼠给药治疗后生存曲线(n=10)

图4A 白色念珠菌感染小鼠给药治疗后心脏菌落计数

图4C 白色念珠菌感染小鼠给药治疗后肾脏菌落计数
本实验研究了丫蕊花皂苷P 抗多个白色念珠菌菌株的活性。棋盘法结果见表2,丫蕊花皂苷P 与氟康唑联用时,对菌株Y0109、632 及152 有协同作用。 时间杀菌曲线结果如图2A,丫蕊花皂苷P 与氟康唑抗CAY0109 结果表明,12 h 时联合用药与对照组相比,菌浓度 log10 CFU/ml 降低值>1,表明联合用药有显著相加作用;如图2B,丫蕊花皂苷P 与氟康唑抗CA632 结果表明,12 h 时联合用药与对照组相比,菌浓度 log10 CFU/ml 降低值>2,表明联合用药有显著相协同作;如图2C,丫蕊花皂苷P 与氟康唑抗CA152 结果表明,24 h 时联合用药组与单用组相比,菌浓度log10 CFU/ml 降低值>2,故两者联合用药有协同作用。其中两者联合抗CAY0109 和抗CA632 的效果于12 h 左右最佳,而后随时间增长抗菌效果也逐渐消失,这可能是由于联合抗菌用药浓度较低导致。 且丫蕊花皂苷与P 氟康唑联用时的氟康唑MIC 均比氟康唑单用时的MIC 有所降低,说明丫蕊花皂苷P 有一定的抗耐药效果。
侵袭性白色念珠菌感染模型建立实验结果显示: 连续3 d 腹腔注射100 mg/kg 环磷酰胺免疫抑制后, 环磷酰胺组小鼠的体重与第1 d 相比显著减轻(P< 0.01),而生理盐水小鼠的第4 d 和第1 d 相比没有明显的体重差异, 见表4; 小鼠白细胞数(white blood cell,WBC )结果显示,环磷酰胺组小鼠的白细胞数在第4 d 和第1 d 相比明显减少(P<0.01),而生理盐水组小鼠第4 d 与第1 d 相比白细胞数与无显著性差异;脾脏的体重系数结果见表5,第4 d环磷酰胺组和生理盐水组的脾脏重量系数比,前者脾脏的体重系数明显下降(P< 0.01)。 参照文献[8],小鼠的白细胞数连续3 d 下降70%, 表明免疫抑制的成功,即连续3 d 每日腹腔注射环磷酰胺100 mg/kg可以成功地对小鼠实施免疫抑制。
体内实验结果表明各组小鼠中位生存时间分别为:感染对照组 5 d﹑FLC 0.5 mg/kg 组 7 d﹑FLC 1 mg/kg 组 10 d、丫蕊花皂苷 P 0.5 mg/kg 组 5 d、丫蕊花皂苷P 1 mg/kg 组6 d、丫蕊花皂苷P 2 mg/kg 组8 d。与感染对照组相比,FLC 0.5 mg/kg 组和FLC 1 mg/kg组小鼠生存率提高、中位生存时间延长,均具有统计学差异(P< 0.01);丫蕊花皂苷P 各组小鼠的中位生存时间均较感染对照组有所延长,但只有丫蕊花皂苷P 2 mg/kg 组小鼠的中位生存时间差异有统计学意义(P<0.05)。 实验结果说明丫蕊花皂苷P 在体内具有抗白色念珠菌活性。
在脏器菌落计数实验结果显示, 给药治疗后,各脏器中1 mg/kg FLC 及2 mg/kg FLC 组的菌落数与对照组相比显著下降,且差异随给药剂量的增大而增大。 在肝脏中3 个剂量浓度的丫蕊花皂苷P 与对照组相比,差异无统计学意义(P> 0.05),在心脏和肾脏中只有2 mg/kg 丫蕊花皂苷P 与对照组相比菌落数降低(P< 0.01)。
白色念珠菌耐药却是一种复杂的多因素作用过程,它涉及到多个因素的参与,丫蕊花皂苷P 具体的抗菌机制还需进一步深入研究。
