一氧化氮对鱼藤酮诱导神经细胞损伤的调节作用
2021-05-13孙悦赵艳春张婷葛文文王铁鹏
孙悦,赵艳春,张婷,葛文文,王铁鹏
(石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832000)
帕金森氏症(Parkinson’s Disease,PD)是由于环境或遗传原因导致的中脑黑质区退行性疾病,表现为多巴胺能神经元丢失,引起手足颤抖、僵硬、动作缓慢、站立不稳等表现。帕金森氏症一般在50岁后发病,发病风险随着年龄增长而升高,已成为困扰人类的第二大神经退行性疾病[1]。
一氧化氮(Nitric oxide,NO)是引发帕金森氏症的重要致病性介质[2],主要通过硝化应激效应导致神经细胞损伤及神经系统病变。PD发生伴随炎症反应,病变组织中激活的神经胶质细胞中可诱导iNOS(Inducible nitric oxide synthase)生成,产生大量一氧化氮,作用于周边神经元,发生硝化应激[3]。通过解剖PD病人组织样本发现,NO与PD发病的过程关系非常密切[4]。在使用天然毒素鱼藤酮等制备的大鼠、小鼠等PD动物模型中,也体现出NO的重要作用[4-5]。
鱼藤酮处理SH-SY5Y细胞是构建PD神经细胞模型的最常用方法之一,该模型可以模拟出含α-突触核蛋白(α-synuclein)等成分的路易小体类似物,与PD细胞病理表现相似而被较广泛地使用[6]。那么,在鱼藤酮诱导的SH-SY5Y细胞中,是否能够产生NO,NO的存在对于PD细胞模型是否必要呢?一些文献对此进行了报道,但报道不统一,甚至有些矛盾。Yin等报道,鱼藤酮处理致使神经元去极化,可诱导神经细胞NMDAR受体开放,内流的钙离子引起nNOS激活,产生NO[7]。但是在SH-SY5Y细胞中,NMDAR受体的亚基表达不足,可能无法形成有功能的钙离子通道,因而,鱼藤酮可能无法通过神经元中的经典途径诱导NO生成[8]。
鱼藤酮处理的SH-SY5Y细胞体系中能否产生一氧化氮,一氧化氮对于鱼藤酮诱导的细胞损伤模型是否具有显著的调节作用等问题尚不明确。本工作对这一问题展开研究,以期对鱼藤酮诱导的PD细胞系模型中一氧化氮的作用加以确认。
1 材料与方法
1.1 材料
SH-SY5Y细胞购自中国典型培养物武汉大学保藏中心细胞库;DMEM高糖培养基、胰蛋白酶(含EDTA)、青霉素-链霉素混合液购自Gibco;胎牛血清购自Biological Industries;鱼藤酮、Hoechst 33342、MTT、DMSO购自Sigma;硝酸纤维素膜购自PALL;丽春红S购自Merck;Tyrosine Hydroxylase抗体购自Millipore;α-synuclein抗体购自Santa Cruz;GAPDH抗体购自Bioworld;化学发光试剂盒购自Thermo Fisher;蛋白酶抑制剂Cocktail、BCA蛋白定量试剂盒购自北京普利莱基因技术有限公司;NO检测试剂盒购自碧云天生物技术有限公司;Dopamine ELISA Kit购自Elabscience;Mito Tracker Red CMXRos购自Molecular Probes;其他生化试剂为国产分析纯。
1.2 方法
1.2.1 细胞培养及药物处理
SH-SY5Y细胞培养采用含10%胎牛血清的高糖DMEM培养基,添加100 U·mL-1青霉素和100 μg·mL-1链霉素,细胞传代采用0.25%胰酶消化细胞,以完全培养基终止消化。细胞接种24 h左右,根据不同条件进行刺激。鱼藤酮及GSNO采用完全培养基溶解,刺激细胞时采取全换液的方式进行。
1.2.2 细胞活力检测MTT
96孔板各孔接种4×104SH-SY5Y细胞,37 ℃,5% CO2培养箱中培养24 h后施加不同条件进行处理。刺激结束后,各孔加入20 μL MTT(终浓度为0.5 g·L-1),培养箱中避光孵育3 h。各孔弃除培养基,加入200 μL DMSO,摇床震荡15 min,使结晶充分溶解。将96孔板置于酶标仪中,读取565 nm波长处吸光度值A值,空白孔加入相同体积DMSO为培养板本底对照。
1.2.3 一氧化氮含量检测
传代细胞接种于6孔板中,37 ℃、5%CO2培养24 h。各组细胞经不同条件处理后,弃除培养基,用Locke’s缓冲液洗细胞2次后,加入细胞裂解液,冰上裂解细胞20 min。14000 g离心20 min,取上清,BCA试剂盒对细胞抽提物进行蛋白定量。按照检测试剂盒步骤,避光条件下在96孔板各孔加入50 μL试剂Ⅰ和试剂Ⅱ,再加入150 μL检测样品,混匀,于酶标仪540 nm处读取吸光度值,按照既定公式计算NO含量。
1.2.4 细胞核染色
DNA染料Hoechst 33342(5 μg·mL-1)采用完全培养基(含10% FBS)配制。细胞接种于6孔板中,经不同条件处理后吸尽培养基,加入DNA染料标记10 min。使用Locke’s缓冲液清洗细胞2次,冰甲醇固定细胞30 min,弃去固定液。培养皿中加入1 mL Locke’s液,于荧光显微镜下观察、拍照。
1.2.5 Western Blot
采用RIPA裂解液(包含蛋白酶抑制剂Cocktail)破碎细胞提取蛋白,使用BCA蛋白定量试剂盒检测蛋白浓度,采用SDS-聚丙烯酰胺凝胶电泳分离蛋白质,每个泳道上样量为20 μg。采用湿转法,恒压(80 V)条件将蛋白转印至硝酸纤维素膜上。丽春红S染色观察条带位置后进行裁膜,1×TBST洗脱后使用5%脱脂奶粉室温封闭2 h,1×TBST清洗NC膜2次,一抗4 ℃条件下孵育过夜。次日,1×TBST洗NC膜4次,每次10 min。二抗室温孵育NC膜2 h,1×TBST洗膜4次,每次10 min。NC膜上滴加化学发光液,使用Fluo Chem HD-2 成像仪采集图片并进行定量分析。
1.2.6 多巴胺含量检测
细胞接种于100 mm直径培养皿中,经不同条件处理后,用Locke’s液清洗细胞2次,胰蛋白酶消化,1 000 r·min-1离心5 min收集细胞。使用预冷Locke’s再次清洗细胞3次,加入蛋白酶抑制剂Cocktail,超声破碎细胞后离心(1500 g,10 min),收集上清。细胞内多巴胺水平的检测按照DA酶联免疫吸附测定(ELISA)试剂盒说明书进行,酶标仪450 nm波长处读取吸光度值,根据标准品不同浓度DA结果绘制标准曲线,计算样品中实际多巴胺浓度。
1.2.7 细胞膜电位检测
接种于培养皿的SH-SY5Y细胞经不同条件处理后,加入Mito Tracker Red染色液(10 mmol·L-1),于37 ℃培养条件下染色30 min。Locke’s缓冲液清洗细胞2次,使用预冷甲醇室温固定细胞30 min。弃去固定液,DNA染料标记10 min,Locke’s缓冲液清洗细胞2次,加入1 mL Locke’s液,荧光显微镜(汞灯绿色激发光通道)下观察、采集图片,红色荧光越强,代表细胞膜电位越高。
1.2.8 数据分析
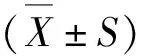
2 结果与分析
2.1 鱼藤酮处理SH-SY5Y细胞的剂量和时间效应
为了摸索鱼藤酮处理SH-SY5Y细胞的合适浓度,我们采用不同浓度的鱼藤酮处理细胞24 h,用MTT法检测不同条件下鱼藤酮对细胞活力的影响(图1A)。结果显示,随着鱼藤酮浓度增高,神经细胞活力逐渐降低,100 nmol·L-1浓度时,细胞活力下降到对照组的56.52%。接着,采用100 nmol·L-1鱼藤酮处理SH-SY5Y细胞不同时间,检测鱼藤酮对神经细胞毒性作用的时间曲线,结果显示,处理12 h后,细胞活力显著降低,处理24 h时,细胞活力为对照组65.08%(图1B)。由此,确认100 nmol·L-1鱼藤酮处理SH-SY5Y细胞24 h为较合适的实验条件。
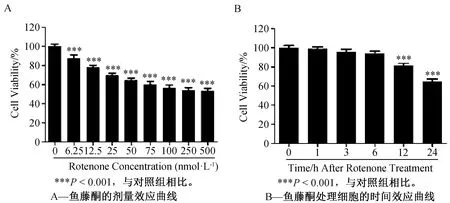
图1 鱼藤酮处理SH-SY5Y细胞的浓度和时间效应
2.2 鱼藤酮细胞模型中一氧化氮毒性及含量检测
鉴于文献中关于采用一氧化氮合酶(Nitric Oxide Synthase,NOS)抑制剂可以保护鱼藤酮诱导的大鼠PD模型的报道[9],我们采用广谱型NOS抑制剂L-NAME(L-nitro-arginine-methylester)及神经型NOS(neuronal NOS)特异性抑制剂7-NI(7-nitroindazole)处理细胞,验证其是否能够保护鱼藤酮诱导的神经细胞毒性。L-NAME的使用浓度为200 μmol·L-1,7-NI的使用浓度为100 μmol·L-1。结果如图2A所示,单独的L-NAME及7-NI对神经细胞均没有毒性;鱼藤酮处理组细胞活性显著降低;但是,在鱼藤酮处理下,无论是广谱型NOS抑制剂L-NAME还是神经细胞特异性抑制剂7-NI均未表现出对鱼藤酮细胞毒性的显著保护作用。针对鱼藤酮是否可以诱导SH-SY5Y细胞生成NO的问题,我们采用一氧化氮检测试剂盒,并以外源性一氧化氮供体 GSNO(500 μmol·L-1)作为阳性对照,分别检测了100 μmol·L-1鱼藤酮处理SH-SY5Y细胞1、6、9、12、16、24 h条件下神经细胞内NO水平,检测结果显示,上述各时间点与对照组相比,均未能显著提升细胞内的一氧化氮水平(图2B)。结果表明,在鱼藤酮处理的SH-SY5Y神经细胞中一氧化氮并没有发挥主要作用。
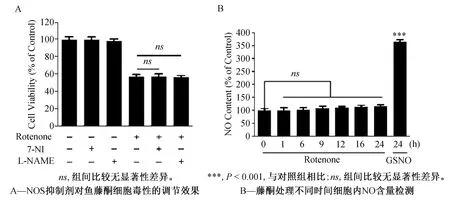
图2 鱼藤酮处理SH-SY5Y细胞中一氧化氮功能及含量检测
2.3 外源性一氧化氮剂量的确认
外源性一氧化氮剂量的确认结果见图3。
***,P<0.001,与对照组相比;ns,无显著性差异,与单独鱼藤酮处理组相比;#,P<0.05,与单独鱼藤酮处理组相比;##,P<0.01,与单独鱼藤酮处理组相比。
鉴于在帕金森氏症病变过程中,神经元接受的NO信号刺激主要来自于周边的胶质细胞(小胶质细胞及星形胶质细胞)中iNOS生成的NO,即神经细胞受到细胞外高浓度NO的刺激,我们尝试通过在鱼藤酮诱导的SH-SY5Y细胞中添加外源性NO供体(GSNO)的方式,研究NO对该PD细胞模型的调节作用。通过在鱼藤酮处理模型中添加不同浓度GSNO进行细胞活力摸索,发现GSNO浓度达到500 μmol·L-1以上时,细胞活力降低较为明显(图3),因此确定在后续实验体系中采用100 nmol·L-1鱼藤酮结合500 μmol·L-1GSNO的处理浓度刺激24 h作为研究条件,此时细胞MTT活力降低至对照组48.14%。
2.4 一氧化氮对鱼藤酮模型细胞形态的影响
为了验证加入外源NO对鱼藤酮毒性模型的影响,我们首先检测了GSNO与鱼藤酮联合处理16 h对细胞可见光形态及细胞核DNA形态的影响。结果显示,单独的鱼藤酮可引起细胞损伤,损伤细胞的DNA浓缩、高亮比例增加,损伤细胞的胞体先变圆后脱落,并未有“肿胀”的表现(图4)。GSNO单独处理组和联合处理组中,细胞核DNA浓缩比例比单独鱼藤酮组略有增加,但胞体形态呈现膨胀、细胞核凸出等较典型的“胀亡”形态(图4)。上述结果表明,一氧化氮的加入,使鱼藤酮处理的神经细胞系死亡模式发生了显著改变,转为坏死模式。
2.5 一氧化氮对鱼藤酮模型多巴胺合成的影响
多巴胺分泌不足及多巴胺能神经元死亡导致黑质向纹状体神经投射信号减弱,是帕金森氏症发生的直接原因[10]。酪氨酸羟化酶(Tyrosine Hydroxylase,TH)是合成神经递质多巴胺的限速酶,该酶的表达在PD病人或动物模型中显著降低[11]。鱼藤酮处理的SH-SY5Y细胞中,酪氨酸羟化酶的表达情况及加入外源性NO供体共处理后,酪氨酸羟化酶的表达是否会有进一步改变目前尚未明确。我们的实验结果表明,单纯100 nmol·L-1鱼藤酮处理细胞后,酪氨酸羟化酶的蛋白表达并未发生显著改变,NO处理组的酪氨酸羟化酶明显降低至对照组的85.16%,鱼藤酮与NO联合处理组的酪氨酸羟化酶下降水平更加明显,降低到对照组的78.52%(图5A)。结果表明,外源性NO对于酪氨酸羟化酶蛋白表达的调节作用比鱼藤酮要更加显著。于此同时,我们检测了不同刺激条件下,神经元中神经递质多巴胺的含量,结果显示鱼藤酮组的DA含量降低至对照组56.04%左右,单独的NO处理也能显著降低DA含量(至对照组78.92%),而联合刺激组的DA降低最显著,降低至对照组的32.32%(图5B)。
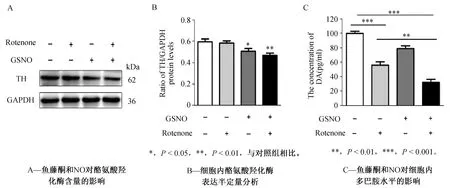
图5 鱼藤酮和一氧化氮对酪氨酸羟化酶及多巴胺含量的影响
2.6 一氧化氮对鱼藤酮模型线粒体膜电位的影响
基于细胞和动物模型的研究表明,线粒体异常所致供能障碍是PD神经元病变的主要诱因之一[6-7],供能不足最直接的影响之一是导致线粒体膜电位(Mitochondrial membrane potential,MMP)降低。经典的PD造模剂,如MPTP(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine)、6-羟多巴胺、鱼藤酮、百草枯等均通过抑制线粒体呼吸链I介导PD模型神经细胞的损伤[6-7]。多巴胺能神经元线粒体膜电位降低是PD疾病模型的经典指标,也是介导神经元死亡的重要因素[12],我们采用线粒体膜电位探针Mito Tracker Red CMXROS对细胞进行标记[13],并检验了不同刺激组别中线粒体膜电位的改变。
结果显示,对照组荧光色度最强,表明线粒体膜电位水平较高,鱼藤酮处理组与对照组相比发生了明显的膜电位下降,GSNO组处理也能显著降低细胞膜电位,联合处理组细胞的线粒体膜电位降低幅度最大,对细胞损伤最为严重(图6)。
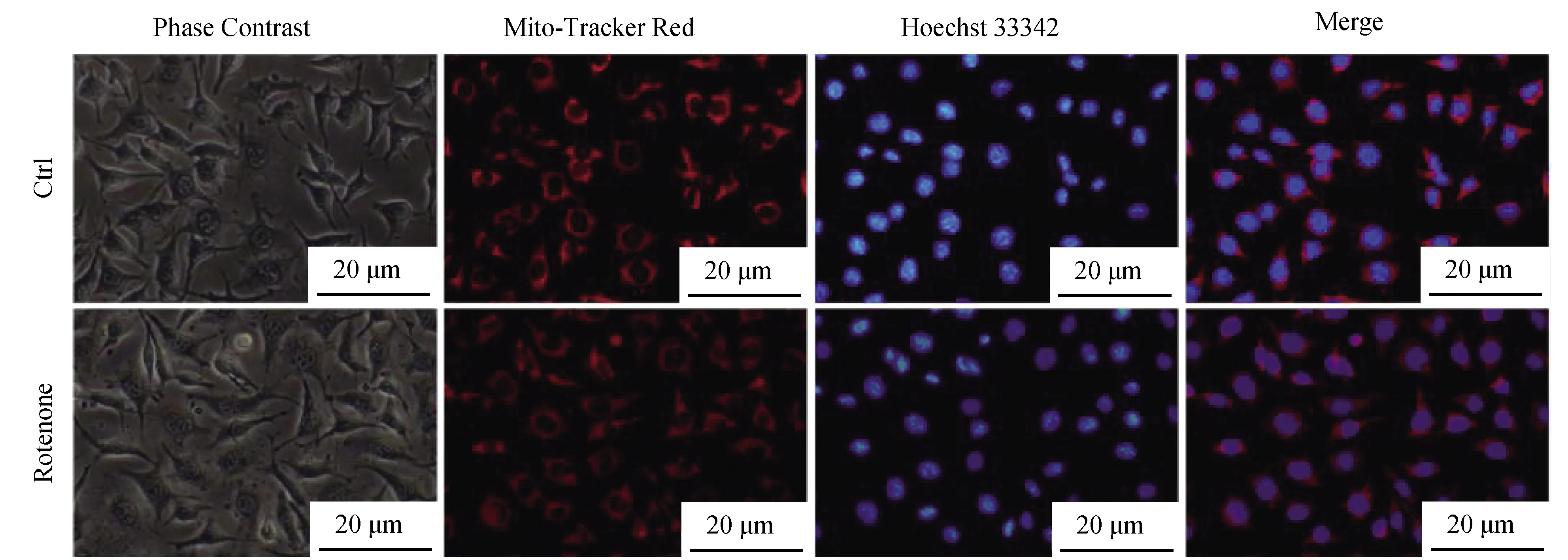
图6 鱼藤酮及一氧化氮处理对神经细胞线粒体膜电位的影响
2.7 一氧化氮对鱼藤酮模型α-突触核蛋白含量的影响
路易小体的形成是PD病理检测中的重要特征性指标[14],路易小体的形成主要源自α-突触核蛋白表达的异常增高及无规则缠结。我们检测了鱼藤酮处理下及NO联合处理下神经细胞中的α-突触核蛋白含量。结果显示,鱼藤酮处理后,细胞内α-突触核蛋白含量明显增加至对照组的117.97%,而加入GSNO处理也能显著增加α-突触核蛋白表达水平(至对照组130.54%),联合处理组的蛋白上调作用最显著(至对照组137.67%),(图7)。联合处理组中α-突触核蛋白表达水平的升高表明,一氧化氮共处理可以使单纯鱼藤酮刺激模型更接近帕金森氏症神经元病变的真实情况。
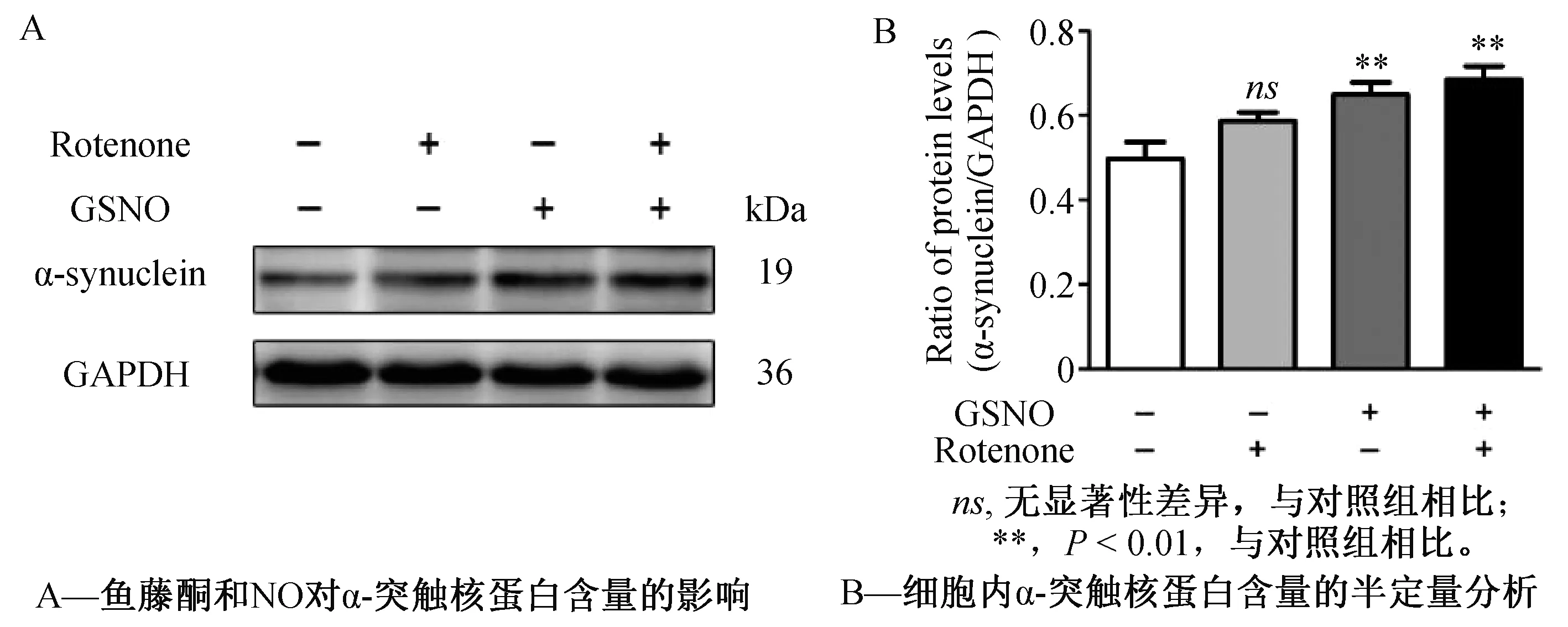
图7 鱼藤酮和一氧化氮对α-突触核蛋白含量的影响
3 讨论
一氧化氮在帕金森氏症多巴胺能神经元的退变过程中扮演重要角色,对于神经元而言,其接受的一氧化氮刺激,主要有两个来源。首先,一氧化氮来源中脑病变组织中的神经元细胞内nNOS被激活而生成[15];其次,PD的发生始终伴随着炎症反应,病变组织中的小胶质细胞和星形胶质细胞中的iNOS被激活,释放比神经元中nNOS来源更高浓度的NO。由于NO有较好的跨膜特性,很容易到达神经元细胞内介导神经毒性作用[16]。相对于神经元细胞内生成的NO,来自胶质细胞的“外源性”NO浓度更高,毒性作用更强,这种作用机制也为PD细胞模型中加入外源性NO供体GSNO提供了病理学支持。
已有的报道表明,NO在帕金森氏症神经元损伤中主要通过抑制线粒体呼吸链活性、cGMP途径、可逆的亚硝基化修饰途径、不可逆的ONOO-及硝基化修饰方式对神经细胞产生毒性作用[17]。DEHMER等人[18]的研究显示,缺乏iNOS的模型动物,PD无法造模或受到显著影响;CHALIMONIUK等[19]报道,NO通过cGMP途径介导PD损伤;NAKAMURA等[20]在综述中介绍了NO通过对多个蛋白靶点的亚硝基化修饰机制参与了PD的病变过程。PD疾病发生中,NO的其他毒性机制,还在进一步探讨和发掘中。
鱼藤酮诱导神经细胞凋亡作为PD常用的细胞模型已经应用多年,但其中是否体现了NO的作用,缺少详实的实验证据。我们通过实验发现,使用100 nmol·L-1的鱼藤酮处理SH-SY5Y细胞不同时间,细胞活力明显降低,但内源性NO均不出现显著提升(图1、图2A),并且使用广谱型NOS抑制剂L-NAME或者神经型NOS特异性抑制剂7-NI均不能有效保护神经细胞(图2B),这与临床及动物实验研究中关于抑制NOS保护PD的事实有较明显的差距,表明鱼藤酮处理SH-SY5Y的细胞模型并不能有效模拟PD机制中NO的作用。因此,通过引入外源性NO,改善鱼藤酮诱导的PD细胞模型,具有必要性。
鱼藤酮诱导的SH-SY5Y细胞不能产生显著的NO,可能由以下原因造成。神经元内源性NO的生成主要通过细胞膜上NMDAR受体开放,钙离子内流激活nNOS来生成。但是,在SH-SY5Y细胞中NMDAR受体亚基的表达不完善,不能形成功能化的钙离子通道,因而抑制了神经型一氧化氮合酶的活性[8,21]。此外,在PD病理状态下,作用于神经元的NO更多来自于周围胶质细胞iNOS产生的高浓度NO,因此在神经细胞PD模型中通过加入胶质细胞诱导的条件性培养基[22]或外源性NO[23],才能更好的模拟体内中脑神经细胞死亡的客观过程。神经细胞损伤后形态变化、酪氨酸羟化酶蛋白水平、多巴胺递质含量、线粒体膜电位、α-突触核蛋白含量等是表征PD造模的经典指标[6,11,14],在鱼藤酮诱导的细胞模型中引入外源性NO之后,我们通过检测上述指标,描述一氧化氮对鱼藤酮造模的调节作用。
从细胞形态上看,单独的鱼藤酮刺激组损伤细胞呈现先变圆再脱落的类凋亡样形态改变;鱼藤酮与NO联合处理组,损伤细胞从刺激后6 h开始出现胞体“胀大”的类坏死样死亡模式,即NO的加入改变了神经细胞的死亡模式(图4)。关于鱼藤酮诱导神经细胞损伤的机制,目前的研究报道集中于其通过抑制线粒体呼吸链I,导致大量活性氧自由基产生,引发氧化应激损伤神经细胞,具体的损伤途径涉及PI3K、AKT、GSK-3β、CREB等不同分子的信号传递过程[24-25]。一氧化氮阻止凋亡但诱导细胞走向坏死等损伤模式可能源于一氧化氮使酶活中心的保守半胱氨酸残基发生亚硝基化修饰,抑制凋亡通路中caspase家族水解酶(caspase3、caspase9等)的活性[26]。YOUNG等[27]报道鱼藤酮处理的PC12神经细胞以凋亡形式溃变;HE等[28]报道,NO处理的SH-SY5Y细胞以坏死的形式退行,PERIER等[29]报道,在临床PD病人的神经元死亡表现出坏死的趋势。这些报道佐证了我们的实验结果,也表明鱼藤酮处理体系中加入NO是能够更好地模拟PD病变的建模方式。
神经递质多巴胺合成减少及多巴胺能神经元退行是临床PD病人最明显的病理特征[10-11]。我们发现,在采用一氧化氮联合鱼藤酮处理神经细胞后,能够更显著地下调胞内多巴胺合成限速酶(酪氨酸羟化酶)的含量,明显减低神经细胞内多巴胺水平,比单纯鱼藤酮处理能更加贴切地模拟PD病理特征(图5)。一氧化氮诱导酪氨酸羟化酶(TH)含量降低的具体机制尚未见文献报道,但神经退行性病变的发生与神经炎症并行,诱导型一氧化氮合酶iNOS的表达是神经炎症的标志物[30],且iNOS的表达与TH含量负相关。DANIELA等[31]报道,小鼠外创性脑损伤可导致PD样病理表型,在小鼠黑质区,iNOS的显著增加伴随着酪氨酸羟化酶含量急剧降低。VIJA等[30]报道,小分子有机物mildronate可对6-羟多巴胺诱导的大鼠PD模型产生明显保护作用,在降低神经炎症及iNOS表达的同时,完全阻止了TH含量的下降。一氧化氮对酪氨酸羟化酶含量的调控机制值得进一步探究。
神经元应激后细胞能量缺失是PD神经细胞死亡的最重要原因之一[32],流行病学调查显示经常接触鱼藤酮、百草枯等杀虫剂、除草剂的工人更容易患帕金森症,其中重要的原因就是此类神经毒剂可以直接影响中脑神经元的线粒体呼吸链功能,导致线粒体膜电位下降、细胞产能障碍[33]。我们的实验结果表明,鱼藤酮本身就能下调线粒体膜电位(图6),单独的NO也能降低线粒体膜电位,而NO与鱼藤酮联合处理组对神经细胞线粒体膜电位的下调效果最显著,可将PD发病过程的线粒体损伤作用放大,更容易检测到相关损伤指标或细胞信号机制。
α-突触核蛋白的过量表达及无序缠结是造成PD病理中路易小体形成的最主要因素,也是PD病变中区别于其他神经退行性疾病的最显著指标之一[1]。我们检测了不同处理条件对细胞内α-突触核蛋白含量的影响,发现鱼藤酮组能显著增加α-突触核蛋白含量,NO增加该蛋白的作用更强,而NO与鱼藤酮联合处理组使α-突触核蛋白含量达到最大增幅(图7),使PD病变中的α-突触核蛋白指标改变得到更显著的体现。Giuliano等报道,NO可对α-突触核蛋白进行硝基化修饰,使得胞内显微缠结加剧,促进细胞损伤[4,34],但是NO如何调节α-突触核蛋白的含量尚有待于进一步研究。
蛋白质巯基亚硝基化修饰是NO介导PD神经元病变的重要途径,可以通过可逆性修饰Parkin、PDI、XIAP等靶点诱导神经细胞死亡[16]。我们在之前的研究中报道了使用一氧化氮供体GSNO对神经细胞中经典靶点的亚硝基化修饰[35],在鱼藤酮和NO联合处理的SH-SY5Y细胞中,我们也检测到相关蛋白质的SNO修饰(数据尚未发表),表明使用联合诱导模型可以对PD模型中蛋白质亚硝基化修饰的功能开展研究。
综上所述,一氧化氮的加入使鱼藤酮诱导的神经细胞损伤中的多项指标更加趋近PD病理性神经元损伤,是对鱼藤酮建立的PD细胞模型的有益补充。此外,NO供体与鱼藤酮联合处理神经细胞的模型也为研究NO在PD病变中的作用提供了有力的工具。
