lncRNA HCG11-201对肾癌细胞增殖和侵袭的影响*
2021-05-13崔应东廖兆琳
杨 超,谭 威,崔应东,向 奎,廖兆琳
恩施土家族苗族自治州民族医院泌尿外科,湖北恩施 445000
肾癌是泌尿系统最常见的恶性肿瘤之一,起源于肾实质泌尿小管上皮系统,其发病率在我国呈逐年增加的趋势[1]。肾癌的主要治疗手段是外科手术,对放疗和化疗均不敏感[2]。肾癌发病机制尚未完全阐明,其分子机制研究对治疗方案的筛选和预后判断具有非常重要的临床价值。
长链非编码RNA(lncRNA)是一类超过200核苷酸的非编码小分子RNA,可在染色质修饰、转录、转录后等多个水平进行基因表达的调控[3]。lncRNA参与调控细胞增殖、发育、凋亡、分化、验证等细胞活动,在细胞生理和病理过程中起关键作用[4]。有研究表明,lncRNA在多种恶性肿瘤如神经胶质瘤、乳腺癌、宫颈癌等中表达异常,与肿瘤细胞的恶性生物学行为密切相关[5]。HCG11-201是一种新发现的lncRNA,在前列腺癌、神经胶质瘤等肿瘤中均扮演“抑癌基因”的作用[6-7]。本研究旨在探讨HCG11-201在肾癌组织和细胞系中的表达情况及对肾癌患者预后的影响,并进一步研究HCG11-201对肾癌细胞增殖和侵袭的影响。
1 材料与方法
1.1材料
1.1.1标本来源 选取2017年3月至 2019年7月在恩施土家族苗族自治州民族医院泌尿外科进行肾癌手术切除的患者59例为研究对象,标本来源于患者的肾癌组织和癌旁正常组织(距离肿瘤边缘2 cm以外)。患者平均年龄(63.21±13.86)岁;男37例,女22例;临床分期:T1期24例,T2期21例,T3期14例。组织学分级:高、中分化腺癌27例,低分化腺癌32例。所有患者术前均未接受化疗及放疗,癌组织标本均经病理确诊为肾癌。本研究经恩施土家族苗族自治州民族医院伦理委员会批准,所有患者均签署知情同意书。
1.1.2细胞与试剂 肾癌细胞(ACHN、Caki-1、786-O、A498和OS-RC-2)和人正常肾小管上皮细胞(HK-2)购自上海素尔生物科技有限公司;RPMI 1640培养基、DMEM高糖培养基和胎牛血清购自美国Hyclone公司;HCG11-201质粒和阴性对照质粒购自上海艾博斯生物技术有限公司;Lipofectamine 3000购自美国Invitrogen公司;PCR试剂盒购自宝生物(大连)公司;MTT购自美国Sigma公司;Transwell小室购自美国Corning公司;Matrigel基质胶购自美国BD公司;线粒体融合蛋白2(mitofusion-2)、p-AKT、p-mTORC2、p-IKK、p-MDM2和β-actin单克隆抗体购自Santa Cruz(北京)公司;引物购自上海生工生物工程公司。
1.2方法
1.2.1细胞培养和转染 用含10%胎牛血清的DMEM高糖培养基培养肾小管上皮HK-2细胞,用含10%胎牛血清的RPMI 1640培养基培养肾癌细胞ACHN、Caki-1、786-O、A498和OS-RC-2,置于37 ℃、5% CO2的培养箱中培养和传代。取对数生长期的Caki-1细胞接种于6孔板内,待细胞融合度达到50%,根据Lipofectamine 3000转染试剂说明书进行转染。实验分为对照组和实验组。对照组转染阴性对照质粒,实验组转染HCG11-201质粒。转染24 h后更换新鲜培养基。
1.2.2RNA提取和实时荧光定量PCR(qPCR)检测 提取组织和细胞总RNA,并反转录成cDNA,分别采用HCG11-201、miR-522、mitofusion-2引物进行qPCR扩增,以GAPDH为内参,检测细胞中HCG11-201和mitofusion-2的表达,以U6为内参检测细胞中miR-522的表达。具体步骤严格参照说明书操作。实验数据采用2-ΔΔCt法分析。引物序列见表1。
1.2.3MTT法 转染完成后24 h,消化收集每组细胞,将Caki-1细胞接种至96孔板,每孔100 μL,在培养箱中培养。在第1、2、3、4、5天时间点,向每孔加入20 μL MTT试剂,在培养箱中继续培养,观察颜色变化。4 h后弃去上清液,每孔加入150 μL二甲基亚砜,振荡15 min保证结晶溶解。酶标仪测量每孔在490 nm波长处的吸光度(A)值。以A值为纵轴,时间(d)为横轴,绘制细胞生长曲线。

表1 qPCR引物序列
1.2.4Transwell小室实验 采用RPMI 1640培养基稀释Matrigel基质胶,在Transwell上室加入50 μL稀释后的Matrigel基质胶,培养箱内凝固成形。Transwell下室加入600 μL含10%胎牛血清的RPMI 1640培养基。转染完成后24 h,消化收集每组细胞,使用无血清培养基重悬后,分别接种到Transwell上室,每室5×104个细胞。24 h后弃去培养基,棉签擦去未穿过膜的细胞。甲醇溶液固定20 min,结晶紫溶液染色20 min。显微镜下随机选5个视野,计数穿透细胞数。
1.2.5生物信息学方法预测 采用GEPIA数据库对肾癌中HCG11-201的表达进行生存分析。采用靶基因预测软件LncBase Predicted v.2预测HCG11-201可吸附结合的微小RNA(miRNA)。采用靶基因预测软件MicroT-CDS预测miRNA的下游基因。
1.2.6Western blot 转染完成后48 h,消化收集每组细胞,提取总蛋白。等量上样至10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,冰浴下90 V转膜至PVDF膜。5%脱脂牛奶在37 ℃封闭2 h。分别与一抗(mitofusion-2、p-AKT、p-mTORC2、p-IKK、p-MDM2和β-actin)在4 ℃下孵育过夜。洗膜后,分别与二抗在室温下孵育1 h。洗膜后,采用凝胶成像分析仪曝光、显影。
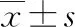
2 结 果
2.1HCG11-201在肾癌组织和癌旁正常组织中的表达 癌旁正常组织和肾癌组织中 HCG11-201的相对表达水平分别为8.03±0.56和3.17±0.37,差异有统计学意义(P<0.01)。
2.2HCG11-201在肾癌患者中的生存分析 GEPIA数据库显示,HCG11-201的相对表达水平越高,肾癌患者的生存时间越长(P<0.01)。
2.3HCG11-201在肾癌细胞和正常肾小管上皮细胞中的表达 肾癌细胞(ACHN、Caki-1、786-O、A498和OS-RC-2)和正常肾小管上皮细胞(HK-2)中 HCG11-201的相对表达水平分别为0.79±0.03、0.09±0.02、0.54±0.04、0.24±0.03、0.63±0.03和1.00±0.04,差异有统计学意义(P<0.01),其中Caki-1细胞相对表达水平最低(P<0.01)。
2.4转染后Caki-1细胞中HCG11-201的表达 HCG11-201质粒和阴性对照质粒转染Caki-1细胞后抽取lncRNA,与对照组比较,实验组细胞中HCG11-201的相对表达水平显著升高(1.03±0.15vs.10.56±0.86),差异有统计学意义(P<0.01)。
2.5HCG11-201对Caki-1细胞增殖活性的影响 MTT实验结果表明,转染HCG11-201后,从检测第2天开始,Caki-1细胞增殖活性显著降低(P<0.05)。见图1。
注:与对照组比较,aP<0.05,bP<0.01。
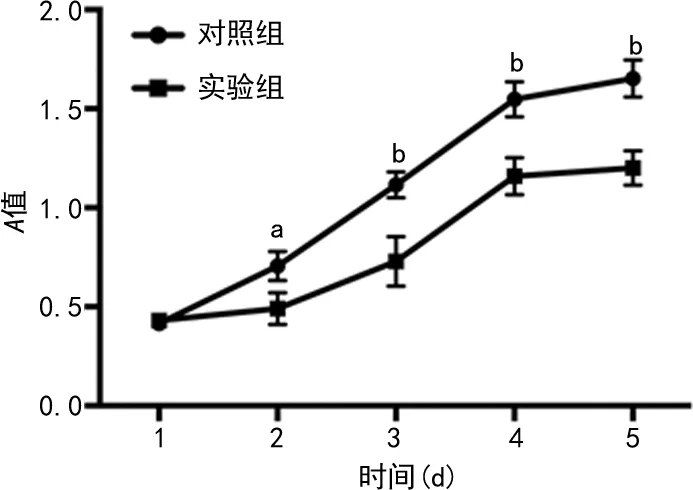
2.6HCG11-201对Caki-1细胞侵袭能力的影响 Tranwell小室实验结果显示,实验组穿过Tranwell上室基底膜的Caki-1细胞数显著少于对照组(31.46±7.09vs.89.87±7.43),细胞的侵袭能力显著降低,差异有统计学意义(P<0.01)。见图2。
注:A表示对照组,B表示实验组。
2.7HCG11-201互补结合的miRNA及miRNA下游靶基因 靶基因预测软件显示,LncBase Predicted v.2预测HCG11-201互补结合的miRNA为miR-522,靶基因预测软件MicroT-CDS预测miR-522的下游靶基因为mitofusion-2。见图3。
2.8转染HCG11-201对miR-522和mitofusion-2 mRNA表达的影响 qPCR显示,与对照组比较,实验组Caki-1细胞中miR-522的相对表达水平显著降低(1.01±0.08vs.0.19±0.02),差异有统计学意义(P<0.01);mitofusion-2 mRNA的相对表达水平显著升高(1.14±0.35vs.6.17±0.61),差异有统计学意义(P<0.01)。
2.9转染HCG11-201对相关蛋白表达的影响 Western blot结果显示,转染HCG11-201后,mitofusion-2蛋白水平升高,p-AKT、p-mTORC2、p-IKK和p-MDM2蛋白水平降低。见图4。

图3 HCG11-201与下游miRNA及下游靶基因的结合位点
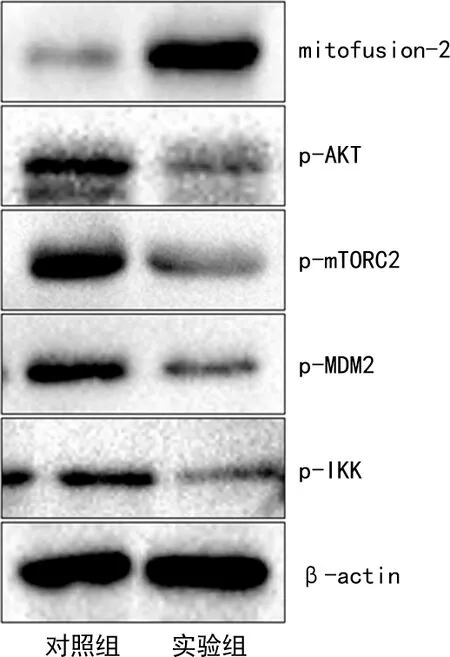
图4 上调HCG11-201表达后Caki-1细胞中相关蛋白的表达Western blot图
3 讨 论
肾癌的发生、发展与多种信号通路及基因的异常表达密切相关,是一个复杂的过程[8]。近年来随着分子生物学的进展,明确肾癌的发病机制和寻找基因靶向治疗是国内外研究的重点。越来越多的研究表明,lncRNA如ROR、NBAT1、AFAP1-AS1、HOTTIP等在肾癌组织和癌旁正常组织中存在差异表达,在肾癌细胞的分化、增殖、凋亡、转移等活动中发挥重要作用[9-12]。HCG11-201是一种新发现的lncRNA,CHEN等[13]研究表明,HCG11-201在神经胶质瘤中呈低表达,可通过充当竞争性内源性RNA吸附miR-496,抑制神经胶质瘤细胞的增殖,促进细胞的凋亡。ZHANG等[7]研究表明,前列腺癌组织中HCG11-201的相对表达水平显着低于非肿瘤组织,HCG11-201的相对表达水平与患者年龄、淋巴结转移、前列腺特异性抗原水平、Gleason评分和肿瘤复发相关,且前列腺癌组织中HCG11-201低表达与前列腺癌患者的生存不良有关。本研究发现,HCG11-201在肾癌组织和细胞系中低表达。通过转染上调Caki-1细胞中HCG11-201的表达,Caki-1细胞的增殖活性和侵袭能力均受到显著抑制,表明HCG11-201的异常低表达与肾癌的发生、发展密切相关。GEPIA数据库显示,HCG11-201的相对表达水平越高,肾癌患者的生存时间越长,HCG11-201与肾癌患者的预后显著相关,HCG11-201可能成为肾癌的治疗靶点和预后标志物。
研究表明,lncRNA可通过充当竞争性内源性RNA吸附下游miRNA,间接抑制miRNA对下游靶基因的干扰作用[9,14]。靶基因预测软件LncBase Predicted v.2预测HCG11-201的下游miRNA为miR-522。miR-522在骨肉瘤、结直肠癌、非小细胞肺癌等多种肿瘤中表达上调,具有促进肿瘤细胞增殖和转移的作用,发挥显著的“癌基因”作用[15-16]。上调HCG11-201的表达后,miR-522表达下调,表明HCG11-201可吸附miR-522,抑制miR-522的表达。靶基因预测软件MicroT-CDS结果显示,mitofusion-2可能是miR-522的靶基因。mitofusion-2蛋白是一种高度保守的跨膜三磷鸟苷酶,位于线粒体外膜中,是促进线粒体融合的重要成分,在维持线粒体和细胞功能方面具有重要作用[17]。mitofusion-2蛋白在多种恶性肿瘤中低表达,其过表达可显著抑制肿瘤细胞的增殖和转移[18]。本研究中miR-522表达被抑制后,mitofusion-2基因表达显著增加。mitofusion-2蛋白主要通过抑制AKT/mTOR信号通路的活化,发挥肿瘤抑制作用[19]。本研究中mitofusion-2蛋白水平升高后,AKT/mTOR信号通路蛋白如p-AKT、p-mTORC2、p-MDM2和p-IKK蛋白水平均显著降低,提示AKT/mTOR信号通路被抑制。
综上所述,HCG11-201在肾癌组织和细胞系中低表达,HCG11-201的相对表达水平与肾癌患者的生存期具有相关性。上调肾癌细胞Caki-1中HCG11-201的表达可显著抑制细胞的增殖和侵袭能力,其分子机制可能为HCG11-201充当竞争性内源性RNA吸附miR-522,进而促进mitofusion-2蛋白的表达。
