饲粮不同氮硫比对藏羔羊空肠组织形态和空肠微生物区系的影响
2021-05-12闫小兰侯生珍李鹏翔王志友杨葆春贾建磊
闫小兰,侯生珍,李鹏翔,王志友,杨葆春,贾建磊
(青海大学农牧学院, 青海 西宁 810016)
硫是反刍动物体内一种常量矿物质元素,也是构成牛、羊等动物第一限制性氨基酸的元素,在体内通常以有机物的形式存在。硫对所有动物都是必不可少的,因为含硫化合物,如氨基酸、激素、B 族维生素和辅酶,是所有生物体正常代谢、结构和调节功能所必需的。动物对硫的需要是一个适宜量,缺乏和不足均会影响饲料转化率,降低动物的生产性能[1-2]。研究表明,反刍动物的硫需要量通常以氮硫比的形式表示,氮是构成蛋白质的基础元素,适宜的氮硫比可促进瘤胃微生物蛋白质的合成,促进氮的沉积,从而促进反刍动物的生长[3-4]。动物营养学家们早期研究发现动物品种、生长时期以及硫来源都是影响动物适宜的氮硫比的因素[5-9]。
肠道是营养物质吸收的主要场所。研究表明,小肠对营养物质的消化吸收能力受小肠组织形态发育状况、肠道消化酶以及肠道菌群多样性等因素的影响[10]。动物肠道寄居着大量微生物,包括细菌(最多)、古菌、真菌、原虫和病毒。肠道微生物区系的形成受个体、年龄、健康状况和环境等多种因素的影响。空肠占小肠长度的2/5,空肠微生物数量相对较少,主要是与空肠中较快的食糜流动速度有关[11]。空肠微生物组发酵结构性碳水化合物生成的短链脂肪酸(short-chain fatty acids, SCFAs),具有促进肠道黏液分泌、抑制炎症发生和为肠上皮提供能量等作用。此外,SCFAs 还能通过抑制组蛋白去乙酰化酶(histone deacetylase, HDACs)活性的方式促使肠上皮细胞紧密连接,增强机体免疫功能[12]。
目前国内饲养模式主要以现有的作物秸秆类为主要粗饲料,这类饲料能量浓度低,粗蛋白含量少。必需氨基酸严重缺乏。长期饲喂可造成蛋白质的缺乏和氨基酸的不平衡,制约养殖业快速发展。日粮中添加硫或降低氮硫比能增加饲料的转化率,但是各国的饲养标准对反刍动物的适宜氮硫比的规定存在一定差异。已有的研究结果也不尽一致,而且多集中在产毛动物上,并且多以无机硫为添加源,尚未进行有机硫为添加源方面的研究。已有研究主要集中于对反刍动物瘤胃发酵的影响上,而对于其他消化器官的研究较少。因此,本研究以藏羊为研究对象,用利用率较高的蛋氨酸为补充硫源,通过对空肠组织形态和微生物结构与功能的研究,从而筛选出藏羔羊所适宜的氮硫比例。
1 材料与方法
1.1 试验动物和试验饲粮
试验选择健康状况良好、体重相近[(12.0 ± 1.0) kg]的60 日龄断奶藏羔羊150 只(公母比1 ∶ 1),随机分为5 组,每组30 只,用蛋氨酸和赖氨酸替代精料补充料中的麸皮以此调节日粮中的氮硫质量比为10.5 ∶ 1(A)、9 ∶ 1 (B)、7.5 ∶ 1 (C)、6 ∶ 1 (D)、4.5 ∶ 1 (E)[8-9]。根据青海省当地饲料原料配制能量和蛋白水平相似而氮硫质量比不同的5 组日粮,日粮组成和营养水平如表1 所列。
1.2 试验设计与样品采集
将5 组藏羔羊,分别以氮硫质量比不同的日粮进行限量饲喂(参考中国肉羊饲养标准,干物质采食量为羔羊体重的3%);采用按组分栏的方式舍饲饲养,分别在每天08:00、16:00 进行饲喂,自由饮水。60 日龄开始补饲(羔羊随机采食),预试验5 d,65 日龄开始正式试验。饲养至180 日龄后,每组随机选择6 只羔羊早上空腹,颈动脉放血屠宰(符合医学伦理学),解剖,采集空肠食糜于冻存管中,液氮带回实验室-80 ℃冷冻保存,用于后期空肠食糜细菌多样性的测定。另外采集空肠组织(长度2~3 cm)用生理盐水清洗后,立即放入4%多聚甲醛中固定。
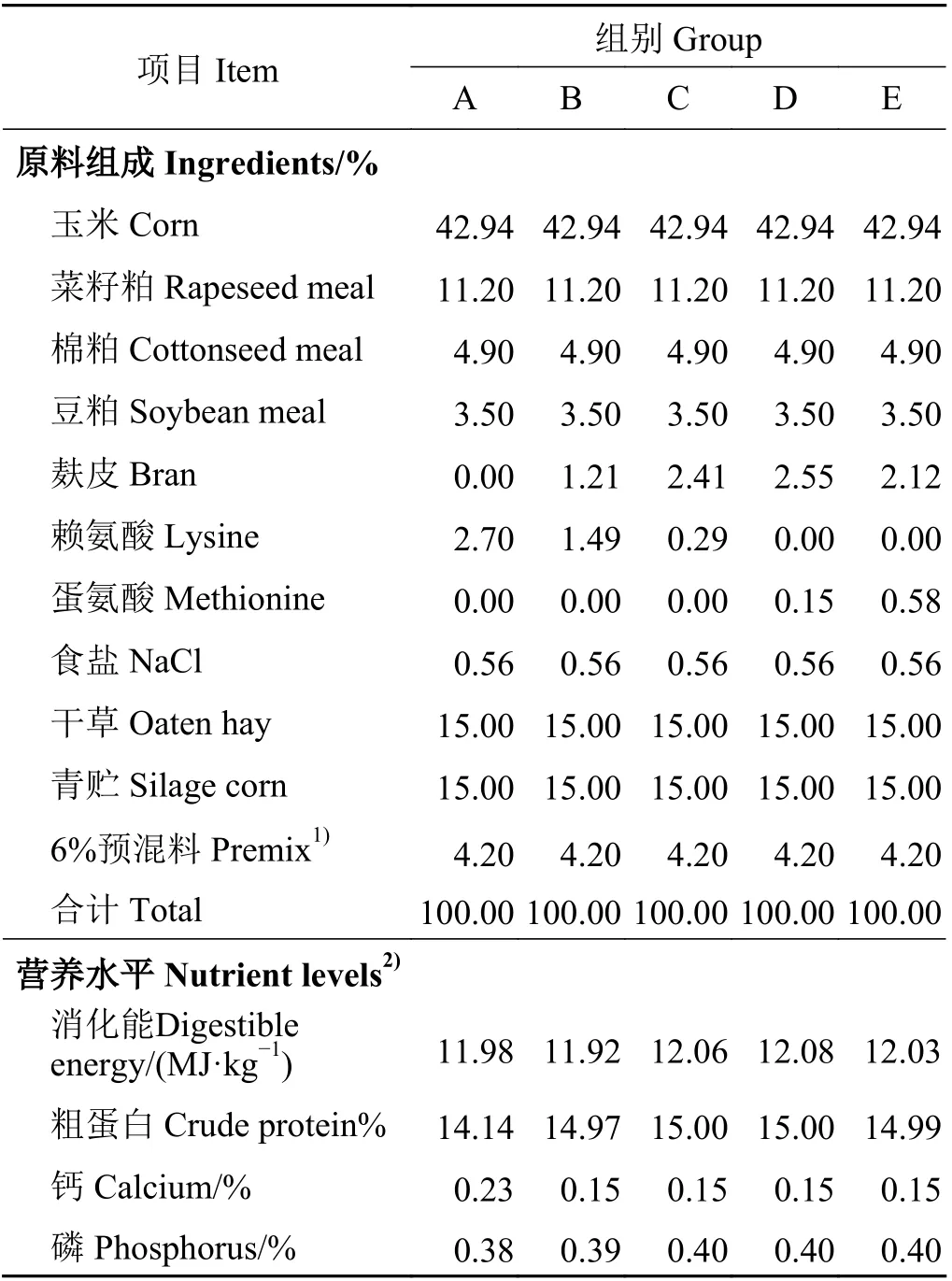
表 1 日粮组成及营养水平(干物质基础)Table 1 Composition and nutritional level of experimental diets (dry weight basis)
1.3 试验样品的测定
1)空肠组织形态的测定:
空肠组织在固定液中固定3 d 后即可制作冰冻切片,具体制作过程参考于晶[13]方法。制作完成的切片在Olympus BX51 显微镜下观察,Olympus DP21图像分析系统中的测量工具进行测量。每个样本随机选择3 张非连续性切片,每张切片选择3 个非临近的视野,每个视野中选择3~5 处测定试验数据。
2)微生物多样性的测定
将采集的空肠食糜样品送到北京百迈客科技有限公司利用Illumina Hiseq2500 高通量测序平台进行测序。主要流程:提取细菌中的DNA,经1%琼脂糖凝胶电泳检测DNA 的纯度和浓度合格后,使用位于V3+V4 高变区两侧的引物338F:5'-ACTCCTACGGGAGGCAGCA-3'和806R: 5'-GGAC TACHVGGGTWTCTAAT-3'进行PCR 扩增,扩增反应条件:98 ℃预变性2 min,98 ℃变性30 s、55 ℃退火30 s、72 ℃延伸90 s,30 个循环,最后在72 ℃下延长7 min。然后将PCR 扩增产物进行纯化、定量和均一形成测序文库,建好的文库先进行库文质检,质检合格的文库用Illumina Hiseq2500 进行测序。
1.4 生物信息学分析
生物信息学分析具体参考闫小兰等[14]方法。
1.5 数据统计与分析
采用Excel 2013 对数据初步整理,应用SPSS 25 软件进行正态分布检验,然后使用Kruskal-Wallis 分析,数据以平均值 ± 标准误表示,P < 0.05 表示差异显著。
2 结果与分析
2.1 不同氮硫比对藏羔羊空肠组织形态的影响
B 组和E 组的空肠绒毛长度和绒毛宽度显著高于A、C、D 组(P < 0.05),且A、D 组的绒毛长度显著高于C 组(P < 0.05);D 组的隐窝深度显著高于其他4 组(P < 0.05),A、C 组的隐窝深度显著高于B 组和E 组(P < 0.05);B、E 组的绒毛长度/隐窝深度显著高于A、C、D 组(P < 0.05);B 组和E 组的黏膜层厚度显著高于C、D 组(P < 0.05),A 组的黏膜层厚度与其他4 组差异不显著(P > 0.05);B 组的肌肉层厚度显著高于其他4 组(P < 0.05) (表2)。
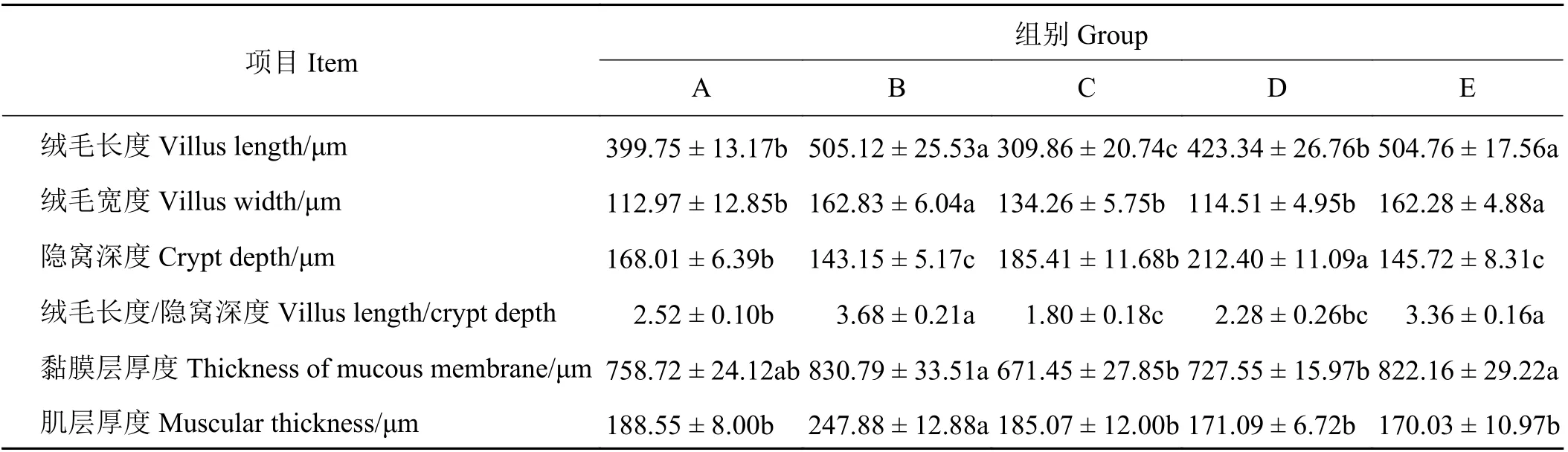
表 2 饲粮不同氮硫比对藏羊空肠组织形态的影响Table 2 Effects of different nitrogen to sulfur ratios on jejunum morphology of Tibetan lambs
2.2 饲粮不同氮硫比对藏羔羊空肠食糜微生物多样性的影响
使用QIIME (version 1.8.0)软件中的UCLUST对Tags 在97% 的相似度阈值下进行聚类,将这些经过拼接和优化的有效序列数划分成1 212 个OTU。每个样品的OTU 统计结果如表3 所列。通过每组样品OTU 的Venn 图(图1)可知:A、B、C、D、E 共5 组之间的共有OTU 数为95 个,独有OTU 数分别为37、131、34、42和167个,占OTU总数的比例分别为3.05%、10.81%、2.81%、3.47%和13.78%,表明B 和E 组OTU的组成与其他组相似度较小,差异较大。
空肠细菌在OTU 水平上基于Bray-Curtis 距离计算的主坐标分析结果(图2)显示,主成分1 和主成分2 的贡献值分别为17.63% 和12.86%。饲喂同一饲粮的样品点之间的距离较近,饲喂不同饲粮的样品点之间的距离较远。
表3 列出了5 组藏羔羊空肠食糜样品的Alpha多样性指数。结果显示,B、E 两组的Shannon 指数显著高于其他组(P < 0.05);C、D 两组的Simpson指数显著高于A、B、E 组(P < 0.05);B、D、E 组的Ace指数显著高于A、C 组(P < 0.05);B、E 组的Chao1 指数显著高于A、C 组(P < 0.05),并且与D 组差异不显著(P > 0.05)。基因文库覆盖率均大于99.9%,因此本研究测序深度能够满足后续分析的要求。
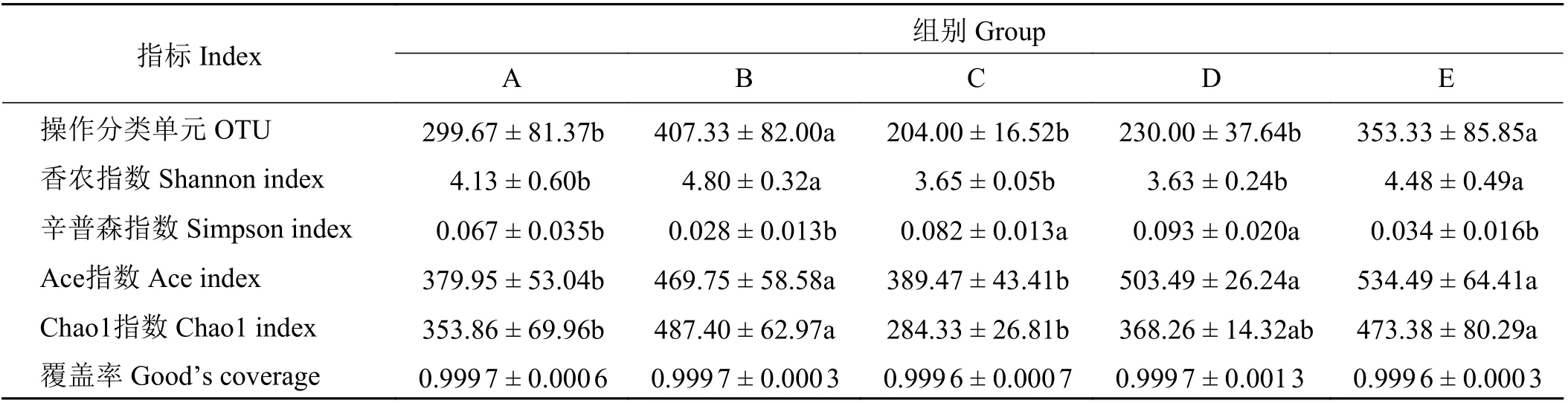
表 3 Alpha 多样性指数Table 3 Alpha diversity indices
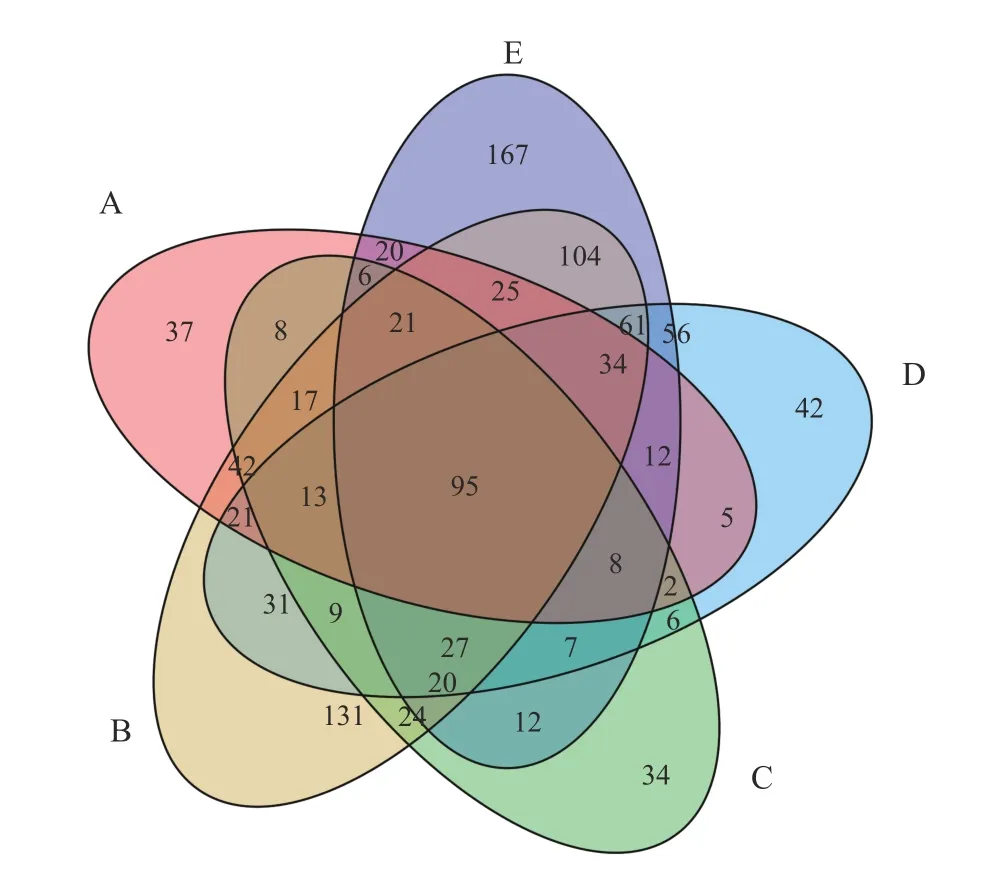
图 1 瘤胃液韦恩图Figure 1 Venn diagram of rumen fluid

图 2 主成分分析图Figure 2 PCoA diagram
2.3 饲粮不同氮硫比对藏羔羊空肠微生物菌群结构及功能的影响
2.3.1 饲粮氮硫比对藏羔羊空肠微生物菌群结构的影响
将所得有效序列在不同分类水平上进行物种注释和统计,本研究在门水平上共注释得到25 种细菌,其中5 组优势菌门为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria) (表4)。B 组厚壁菌门的丰度显著高于C 组(P < 0.05),但与A、D、E 组差异不显著(P > 0.05);A、C 组的放线菌门丰度显著高于B、E 两组(P < 0.05);B、E 组拟杆菌门的丰度显著高于A、C 组(P < 0.05),D 组放线菌门和拟杆菌门的丰度与其他4 组差异不显著(P > 0.05);E 组的变形菌门丰度显著高于B、D 组(P < 0.05),A、C 组变形菌门的丰度与B、D、E 组差异不显著(P > 0.05)。
在属水平上空肠微生物区系物种的相对丰度(表5)可看出,厚壁菌门下的克里斯滕森氏菌R7 菌群(Christensenellaceae-R-7-group) 和Quinella 属、放线菌门下的红球菌属(Rhodococcus) 和短杆菌属(Brevibacterium)以及拟杆菌门下的理研菌科RC9 肠道菌群(Rikenellaceae-RC9-gut-group) 为5 组的优势菌属。A、C、D 组红球菌属的丰度显著高于B、E 两组(P < 0.05);B 组的克里斯滕森氏菌R7 菌群丰度显著高于其他组(P < 0.05);A、B 组的Quinella 属丰度显著高于D、E 组(P < 0.05),并且A、B、D、E 组的Quinella 属丰度与C 组差异不显著(P > 0.05);短杆菌属和理研菌科RC9 肠道菌群的丰度在各组之间差异不显著(P > 0.05)。
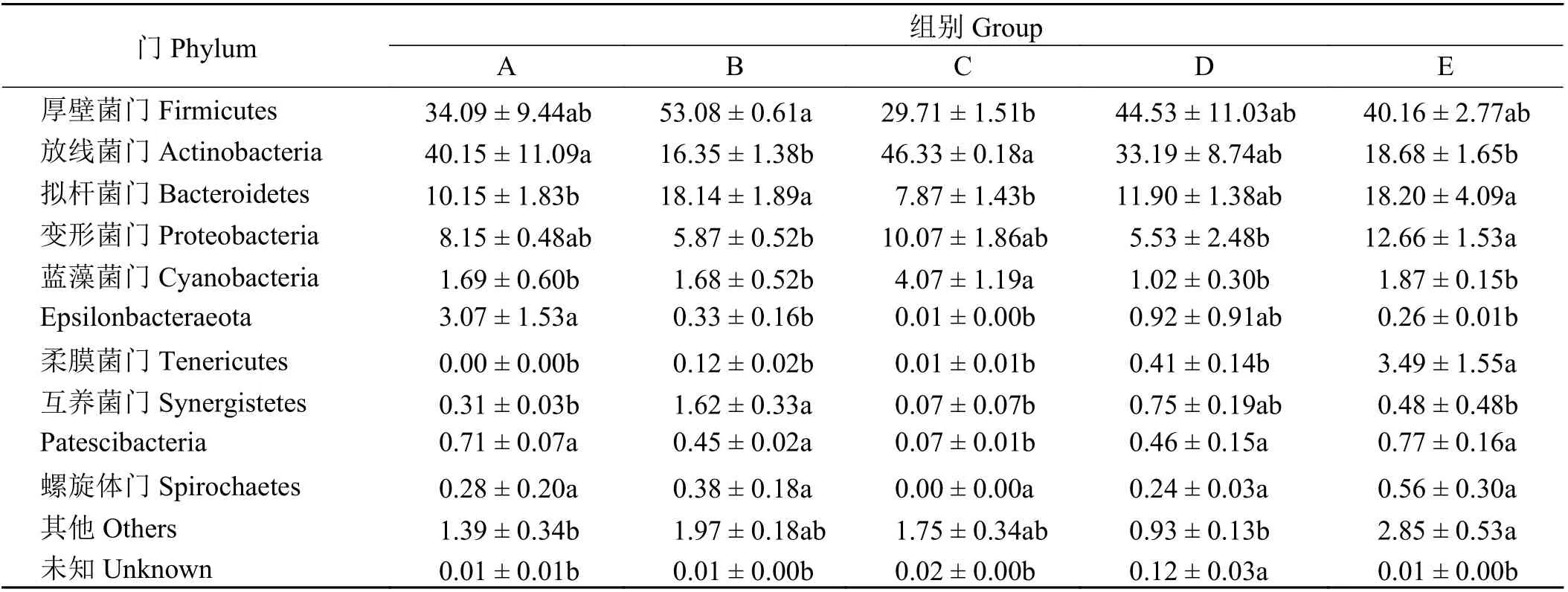
表 4 饲粮不同氮硫比对藏羔羊空肠细菌门水平丰度的变化的影响Table 4 Effects of different nitrogen to sulfur ratios on the abundance of jejunum bacteria in Tibetan lambs at the phylum level%
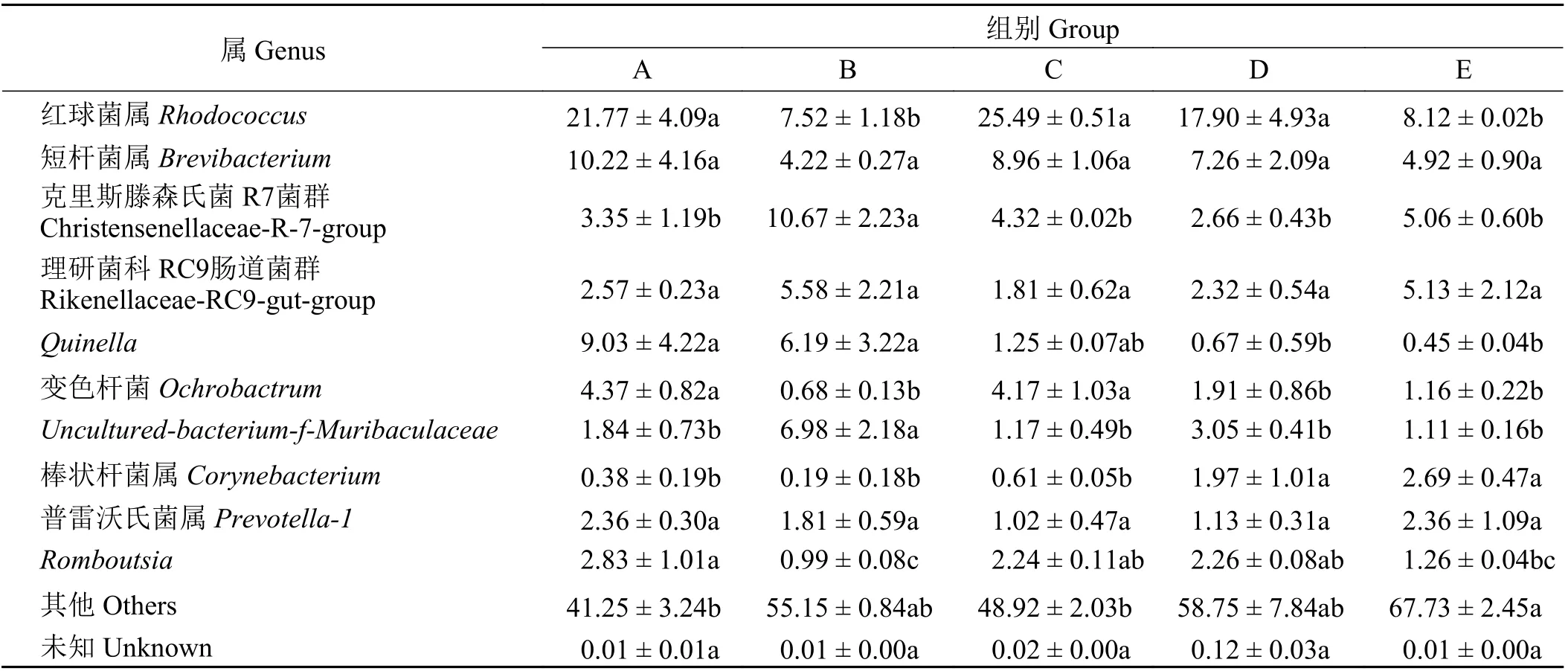
表 5 饲粮不同氮硫比对藏羔羊空肠细菌属水平丰度的变化的影响Table 5 Effects of different nitrogen to sulfur ratios on the abundance of jejunum bacteria in Tibetan lambs at the genus leve l%
2.3.2 功能基因预测
为比较5 组处理在空肠细菌功能上的差异,利用16S rRNA 预测工具PICRUSt 1 软件对这5 组样品进行功能预测,在预测基因功能的同时,参考蛋白质直系同源簇数据库(Clusters of orthologous groups of proteins, COG)对预测的功能类别进行注释(图3)。可以看出,从5 组藏羔羊空肠细菌注释到的COG 分别隶属于25 个功能类别。其中丰度较高的前5 个功能基因为仅一般功能预测、转录、氨基酸转运与代谢、碳水化合物运输和代谢、未知功能。其中A、C 组仅一般功能预测显著高于B (P < 0.05),D 组和E 组仅一般功能预测与其他3 组差异不显著(P >0.05);D 组转录显著高于B、E 组(P < 0.05);未知功能、氨基酸转运与代谢以及碳水化合物运输和代谢在各组间差异不显著(P > 0.05) (表6)。
3 讨论与结论
3.1 饲粮不同氮硫比对藏羔羊空肠组织形态的影响
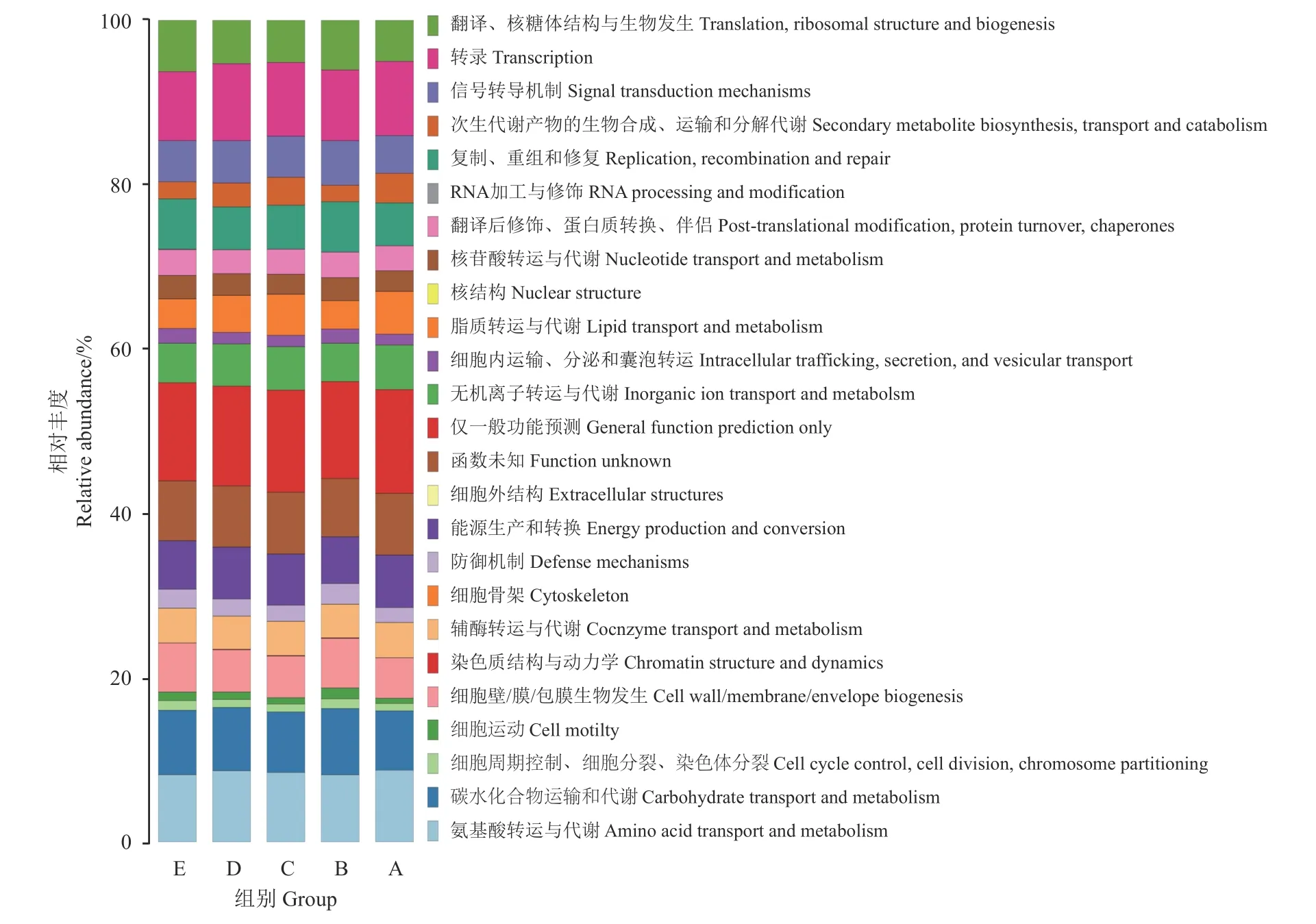
图 3 原核生物同源蛋白簇数据库功能注释Figure 3 COG function note
动物机体的生长发育不但与营养物质的摄入量有关,而且与其对营养物质的消化吸收能力密切相关[15]。小肠是营养物质消化吸收的主要场所,维持小肠的正常结构与功能对于动物健康至关重要。评价肠道结构是否完善的指标主要有肠道绒毛高度、隐窝深度、肠壁厚度以及黏膜厚度[16]。绒毛长度和高度决定了肠道内容物和肠上皮的接触面积,其值越大对营养物质的吸收速率也就越强。隐窝是绒毛根部上皮下陷至固有层而形成。隐窝的深浅可以反映隐窝细胞的生成率,隐窝变浅表明肠上皮细胞成熟率增加,分泌功能增强,消化速率加快[17]。绒毛长度和隐窝深度的比值(villus length/crypt depth, V/C)能够反映小肠吸收功能和黏膜的损伤情况,比值下降,表明成熟肠上皮细胞减少,肠黏膜受到损伤,其消化吸收功能降低[18]。小肠肠壁主要由绒毛和隐窝构成,肠道消化酶含量和活性对小肠充分消化吸收日粮营养素起着决定性作用[19]。肠道肌层的主要功能是紧张性收缩维持肠道形态以及参与肠道运动。研究发现,肠道组织形态的发育受营养物质摄入水平的调控[20]。对于反刍动物而言,饲粮中未被瘤胃发酵消化的蛋白质、非结构性碳水化合物及微生物蛋白质进入十二指肠和空肠后由其进行进一步消化吸收。有研究发现氮硫比不同会影响瘤胃的发酵水平,因此造成由瘤胃发酵后流入空肠的营养物质数量与质量有所不同,进而影响空肠的发育[3-4]。本研究结果显示,B 和E 组羔羊的空肠绒毛长度、绒毛宽度、绒毛长度/隐窝深度、黏膜层厚度以及肌层厚度高于其他组,隐窝深度显著低于其他组,说明氮硫比为9 ∶ 1 和4.5 ∶ 1 时小肠的组织形态发育较好,更有利于营养物质的吸收。
3.2 饲粮不同氮硫比对藏羔羊空肠微生物结构及功能的影响
小肠是动物消化道重要的组成部分,肠道菌群具有参与营养与代谢和免疫与保护、维持肠道菌群平衡、改善肠道环境、促进动物生长发育等作用[21]。肠道微生物结构受饲粮的调控。本研究中,B 和E 组的OTU 个数高于其他组。多样性指数间接反映了微生物群落种类以及结构的多样性,Shannon指数和Simpson 指数可反映微生物菌群的多样性,Ace 指数和Chao1 指数可反映微生物菌群的丰富度。本研究中B 和E 组的Ace 指数较高,Shannon 指数显著高于其他各组,表明饲粮中氮硫比为9 ∶ 1 和4.5 ∶ 1 时藏羔羊空肠微生物的丰富度和多样性较高。本研究中各组覆盖度均高于99.9%,覆盖度高于97% 说明测序样品取样充分[22]。因此本次测序结果能真实地反映藏羔羊空肠微生物群落种类和结构多样性。
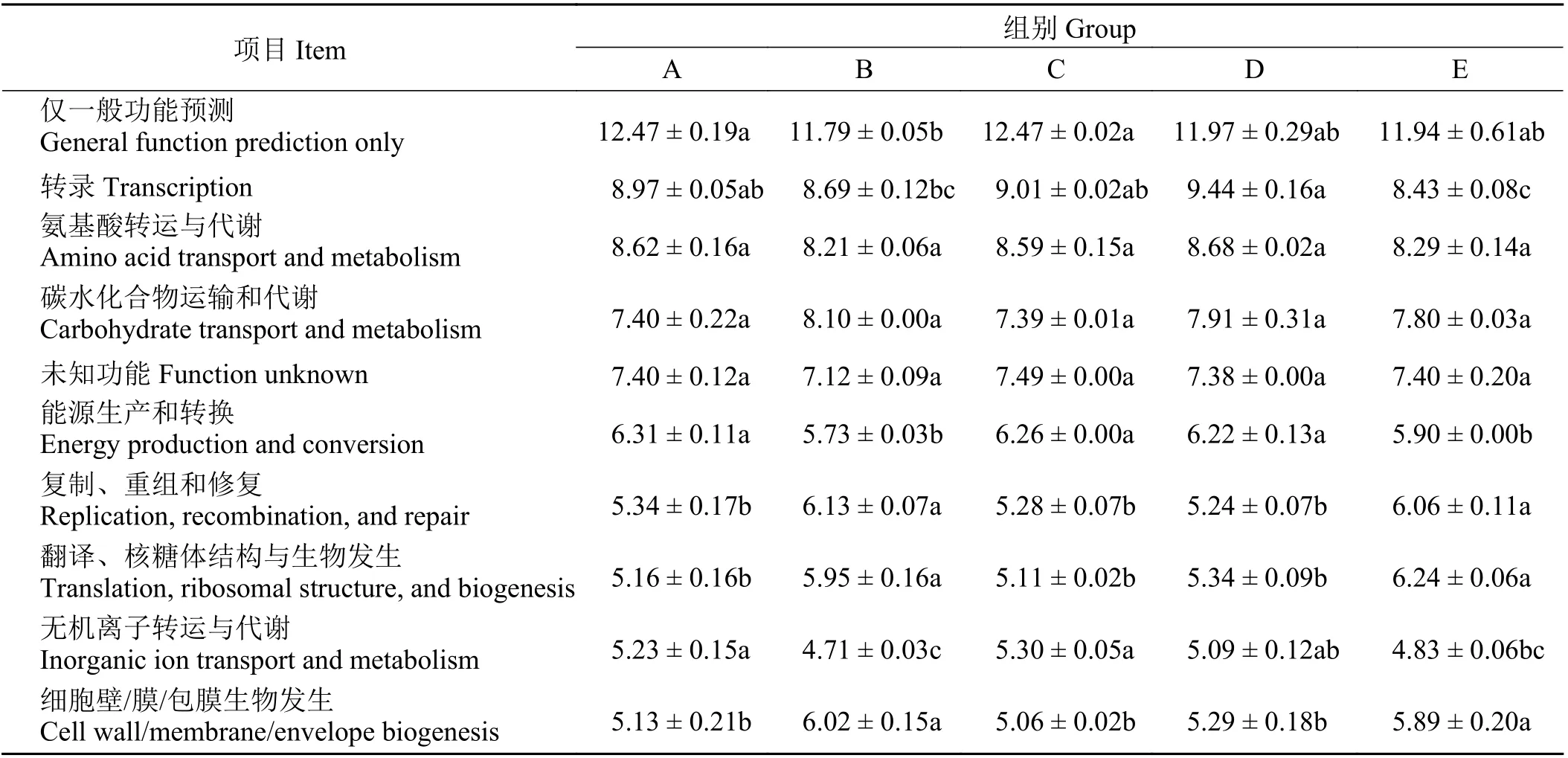
表 6 基因功能丰度Table 6 Gene function abundance%
研究发现,厚壁菌门和拟杆菌门是胃肠道的优势菌门[23-24]。厚壁菌门下的细菌具有分泌淀粉、半乳糖及丁酸等代谢酶的功能,有助于促进机体对能量的吸收,更利于脂肪的沉积;而拟杆菌门主要参与复合碳水化合物的发酵以及其他有机物的消化[25-26]。另外,有研究表明肠道共生的拟杆菌表达的一种蛋白能够快速地招募白细胞,从而杀死一种导致炎症性肠病(inflammatory bowel disease, IBD)的免疫系统细胞,从而阻止IBD 的发生[27]。本研究中在所有羔羊空肠细菌中厚壁菌门、放线菌门、拟杆菌门以及变形菌门的相对丰度均较高,是5 组的优势菌门。这与Wang 等[28]研究报道的绵羊胃肠道中细菌主要以厚壁菌门、拟杆菌门、变形菌门为主的结果基本一致。厚壁菌门是胃肠道内重要的纤维消化菌,能够消化纤维生成乙酸。拟杆菌门为重要的淀粉消化菌,能够促进丙酸的沉积[29]。本研究中B 组和E 组的厚壁菌门和拟杆菌门数量较高,说明B 组和E 组更有利于空肠内营养物质的消化。放线菌门诺卡菌科中含有许多机会致病菌,能引起动物多处炎症反应[30]。本研究中,羔羊空肠放线菌门的丰度呈现C >A > D > E > B 的变化趋势,并且C 组的放线菌门丰度显著高于B 和E 组,说明氮硫比为9 ∶ 1 和4.5 ∶ 1时能有效降低条件病原菌的丰度。另外,B 组互养菌门的相对丰度高于其他组。互养菌门具有降解氨基酸和丙酮酸的能力,属于革兰氏阴性厌氧杆菌。在属水平上,5 组的优势菌群均为红球菌属、短杆菌属、克里斯滕森氏菌科R7 菌群、理研菌科RC9 肠道菌群以及Quinella 属。红球菌属和短杆菌属均属于放线菌门诺卡菌科下的菌属。红球菌属是一类可利用许多有机化合物作为唯一碳源的菌属,但是不具备降解酪蛋白、纤维糖、几丁质、弹性蛋白或木聚糖的能力,并且动物感染后会出现发烧、乏力等症状[31]。短杆菌属是胆固醇氧化酶的高产菌[32]。在B 和E 组红球菌属的丰度显著低于其他水平,B 组的克里斯滕森氏菌科R7 菌群丰度显著高于其他各组,理研菌科RC9 肠道菌群在各水平之间差异不显著,但在B 水平下丰度较高,A 和B 水平下Quinella 属的相对丰度显著高于D 和E 组。克里斯滕森氏菌科R7菌群和Quinella 属是厚壁菌门下的菌属,与纤维的消化分解有关,而理研菌科具有降解结构性碳水化合物的作用[33]。研究发现,理研菌科RC9 肠道菌群能够促进肌肉中n-3 多不饱和脂肪酸 (n-3 Polyunsaturated fatty acids, n-3PUFA)的沉积。因此,B 和E 组羔羊空肠食糜微生物的结构均有利于动物的生长发育。
肠道菌群可促进羔羊营养物质的消化与吸收,提高免疫力。本研究中PICRUSt 预测结果显示,试验羊空肠菌群主要的功能与氨基酸代谢、碳水化合物代谢、能量代谢、辅助因子和维生素代谢、核苷酸代谢、脂质代谢等新陈代谢类功能有关,表明肠道菌群积极参与了藏羔羊的日常代谢活动。转录和能量的产生与转换与化合物的代谢紧密联系。因此本研究结果也显示出微生物中含有较高丰度的与转录、能量转换相关的基因。5 组样品的微生物群落所具有的基因功能一致,但是相对丰度不同,其原因可能为不同菌群所具有的基因功能具有相似性。
综上所述,可以得出以下结论:1) 饲粮氮硫质量比为9 ∶ 1 和4.5 ∶ 1 时羔羊空肠组织形态发育较好,微生物的相对丰度和多样性较高;2) 羔羊空肠微生物菌群功能主要集中于氨基酸的转运与代谢和碳水化合物的运输与代谢;3)蛋氨酸价格较高且有毒性,不适用于羔羊的长期饲喂,因此日粮氮硫质量比为9 ∶ 1 更有利于藏羊的规模化养殖。
