急性心肌梗死患者介入术后缺血再灌注损伤发生的影响因素分析
2021-05-11王海燕鄄城县人民医院心内科山东鄄城274600
王海燕(鄄城县人民医院心内科,山东 鄄城274600)
急性心肌梗死(AMI)是在动脉粥样硬化的基础上,由寒冷刺激、情绪变化等因素诱发动脉粥样斑块破裂,致使相应的心肌出现持久而严重的缺血性病变[1];而AMI病情变化快,需在发病后尽早采取治疗。目前,经皮冠状动脉介入治疗为临床治疗AMI患者的有效方案,能够快速恢复心肌血流灌注,缓解患者临床症状。但有研究表明,部分患者在接受介入治疗后可出现心肌损害进一步加重,即缺血再灌注损伤(IRI),严重者因血流动力学障碍而病死,需及时明确AMI患者介入术后出现IRI的相关原因,并予以针对性的干预措施[2]。鉴于此,本研究着重分析AMI患者介入术后发生IRI的影响因素,旨在为患者的预后改善提供理论依据。报道如下。
1 资料与方法
1.1 一般资料 选取我院2018年3月~2020年4月行经皮冠状动脉介入治疗的AMI患者80例。其中男48例、女32例;年龄49~85(62.19±3.49)岁;胸痛至梗死血管开通时间3~12(7.15±0.37)h;梗死部位:前壁37例、下壁43例。本研究经医院伦理委员会审核。
1.2纳入与排除标准 纳入标准:(1)符合《内科学》[3]中关于AMI的诊断标准,并接受经皮冠状动脉介入治疗;(2)临床资料保存完善。排除标准:(1)冠状动脉粥样硬化性心脏病;(2)合并主要器官功能障碍;(3)合并恶性肿瘤;(4)合并免疫性疾病。
1.3 方法
1.3.1 经皮冠状动脉介入治疗 所有患者在术前静脉滴注硝酸酯类药物,口服氯吡格雷与阿司匹林各300mg后送至导管室,使用数字减影血管造影系统并经股动脉或桡动脉穿刺行冠状动脉介入,采用非离子型造影剂并结合心电图明确梗死血管后进行球囊扩张,然后行支架置入;术后使用低分子肝素抗凝3d,结合患者自身情况给予利尿类、血管紧张素转换酶抑制剂处理。
1.3.2 IRI判定 参考《美国经皮冠状动脉介入治疗指南》[4]中关于IRI的判定标准:(1)介入治疗中开通冠状动脉血管后数分钟内发生严重心动过缓、低血压、频发室性期前收缩;(2)药物治疗或电复律、电除颤治疗后仍有严重室性心律失常;(3)冠状动脉造影检出冠状动脉前向血流TIMI≤2级,合并血栓、夹层或痉挛。
1.3.3 一般资料统计 统计患者的一般资料,包括年龄、梗死部位(前壁、下壁)、冠心病史(有、无)、术前低血压(是、否)、多支血管病变(是、否)、胸痛至梗死血管开通时间。其中术前收缩压<90mmHg、舒张压<60mmHg则为低血压。
1.4 统计学处理 数据采用SPSS 24.0统计学软件进行处理。计量资料采用±s表示,行t检验;计数资料采用例(百分率)表示,行χ2检验。P<0.05示差异有统计学意义。采用Logistic回归分析AMI患者介入术后发生IRI的影响因素;P<0.05为差异有统计学意义。
2 结果
2.1 AMI患者介入术后IRI发生状况分析80例AMI患者介入术后发生IRI 29例,发生率为36.25%。
2.2 AMI患者介入术后发生IRI的单因素分析 单因素分析结果显示,AMI患者介入术后发生IRI不受年龄、冠心病史、胸痛至梗死血管开通时间的影响(P>0.05),但可能受梗死部位、术前低血压、多支血管病变的影响(P<0.05)。见表1。
2.3 AMI患者介入术后发生IRI的Logistic回归分析 以AMI患者介入术后IRI发生情况为因变量,发生为“1”,未发生为“0”,以2.2经单因素分析结果显示为可能的影响因素纳为自变量并赋值,见表2。Logistic回归分析发现梗死部位、术前低血压、多支血管病变均是AMI患者介入术后发生IRI的影响因素(OR>1,P<0.05)。见表3。
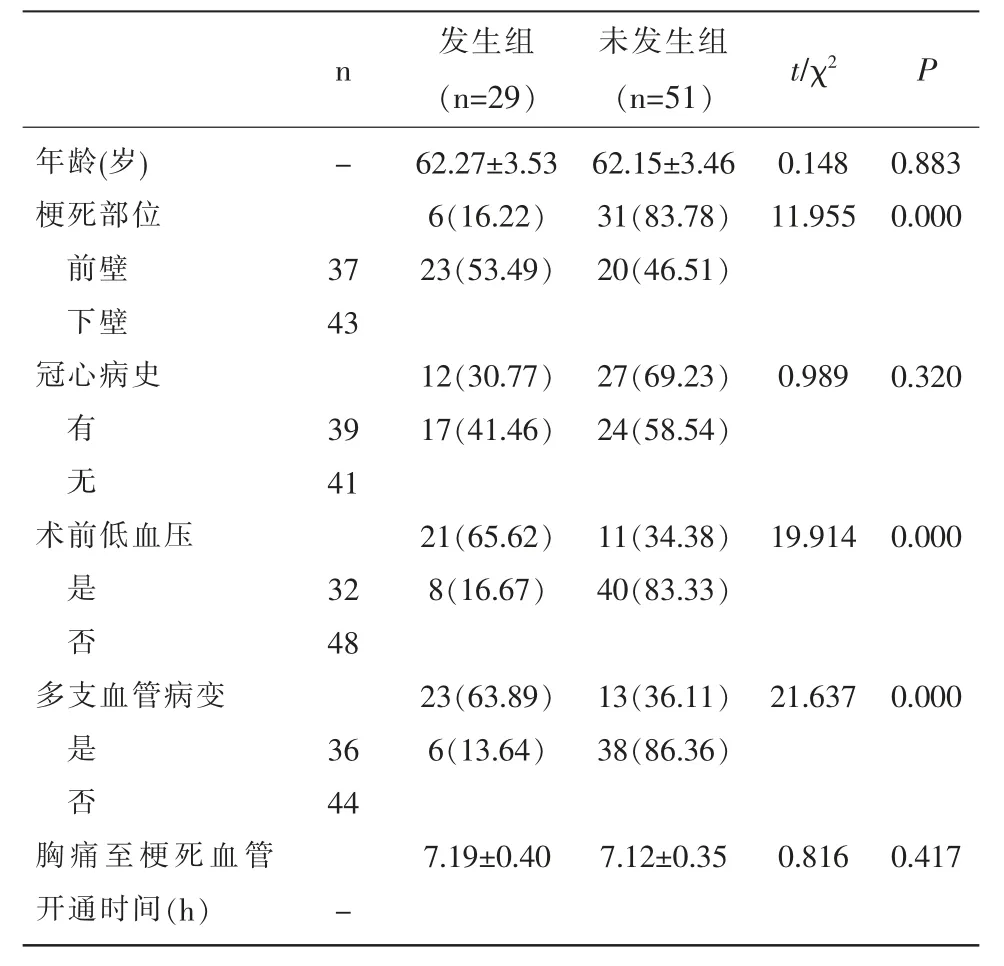
表1 AMI患者介入术后发生IRI的单因素分析

表2 自变量说明
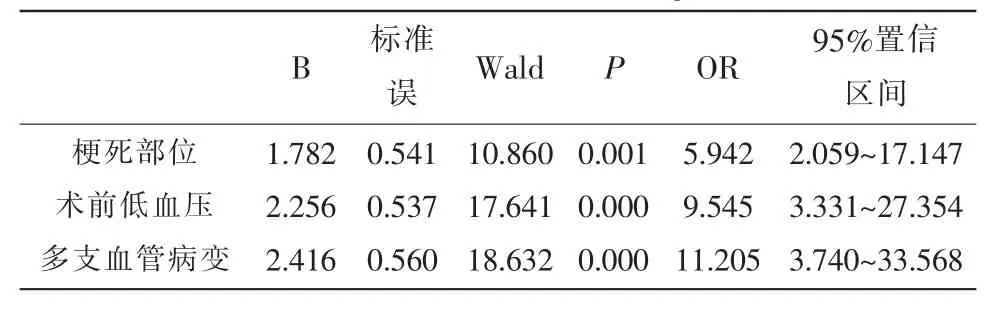
表3 AMI患者介入术后发生IRI的Logistic回归分析
3 讨论
AMI的发病机制较为复杂,多由管腔内血栓形成、粥样斑块破溃等因素综合作用导致,部分患者可出现低血压、心力衰竭甚至心源性休克[5,6]。经皮冠状动脉介入治疗是通过心导管技术疏通狭窄甚至闭塞的冠状动脉管腔,恢复心肌血流灌注的首选方案,但有部分患者可能会发生心功能不全、心律失常等IRI症状,严重威胁生命安全,故需积极探寻介入术后发生IRI的影响因素并给予对应的干预措施[7]。
本研究中,80例AMI患者介入术后IRI发生29例,发生率为36.25%,经初步单因素与Logistic回归分析发现,梗死部位为下壁、术前低血压、多支血管病变均是AMI患者介入术后发生IRI的影响因素。分析上述因素:(1)下壁梗死患者更容易发生IRI可能与下壁的神经分布有关,由于下壁梗死患者常累及后壁,导致心肌发生过亢的迷走神经反射,容易合并房室传导阻滞,造成相对性血容量不足,诱发冠状动脉内皮细胞线粒体缺血性肿胀,加重乳酸堆积,从而引起术后再灌注损伤。因此,临床医师应在介入治疗前应明确AMI患者的梗死部位,对于下壁梗死的患者可予以去甲肾上腺素以促使冠状动脉扩张,增强冠状动脉内皮细胞线粒体持续氧供给。(2)心肌缺血性损伤与术后IRI的表现常交织在一起,而术前低血压或休克可直接降低冠脉流量,从而加重心肌损害;同时,低血压还会影响血管紧张素转化酶抑制剂、钙离子拮抗剂及β-受体阻滞剂等药物效果,再灌注后难以保证局部微循环的开放与血液灌注,且微循环易感性与灌注期间乙酰胆碱含量的升高可造成血管扩张,故经皮冠状动脉介入手术后更容易发生IRI[8]。因此,术前应使用水银血压计复测,询问患者基础血压情况,对于术前低血压患者应及时处理,待血压恢复稳定后再进行手术。(3)多支血管病变:AMI患者的病变血管多为左前降支、左回旋支动脉或右冠状动脉,而存在两支或以上的血管病变可直接增加AMI的病情严重程度,血管粥样硬化面积更广泛,从而增加术后再灌注损伤发生的风险;同时,存在多支血管病变的AMI患者心肌细胞缺血更为严重,代谢物与氧气消耗增多,进而造成三磷酸腺苷不足,心肌纤维过度收缩,加重血管外压迫,故术后IRI发生率更高。因此,术前仔细检测患者的血管病变数量与类型,对于存在多支血管病变的患者手术应更为细致,术中、术后应密切监测患者生命体征,结合患者实际情况在必要时可选择溶栓或急症外科搭桥手术。
综上所述,术前低血压、下壁梗死、多支血管病变为AMI患者介入术后发生IRI的影响,临床可据此展开相应的干预措施以降低IRI的发生率。
