大血管血管炎发病机制中的遗传因素
2021-05-11杜丽虹李菁
杜丽虹,李菁
大血管血管炎(large vessel vasculitis, LVV)主要包括大动脉炎(Takayasu arteritis, TAK)和巨细胞动脉炎(giant cell arteritis, GCA)两种类型,是主要累及主动脉及其一级分支的慢性肉芽肿性血管炎,治疗主要是糖皮质激素联合免疫抑制剂或生物制剂,预后与器官缺血性损伤的严重程度有关。与TAK相比,GCA的好发人群较为年轻化,颅内外血管受累及主动脉瘤样扩张较多见,两者对生物制剂治疗反应也存在差别。
GCA是一种免疫介导的疾病,在GCA易感人群中,潜在的危险信号导致血管树突状细胞(vascular dendritic cells, vas DCs)受损,引起T细胞活化及一系列的炎症级联反应[1];TAK的发病机制与GCA相似,主要由辅助T细胞(helper T cell,Th)1和Th17介导DC引发的炎症级联反应,与GCA发病机制不同的是,可能存在未知的刺激导致热休克蛋白65kDA(heat shock protein 65 kDA, HSP-65)过表达,引起细胞表面蛋白MICA的表达,介导血管炎症和损伤[1]。TAK和GCA的病因和发病机制复杂,包括遗传学、体液及细胞免疫、细胞因子、环境、激素、炎症性肠病等炎性疾病等。这两种类型的大血管血管炎临床表现各有特点,在遗传机制上也不尽相同,本文对TAK和GCA发病机制中遗传因素的主要研究成果进行总结(表1,2)。
1 HLA基因区域
根据人类白细胞抗原(human leukocyte antigen, HLA)的编码蛋白结构和功能不同,将其分为Ⅰ类、Ⅱ类和Ⅲ类基因。
1.1 HLA-Ⅰ类基因区
经典的HLA-Ⅰ类基因包括HLA-A、HLA-B、HLA-C位点,非经典的HLA-Ⅰ类基因主要是主要组织相容性复合物Ⅰ类链相关基因A(major histocompatibility complex class Ⅰchain-related protein A, MICA)与GCA相关。
1.1.1 TAK与HLA-Ⅰ基因区
在TAK发病机制中,主要发挥作用的HLA-Ⅰ类基因是HLA-B,包括HLA-B*52和HLA-B*39。
HLA-B*52被认为是TAK发病的易感位点[2]。1977年,Naito等[3]发现并证实了HLA-B5及其Bw52亚型在日本人群中与TAK的发病密切相关。HLA-B*5201是中国、日本、韩国、土耳其、希腊(样本量较小)等国家TAK患者的共同易感基因,还与某些并发症密切相关,例如,在韩国TAK患者中与急性心肌梗死等心血管疾病显著相关[4];在日本TAK患者中与溃疡性结肠炎等炎症性肠病有关[5]。一项日本研究发现,位于HLA-B蛋白的肽结合槽的第171位组氨酸和第67位苯丙氨酸,与HLA-B*5201密切相关,其突变可能影响TAK的易感性[6]。
HLA-B*39在不同人群中的不同亚型与TAK发病相关:HLA-B*39061和HLA-B*39062亚型主要出现在墨西哥患者中[7];而日本患者则主要表现为HLA-B*3901和HLA-B*3902亚型[7];美国TAK患者则主要表现为HLA-B*3908[8]。
HLA-B*52与HLA-B*39061、HLA-B*39062内含子2的3′端末尾以及外显子3的5′端末尾部分基因序列相同,提示不同人群中易感基因的异质性,可能与一些特定的基因序列导致TAK发病有关[7]。
1.1.2 GCA与HLA-Ⅰ基因区
在西班牙GCA患者中,HLA-B*15的表达水平增高,主要通过影响T细胞的抗原呈递过程参与GCA的发病机制[9]。MICA位于MHC-Ⅰ类区域中,MICA A5是GCA发病的易感基因之一,与影响GCA发病的主要等位基因HLA-DRB1*04连锁不平衡[9]。同时存在HLA-DRB1*04和 MICA A5,或HLA-B*15和MICA A5,会导致GCA患病风险升高,且具有累加效应;而这些风险基因的缺失会对GCA起保护作用[9]。
1.2 HLA-Ⅱ类基因区
经典的HLA-Ⅱ类基因包括HLA-DR、HLA-DQ、HLA-DP,每个基因座分为A、B基因,分别编码HLA-Ⅱ分子的α链和β链。
1.2.1 TAK与HLA-Ⅱ类基因区
中国汉族人群中,TAK的易感性与HLA-DRB1*04[10]、HLA-DRB1*07[10]、HLA-DPB1*09[11]、HLA-DPB1*1701[11]等位基因相关,且HLA-DPB1*1701等位基因可能使TAK患者的发病年龄提前[11]。近期一项中国汉族TAK患者研究发现,HLA-DRB1*07表达水平增高,但HLA-DRB1*04与TAK的发病无明显关联,可能与该研究样本量较小有关(n=100)[12]。
1.2.2 GCA与HLA-Ⅱ类基因区
GCA的疾病易感性与HLA-Ⅱ类基因关系更密切,包括HLA-DRB1和HLA-DQA1,主要影响抗原呈递和免疫细胞自我识别。在一项英国研究中,HLA-DRB1*04的基因频率与患者的发病相关,而HLA-DRB1*01和HLA-DRB1*15可能对GCA发病具有保护作用[13]。结合数据库分析,HLA-Ⅱ蛋白的第一高突变区和第二高突变区中的第11、13和33位氨基酸残基,与HLA-DRB1在GCA中的易感性有关[13]。在欧洲人群中,HLA-DRB1*04∶01、HLA-DRB1*04∶04、HLA-DQA1*03∶01均可增加GCA的患病风险[14],其中与GCA易感倾向相关性最高的等位基因是HLA-DRB1*04∶04[14]。HLA-DRβ1蛋白第13位氨基酸和HLA-DQα1蛋白第47、56、76位氨基酸分别位于各自的肽结合槽中,直接参加与抗原肽结合的过程,可能与HLA-DRB1*04和HLA-DQA1*03在GCA发病中的易感性有关[14]。
1.3 HLA-Ⅲ类基因区
HLA-Ⅲ类基因区域位于HLA-Ⅰ类和HLA-Ⅱ类基因区域之间,主要编码炎症相关基因,包括补体系统、细胞因子以及热休克蛋白等成分。在大血管血管炎的遗传研究中,目前尚未发现TAK与HLA-Ⅲ类基因区之间的关联[15]。在西班牙GCA患者中,位于HLA-Ⅲ内的肿瘤坏死因子(tumor necrosis factor, TNF)基因区域有5个微卫星基因座a、b、c、d、e,其中TNF-a2微卫星基因座与GCA的发病相关,该基因座对GCA发病的影响与HLA-DRB1*04无关[16]。
2 非HLA基因区
近年来,非HLA基因区成为大血管血管炎易感性研究的热门领域,并取得了重大进展。主要分为两类:(1)调节免疫应答相关基因,主要包括:蛋白酪氨酸磷酸酶非受体22型(protein tyrosine phosphatase non-receptor type 22,PTPN22)、IgG的Fc片段受体Ⅱa(Fc fragment of IgG receptor IIa, FCGR2A)、IgG的Fc片段受体Ⅲa(Fc fragment of IgG receptor Ⅲa,FCGR3A)、v-rel网状内皮增生病毒癌基因同源物(v-rel avian reticuloendotheliosis viral oncogene homolog, REL)、脯氨酰4-羟化酶α多肽Ⅱ(prolyl 4-hydroxylase subunit alpha2,P4HA2)、纤溶酶原(plasminogen, PLG)、富含亮氨酸重复序列的蛋白32型(located in the leucine-rich repeat containing 32,LRRC32)、白细胞免疫球蛋白样受体亚家族 (leukocyte immunoglobulin-like receptor subfamily, LILR),可通过调节T/B细胞及其功能影响GCA的发病[14-15, 17-19];(2)参与炎症反应相关基因,主要包括:白介素17A(Interleukin 17A,IL17A)、炎性小体1基因(inflammasome 1,NLRP1)、白介素12B(Interleukin 12B,IL12B)、白介素6(Interleukin 6,IL6),通过影响炎症相关细胞因子参与GCA的发病机制[17-18, 20-21]。
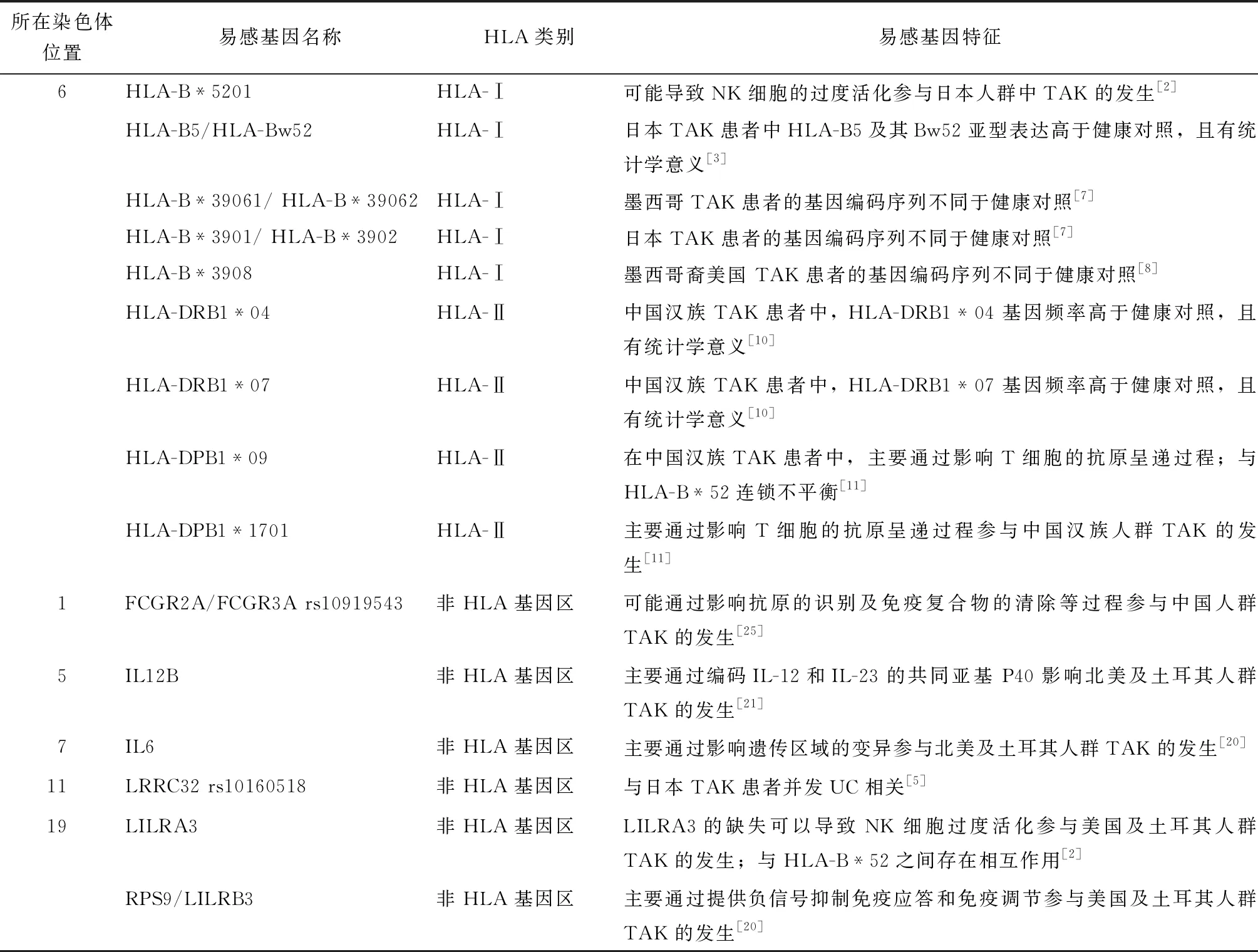
表1 大动脉炎主要易感基因
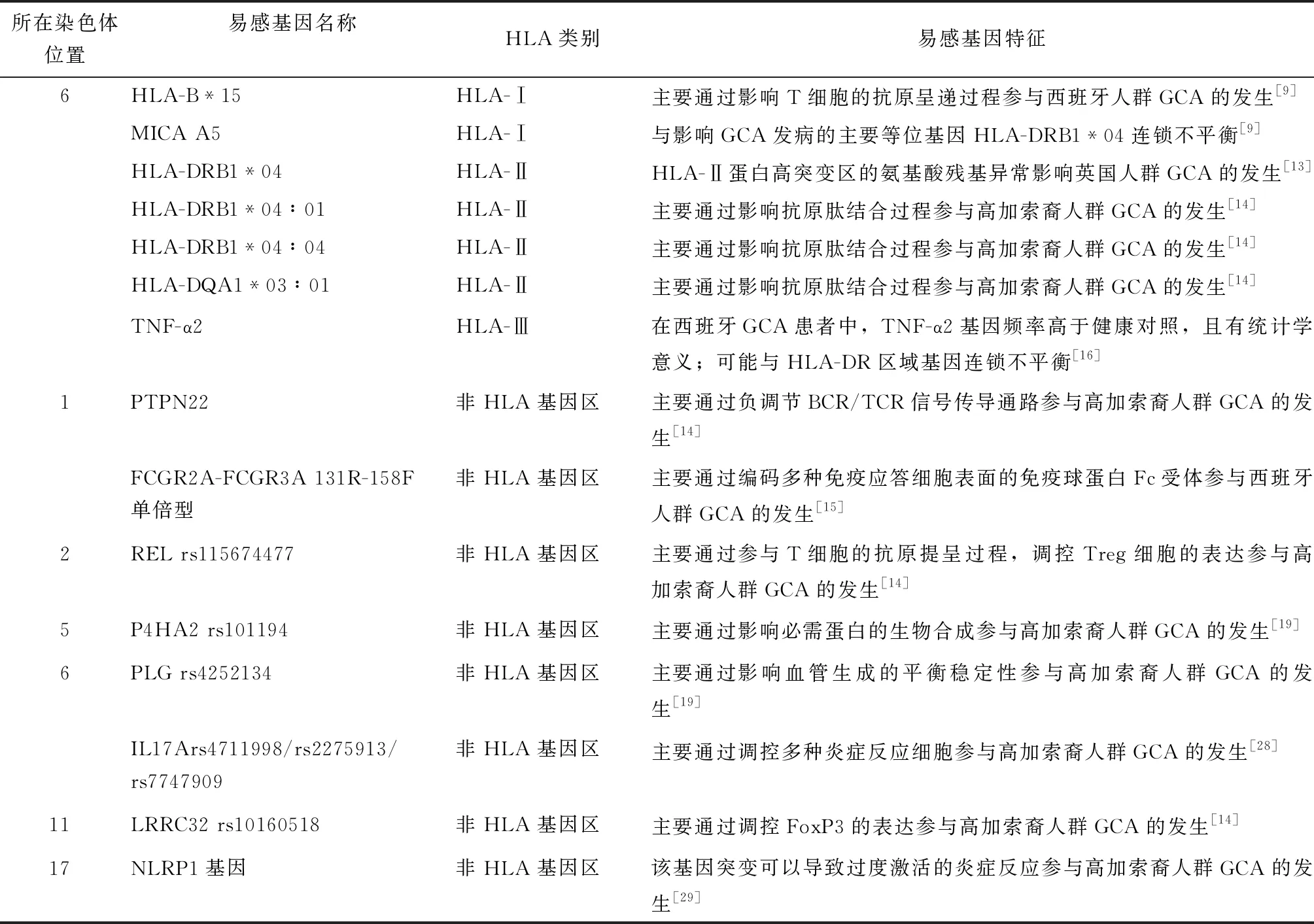
表2 巨细胞动脉炎主要易感基因
2.1 TAK与非HLA基因区
IL12B基因位于5号染色体,编码IL-12和IL-23蛋白共同的β亚基p40[22],IL-12是促进幼稚T细胞向Th1分化的关键因素,而IL-23主要影响Th17细胞的分化[22]。IL12B rs6871626在日本人群中与TAK的疾病易感性有显著关联,可能与TAK疾病严重程度有关[21]。IL12B rs56167332和IL12B rs6871626在北美及土耳其人群中也显示出与TAK发病存在较强的关联性[23]。
IL6基因位于7号染色体,编码细胞因子IL-6。IL6基因的内含子上有一个增强子调控区域,该遗传区域的变异是TAK发病的危险因素之一[20]。在TAK患者中检测到血清IL-6的水平显着升高,抗IL-6受体拮抗剂(tocilizumab)治疗难治性TAK患者有效,提示IL-6参与TAK的发病机制[20, 24]。
LILR基因家族定位于19q13.4的白细胞受体复合物(LRC)区域,由13个激活性或抑制性受体成员组成,其中LILRA3是唯一的分泌型LILR,是其他LILR家族成员的调节剂[2]。LILRA3与HLA-B*52之间存在相互作用,LILRA3的缺失可以导致NK细胞过度活化,从而导致TAK的发生发展[2]。RPS9/LILRB3基因座通常通过提供负信号来抑制免疫应答和免疫调节,增加了美国及土耳其人群的TAK发病风险[2, 20]。
此外,FCGR2A/FCGR3A rs10919543在中国人群中与TAK的易感性相关[25];LRRC32 rs10160518与TAK患者并发溃疡性结肠炎有较强的相关性[5, 14]。
2.2 GCA与非HLA基因区
PTPN22基因位于1号染色体上,编码一种蛋白酪氨酸磷酸酶(Lyp),PTPN22 rs6679677/rs2476601主要通过负调节BCR/TCR信号传导通路而影响GCA的发生[14]。在高加索裔人群中,PTPN22与GCA强关联[14]。PTPN22 rs2476601(R620W)和PTPN22 rs33996649(R263Q)在西班牙GCA患者的遗传易感性中发挥着重要作用[26]。
FCGR2A和FCGR3A基因也位于1号染色体上,是免疫球蛋白基因超家族成员,编码多种免疫应答细胞表面的免疫球蛋白Fc受体影响GCA的发病[15]。FCGR2A-FCGR3A 131R-158F单倍型是与西班牙GCA患者相关性最强的易患基因,FCGR2A-131R等位基因纯合个体与不携带该等位基因的人群相比发生GCA的风险增加[15]。FCGR2A-131R的纯合性与HLA-DRB1*04阳性之间可能存在乘法联合效应[15]。
REL基因位于2号染色体上,编码NF-κB家族的c-Rel转录因子,参与T细胞的抗原提呈过程,调控调节性T细胞(Regulatory cells,Treg)的表达从而参与GCA的发病[14]。REL rs115674477在欧洲人群中与GCA的发病呈现出较强的关联性[14]。
P4HA2位于5号染色体上,编码4-脯氨酰羟化酶α亚基Ⅱ蛋白,催化脯氨酸残基形成4-羟脯氨酸(胶原生物合成所必需)。P4HA2是重要的缺氧反应基因,其表达受缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)调控[19]。因此,P4HA2基因可能影响GCA的纤维化、炎症、血管重塑等病理生理过程。P4HA2 rs101194可能影响其在主动脉中的表达[19]。
PLG位于6号染色体上,编码一种血液酶原蛋白,PLG水解激活后可以转化为纤溶酶和血管抑素。纤溶酶是血管形成、淋巴细胞募集等过程中的重要蛋白酶,而血管抑素主要抑制血管生成[19]。PLG可能通过影响纤溶酶和血管抑素在血管形成过程中的相对稳定性,从而导致GCA的发生[19]。PLG内含子中的rs4252134是PLG与GCA关联性最强的位点[19]。PLG也与ANCA相关性血管炎和冠状动脉粥样硬化性心脏病相关[27],机制与PLG在GCA中的作用机制假说相似。
LRRC32 位于11号染色体上,在活化T细胞中高表达,主要通过调控转录因子叉头框蛋白P3(forkhead box P3,FoxP3)的表达而发挥作用,FoxP3主要调节Treg的发育和功能,LRRC32 rs10160518与GCA的发病密切相关[14]。
Th17在GCA的发病机制中起重要作用,Th17细胞通过产生IL-17诱导慢性炎症,IL-17激活多种表达其受体的细胞,如树突状细胞、巨噬细胞、内皮细胞和平滑肌细胞等,这些细胞参与了GCA的动脉损伤过程[28]。IL17A位于6号染色体上,编码细胞因子IL-17。IL17A上的三个单核苷酸多态性(single nucleotide polymorphism, SNP):rs4711998、rs2275913、rs7747909,增加了高加索裔人群GCA的遗传易感风险,其中rs2275913的关联性最强[18]。
炎性小体是在细胞中形成的多聚蛋白复合物,是人体中的一种应对感染原和异常生理变化的重要防御机制。NLRP1基因位于17号染色体上,参与形成NLRP1炎性小体。NLRP1基因突变可以导致过度激活的炎症反应,该突变是多种自身免疫性疾病常见的危险因素[29]。NLRP1基因与高加索裔患者的发病相关,而NLRP1 rs8182352与GCA患者的缺血性视神经病变有关[17]。
3 小结与展望
大血管血管炎发病机制遗传方面的研究发现,HLA基因区和非HLA基因区在发病机制中均有参与。在大动脉炎中,主要是HLA-Ⅰ类分子发挥主要作用,其中HLA-B*52在不同国家的多种族患者中均表现出明显的相关性;参与炎症反应的相关基因IL12B、IL6、RPS9/LILRB3等也发挥重要作用。在巨细胞动脉炎中,主要是HLA-Ⅱ类分子发挥主要作用,其中HLA-DRB1*04∶04和HLA-DQA1关系最为密切;PTPN22等非HLA基因也发挥重要作用。 GCA与TAK在遗传基因上存在差异,可能与两者临床表现及发病机制的差异相关,为进一步研究大血管血管炎的发病机制及治疗提供新的思路,为基因治疗等新疗法提供理论依据。
